
速康解毒口服液是由中国农业科学院兰州畜牧与兽药研究所和西藏农牧科学院联合研制的针对动物疯草中毒的专利产品,由酵母甘露聚糖、正磷酸钠、硫酸镁和L-鼠李糖按一定比例组成,其对α-甘露糖苷酶的合成具有良好的诱导作用,可有效解除由疯草中毒引起的动物慢性神经机能障碍,有效保护动物的生长发育和畜种改良[1].本试验旨在研究小白鼠急性毒性和亚急性毒性,为该制剂的安全性评价和临床安全剂量的筛选提供依据.
1材料与方法
1.1试验材料
1.1.1 主要试剂及仪器 Sysmex F2820型全自动血常规分析仪(日本东亚公司产品),乙醇(AR).血糖(GLUC),货号YZB262-40-2010;总蛋白(PROT),货号A045-2;白蛋白(ALB),货号A028-1;总胆固醇(CHOL),货号YZB0397-2012;总 胆 红 素 (TBIL),货 号C018;碱 性 磷 酸 酶(AKP),货号A059-2;肌酐(Cr),货号C011-1;尿素氮(BUN),货号C013-2;谷草转氨酶(AST),货号C010-1.试剂盒均由南京建成生物工程研究所提供.
1.1.2 试验动物及饲养环境 SPF级生理状况正常的Wista小白鼠由兰州大学实验动物中心提供,体质量为(17.6±1.0)g.动物房及实验室温度为(24.0±1.0)℃,光照黑暗每12h更替.试验小白鼠于试验前在动物房适应一周,塑料笼饲养,每周更换垫料3次,自由摄食摄水.
1.2试验方法1.2.1预试验预试验前对小白鼠进行7d喂养观察,观察期内小白鼠自由饮水、采食,每日空腹称量体质量,淘汰自然死亡小白鼠.预试验期内选取40只小白鼠,随机分为5组,每组8只,雌雄各半,按200、400、800、1 600mg/kg剂量1次性灌胃给药,确定正式试验的剂量范围.
1.2.2急性毒性正式试验另取20只小白鼠,随机分为2组.给药组以最大质量浓度 (1.0g/mL)、最大容积(0.8mL)1次性灌胃受试药物,对照组用等体积生理盐水,给药后连续观察7d,测定最大给药量.正式试验时,将小白鼠随机分为4组(对照组和3个给药组,给药组药剂量分别为3 200、1 600和800mg/kg),每组10只,雌雄各半,共40只.灌胃前后6h禁食(自由饮水),试验组均按每只小白鼠的体质量计算给药量,金属灌胃器一次性灌胃给药.对照组小白鼠保持自由采食和饮水.给药后每天观察小白鼠的采食、饮水、死亡、精神、被毛和自主活动等,连续观察7d.及时解剖死亡小白鼠,记录病变情况,并在第8天称量所有小白鼠体质量并解剖,观察腹腔内液体情况和实质性器官的病理变化[2-7].
1.2.3 亚慢性毒性试验取小白鼠80只,随机分为4组,每组20只,雌雄各半.分为高、中、低3个剂量组,灌胃剂量分别为3 200、1 600和800mg/kg;对照组每日定时灌胃等量9g/L生理盐水.各组连续灌胃30d,停药后再持续观察14d.
观察给药期间小白鼠的一般状况,根据小白鼠一般健康体征外观评价标准判定小白鼠的健康状况[8-9],若小白鼠两眼有神,被毛光洁,对刺激敏感,对环境敏感,则判定为Ⅰ级;被毛微乱,失去光泽,小白鼠仍然警觉活跃,判定为Ⅱ级;被毛显着凌乱,部分成簇,小白鼠不再警觉活跃,对笼外环境敏感性差,当触摸时出现强力呼吸体征,判定为Ⅲ级;小白鼠弯腰拱背,困倦,对环境不敏感,被毛凌乱成簇,判定为Ⅳ级;小白鼠对刺激无反应,被毛呈瓶刷状,站立不稳,小白鼠弯腰,倦怠,嗜睡,触摸皮毛,爪反应麻木,判定为Ⅴ级.
每周测定小白鼠体质量变化情况,死亡小白鼠及时剖检.于停药后第1天和第14天,各组随机抽取10只采血,EDTA二钾盐抗凝,立即用Sysmex F2820型全自动血常规分析仪测定红细胞数、白细胞总数、淋巴细胞、血小板数和血红蛋白含量.于停药后第1天和第14天,每组随机抽取10只采血,分离血清,用试剂盒测定谷草转氨酶、碱性磷酸酶、尿素氮、肌酐、总蛋白、白蛋白、血糖含量.于停药后第1天每组随机抽取3只,停药后第14天剖检剩余小白鼠,采集心、肝、脾、肺、肾,计算脏器系数.对剖检发现有病理变化的脏器,进行病理组织学观察.
2结果与分析
2.1急性毒性试验
经口1次灌服"速康解毒口服液"后,各试验组小白鼠均未见死亡病例,按寇式改良法不能计算出该制剂的半数致死量(LD50).该结果表明,"速康解毒口服液"的LD50>16 000mg/kg,按药物毒性分级标准,可认为该药物无毒.
2.2最大给药量的测定
根据新兽药申报资料规范,未能检测出LD50的产品需开展最大给药量试验.根据最大给药量的试验方法,按40.0g/kg剂量单次灌服速康解毒口服液后,个别小白鼠蜷缩在角落,活动减少,次日所有小白鼠精神、活动、饮水和采食均转为正常,7d后所有小白鼠均健康存活.同时,处死两组试验小白鼠,剖检心脏、肝脏、脾脏、肺脏、肾脏,肉眼观察均未见异常变化,结合观察结果可知,小白鼠的最大给药量(MTD)为40.0g/kg,相当于临床用药量(0.1g/kg)的400倍,说明合理剂量内使用"速康解毒口服液"无毒性作用.
2.3亚慢性毒性试验
2.3.1药物对小白鼠一般症状的影响
按照3 200、1 600和800mg/kg的剂量给试验小白鼠每天经口灌胃给药1次,连续30d,试验期内对照组和试验组小白鼠均未观察到明显的异常反应和中毒症状,采食、饮水、排尿、排粪均正常,生长发育情况良好,根据标准判定健康级别为Ⅰ级.
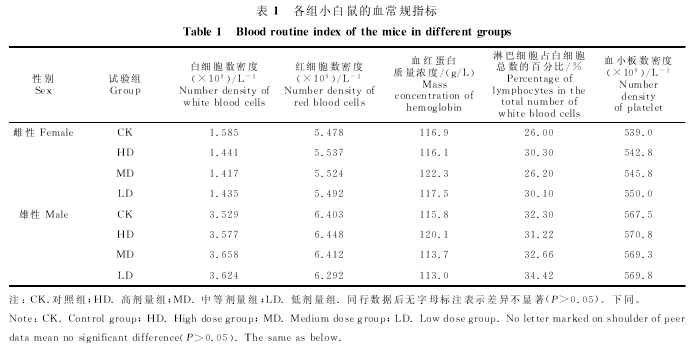
2.3.2 试验药物对小白鼠血液常规指标的影响
由表1可知,连续给药30d后,"速康解毒口服液"高、中、低剂量组的小白鼠血常规指标与对照组相比差异均不显着(P>0.05),表明,"速康解毒口服液"对小白鼠血红蛋白、白细胞、红细胞、血小板等未产生显着影响.
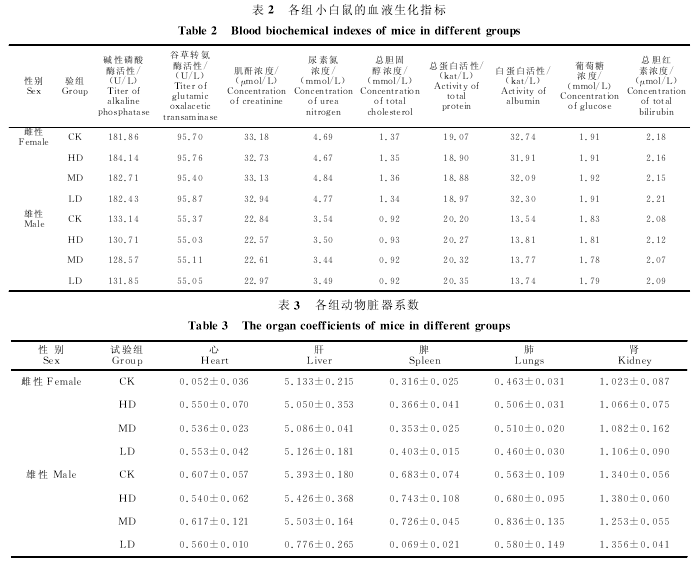
2.3.3 试验药物对小白鼠血液生化指标的影响
由表2可知,连续给药30d后,"速康解毒口服液"高、中、低剂量组的小白鼠血液中与代谢相关的生化指标与对照组相比差异均不显着(P>0.05).说明试验药物对小白鼠的肝脏、肾脏功能无不良影响.
2.3.4 试验药物对小白鼠的脏器系数的影响
停药后第1天和第14天的剖检结果显示,各组小白鼠心、肝、脾、肺、肾的形态、颜色、质地均正常,无明显肉眼可见病变,各组间小白鼠的心脏、肝脏、脾脏、肺脏、肾脏、胸腺系数差异均不显着(P>0.05)(表3).说明,合理使用"速康解毒口服液"不会导致动物实质脏器损伤或异常变化.
3讨 论
3.1"速康解毒口服液"的急性毒性评价
急性毒性试验是确定中毒作用方式、中毒反应,以及为亚急性和慢性毒性试验观察指标及剂量分组提供参考的重要依据,也是新药生物安全评价的重要指标[10].本试验中,急性毒性试验因受"速康解毒口服液"溶液质量浓度和体积的影响,无法给予动物更大剂量的药物,无法测出半数致死量LD50.根据药物毒性分级标准,LD50>16 000mg/kg时,药物可视为为无毒.根据中国新兽药研发规范与申报指南,对无法测出LD50的药物需分析其最大给药量,一般检测动物单次或24h内2~3次服用最大剂量药物后的反应[11].本试验中,小白鼠单次经口灌服剂量为40.0g/kg的"速康解毒口服液"后,一周内体况良好,未见死亡病例,剖检脏器均未见肉眼异常改变.表明临床合理使用药物不会对靶动物造成不良毒性影响,"速康解毒口服液"最大给药量可定为40.0g/kg.
3.2"速康解毒口服液"的亚慢性毒性评
本研究选用无疯草中毒病的健康小白鼠作为试验动物,以考察"速康解毒口服液"本身是否具有毒性作用及其毒性作用的强弱.小白鼠30d喂养试验是评价药物或毒物亚慢性危害的主要依据,本试验受药物最大质量浓度溶液制备的限制,选择3 200、1 600和800mg/kg 3个剂量组,分别是靶动物推荐剂量(0.4g/kg)的8、4和2倍,达到最低限量要求.试验结果显示,3个剂量组小白鼠的血液常规、血液生化指标、脏器系数与对照组间均无显着差异(P>0.05),各脏器亦无组织病理学异常变化.表明在合理疗程范围内,药物"速康解毒口服液"不会对受试动物产生慢性的毒性作用.
4结 论
小白鼠急性毒性试验和小白鼠亚慢性毒性试验结果表明,速康解毒口服液本身无毒性;按临床推荐剂量使用速康解毒口服液药治疗动物疯草中毒,安全可靠,对动物机体无毒副作用,可在兽医临床推广应用.
Reference(参考文献):
[1]YANG Xianpeng(杨贤鹏),HAO Baocheng(郝宝成),LI-ANG Jianping(梁剑平),et al.Research advances in the de-toxificating preparation of swainsonine in"Locoweed"andits application to anti-tumor[J].Journal of Anhui Agri Sci(安徽农业科学),2012,40(5):2664-2665,2668(in Chinesewith English abstract).
[2]XIANG Meng(相猛),SHI Guangliang(石 广 亮),LUYangang(鲁延刚),et al.Acute toxicity of total alkaloids ofAmmopiptanthus mongolica seeds to mice[J].Journal ofGansu Agricultural University(甘肃农业大学学报),2012,47(1):49-52(in Chinese with English abstract).
[3]LEI Hongdong(雷宏东),LIANG Jianping(梁剑平),GUOZhiting(郭志廷),et al.Study on the acute toxicity of Di-chroa febrifugaextractive[J].China Animal Husbandry& Veterinary Medicine(中国畜牧兽医),2011,38(6):236-238(in Chinese).
[4 CHEN Yi(陈燚),CHEN Chao(陈超).Subchronic oraltoxicity study of Daohuaxiang Vigor Liquor(DVL)in wist-ar rats[J].Liquor-Making Science & Technology(酿酒科技),2008(8):43-46(in Chinese with English abstract).
[5]SHI Dongxia(石东霞),JIANG Zhongrong(蒋忠荣),YINZhongqiong(殷中琼),et al.Studies on the subchronic oraltoxicity of neem oil in mice[J].Chinese Veterinary Science(中国兽医科学),2011,41(1):79-84(in Chinese with Eng-lish abstract).
[6]LIU Hongmei(刘 红 梅),ZHENG Aihua(郑 爱 华),CAIGuangxian(蔡光先).Long-term toxicity testing of ChaoweiSini Decoction on rats[J].Chinese Archives of TraditionalChinese Medicine(中华中医药学刊),2012,30(4):776-779(in Chinese with English abstract).
[7]QU Falin(瞿发林),GUO Wei(过伟),SUN Yuanqi(孙元琪),et al.Study on acute toxicity test of Rukang oral liquid[J].Journal of Strait Pharmaceutical(海峡药学),2012,24(1):32-34(in Chinese with English abstract).
[8]YUAN Bojun(袁伯俊),LIAO Mingxu(廖明旭),LI Bo(李波).Drug toxicology experiment method and technology(药物毒理学实验方法与技术)[M].Beijing:Chemical In-dustry Press,1997(in Chinese).
[9]ZHU Beilei(朱 蓓 蕾).Animal Toxicology(动 物 毒 理 学)[M].Shanghai:Shanghai Scientific and Technical Publish-ers,1989(in Chinese).
[10]XU Shuyun(徐叔云),BIAN Rulian(卞如濂),CHEN Xiu(陈修).Methodology of Pharmacological Experiment(药理实验方法学)[M].Beijing:People's Medical Pub-lishing House,2005(in Chinese).
[11]WANG Dongsheng(王东升),XIE Jiasheng(谢家声),LIShihong(李世宏),et al.The acute toxicity of Gongyijingtincture[J].Hubei Agricultural Sciences(湖北农业科学),2011,50(2):346-352(in Chinese with English abstract).
猪丹毒病是由猪丹毒杆菌引起的一种急性、热性传染病,该病多发在夏秋和霉雨季节,2月龄以上的猪最易感染,潜伏期短的为3~5d,长的大半月之久。如不积极预防和治疗病死率很高,人也可感染本病,人感染猪丹毒杆菌所致的疾病称为类丹毒,多是由皮肤损伤感染引...
引言【研究意义】血液中的血糖(glucose,GLU)循环全身,对人体具有重要的生理功能,是反映机体生理状况的一个重要指标。空腹血糖浓度(fastingserumglucose,FSG)是糖尿病临床诊断的常规指标,也是糖尿病诊断后10年内因心血管疾病死亡的独立预警指标...
0、引言【研究意义】促性腺激素抑制激素(gonadotropin-inhibitoryhormone,GnIH)是Tsutsui等于2000年在鹌鹑下丘脑内分离到的一种神经肽,哺乳动物的类似物为RF酰胺相关肽(RFRP)。具有抑制促性腺激素分泌和影响性行为、摄食、生长激素分泌等作用...
针对微生态制剂在畜牧兽医的运用, 从动物疾病防治、促进动物生长、环境污染治理、畜牧产品品质优化4个方面展开论述, 明确微生态制剂的作用, 希望能够为今后畜牧兽医发展提供有价值的参考, 推动我国食品行业发展。...
畜牧兽医农业技术可以有效地提高农民畜牧养殖的效益,为农民实现增收带来重要影响。因此,要大力发展畜牧兽医农业技术,就必须做好相关推广工作。...
谷胱甘肽过氧化物酶(Glutathioneperoxidase,EC1.11.1.9,简称GPx)是生物机体组织中存在的3种重要的抗氧化酶之一,也是一种重要的含硒酶,硒是该酶活性中心的构成成分;它的生物学作用主要是清除脂质氢过氧化物,并在过氧化氢酶含量很少或H2O2产量很低的组...
在多年的临床实践中,笔者运用顺气孔插枝疗法治疗牛、羊的角膜炎、结膜炎、瘤胃膨气、不反刍等,猪的消化不良、胃肠炎、感冒、四肢风湿麻痹、鼻炎、便秘、喘气等多种疾病,共198例,取得了较好的疗效。一、治疗方案1.顺气孔开孔位置。牛、羊、猪均在上腭齿...
乳腺炎(mastitis)是奶牛最常见的生产性疾病,给奶牛业造成了巨大的经济损失[1].奶牛乳腺炎分临床型和隐性乳腺炎两种,临床型乳腺炎以乳房红肿热痛、乳腺组织损伤为主要特征[2],而隐性乳腺炎虽无可见临床症状,但在大部分牛场存在,危害更大。奶牛罹患乳腺...
从目前基层畜牧兽医动物防疫工作的实际情况来看,仍存在一些问题,包括动物防疫意识比较薄弱、专业畜牧兽医防疫人员比较缺少、技术较低、资金短缺、养殖户综合素养较低等。...
对乙酰氨基酚(paracetamol,acetaminophen,apamid,APAP)又名扑热息痛,为乙酰苯胺类解热镇痛药。美国、英国、日本等国的《药典》和《中国药典》均已收载此药,是全世界应用最广泛的药物之一。该药现在主要应用的剂型是片剂和胶囊剂,兽医临床多用注射剂。A...