摘 要: 针对新药研发的途径主要有两种:一种为从头开始合成,另一种为药物重定位。前者从思路的确定到药物批准上市需要耗费大量的人力物力;而后者是指发现目前已经上市药物的新适应症,它不仅是目前新药研发中风险与效益比较好的手段,还是解决新药研发高投入高风险低回报困境的有效策略。目前,被FDA批准上市的重定位药物已有上百种,针对抗菌药物、抗病毒药物以及抗癌抗肿瘤药等研究也越来越多。本文主要针对药物重定位在新药研发中的研究进展进行阐述,阐明目前关于重定位药物的研究报道以及应用前景。
关键词 : 药物重定位;新药研发;研究进展;
Abstract: There are two main approaches to new drug development: one is synthesis from scratch, and the other is drug repositioning. The former requires a lot of manpower and material resources from the determination of ideas to the approval of drugs on the market, while the latter mainly refers to the discovery of new indications of drugs already on the market, which is not only strategy with low risks and high benefits in the current new drug research and development. It is also effective means to solve the dilemma of high investment, high risk and low return in new drug research and development. At present, there are hundreds of drugs that have been successfully repositioned, and more and more researches are being conducted in the fields of antibacterial drugs, antiviral drugs, and anticancer and antitumor drugs. This article focuses on the potential of drug repositioning describes the progress in new drug research and development, and clarifies reports about the relocation of drug research and application prospects.
Keyword : drug repositioning; new drug development; research progress;
尽管现在制药公司对新药研发的投入大幅增加,但是推向市场的新药数量却有所下降,主要是由于新药开发困难,耗费时间久,并且需要面临高成本和高风险,这使得很多制药公司望而却步。在这种情况下,一个新思路——药物重定位(drug repositioning)引起了大家的广泛关注,并且成为药物发现的重要途径。药物重定位又称为“老药新用”是指已批准上市的药物发现其新的适应症或新用途,主要针对正处于临床研究阶段或已批准上市的药物[1]。在通常情况下,新药的研发从确定思路到药物获得批准上市需要15~20年,且成功率低,风险也高[2];而药物重定位只需3~15年,安全性显着提高,研究中出现的不确定性减小,使得研发的时间缩短、风险也显着降低[3]。此外,重定位药物的临床前、药代动力学、药效学和毒性等相关数据可查询,这样使得研发的药物可以迅速转化为临床研究的后期阶段,从而降低开发成本,以此获得更好的投资回报。
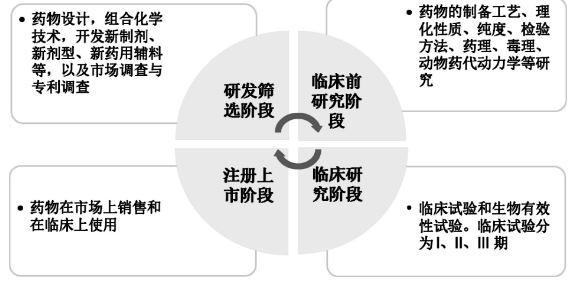
1 、新药开发的过程
药物研发从思路确定到获批上市需要经历以下几个过程:首先为研发筛选阶段,其中包括市场调查、专利调查等;其次为临床前研究;再次为临床阶段;最后为新药获批上市(见图1)[4]。
图1 新药开发过程图
2、 药物重定位的途径
药物重定位的生物学依据为一个药物对应两个及以上的作用靶位(一药多靶)和一个靶位对应两个及以上的疾病治疗(一靶多治)[5,6]。目前,药物重定位研究的主要方法有两类,一是高通量和高内涵筛选,二是基于计算机的虚拟筛选和生物计算;而其中以药物为中心的重定位研究所建立起来的高通量筛选技术需要购置专门的仪器设备,开发和购买特定的试剂盒,开展专门的数据分析和挖掘工作,还需投入大量专业技术人员,这就需要投入较高的成本并且只能对较少的药物进行筛选,筛选结果也会受到药物的化学性质、稳定性等因素的影响[7,8]。根据研究策略的不同,可以将基于计算机的药物重定位研究方法分为三类:一是基于小分子(或配体)特征,即针对特定的药物或化合物,预测新的潜在靶点或药物-靶点相互作用;二是基于药物靶点(核酸、蛋白、酶、离子通道和受体等)的特征,即针对某一特定靶点而预测新药、目标化合物或药物-靶点相互作用[7];三是基于表型的特征,即通过药物-靶点网络预测药物-靶点相互作用[9,10]。
2.1、 基于小分子(或配体)技术
相似性结构搜索和定量构效关系(quantitative structure - activity relationship, QSAR)是基于小分子(或配体)的药物重定位研究方法主要内容。相似结构搜索是指通过计算机大数据进行比较,发现具有相似结构分子可结合到同一靶点位置,并推测这些配体具有相似的生物学功能和药理作用,同时该方法用于搜索不同生物大分子的药物可能具有相似的生物结构域,并且有相似的作用靶点,可用于预测一些药物的未知靶点[11]。
定量构效关系(QSAR)是指根据已有药物的理化性质和结构参数,通过计算机的模拟研究定量得到有机分子和生物大分子之间相互作用、药物在生物体内的吸收、分布、代谢、排泄等生理相关性质的方法[12]。定量构效关系通常被用于药物的研发,并在分子信息与生物活性以及其他理化特性相关联方面具有广泛应用[13]。
2.2 、基于药物靶点的技术
基于药物靶点的重定位技术主要是指针对某一特定药物靶点来预测新药或目标化合物,该方法可用于药物-靶点亲和力预测、药物-靶点相互作用预测等[14]。使用此技术对目前已知其生物活性但作用机制不清楚的候选药物可以预测其存在的潜在靶点;但对于作用机制已经明确的药物可通过反向对接探索药物的次级靶点,将其用于药物重定位,也称为反向分子对接技术[15]。
2.3、 基于网络或表型的技术
基于网络或表型研究技术的基础是一药多靶、一靶多药或多个药物-靶点相互作用可形成网络的理论,这种生物学现象最直接的证据就是通过药物-靶点的联系,经定量分析发现,多数药物或靶点呈现出多样性,即一个药物对应多个靶点,且一个靶点又对应多个药物[14]。基于复杂的网络理论,已有高级推理算法应用于药物重定位研究[16,17]。
基于药物作用相似性推理,推断药物是否共用一个靶点,并且阐明新的药物-靶点相互作用[18]。
基于靶点相似性推理,一般采用以下策略: 一是对基因表达谱相似性的扰动,二是对基因表达标签相似性的扰动,两种方法均需要首先获得待研究药物的基因表达谱[19]。
基于药物网络相似性,主要依靠药物-靶点结合的拓扑学相似性来探知药物的新的靶位点[20]。
综合运用以上三种推理方法来进行药物重定位研究,能够提高预测的准确性,但也存在缺点,在使用时应当根据筛选内容做出合理安排。
3 、适用于重定位的药物
在目前所熟知的药物产品概念中,药物产品包括的范围很广,在各国各地药品管理局登记的处方药以及非处方药,不同厂家生产的同一类或同一种药物,或同一厂家生产的同一种药物的不同剂型以及不同的包装都被认为是不同的药物产品。目前能够查阅到的在美国FDA登记的药物产品就已经超过了10万种。而人们通常说的“药物”主要是指由药品管理局批准的含有一种或多种活性药物成分的处方药或非处方药,根据这个要求能查询到的药物约2.5万种,其中被美国FDA批准的药物约1万种[21]。“活性药用成分”(active pharmaceutical ingredient, API),又叫做“原料药”,通常指由化学合成、植物中提取或生物技术所制备得到,无法直接服用的物质,需要再经过添加辅料、加工,才可直接使用的药物[22]。据统计,全球API约1万个,其中FDA批准使用的超过了5 000个[23]。化学实体(chemical entity, CE),是指化学骨架独特的物质,即结构与已知所有其他物质的结构都不同的分子,据统计,分子实体超过了4 000个,其中FDA批准的达2 500个[24]。
高通量筛选是目前比较高效和快速评价药物活性和毒性的方法,但其使用时存在部分缺点,所以在考虑应用高通量研究方法评价药物对新适应证的活性时,应针对化学实体,且这些化学实体还应满足以下几个要求:一是能溶解于水或 DMSO,二是常温下可以长时间稳定保存,三是为体内活性形式。符合上述要求的CE约2 800个,其中FDA批准的约1 850个[24]。
以上FDA批准的药物均可以用于进行药物重定位筛选,但在进行筛选时应考虑使用哪种筛选方法。
4、 药物重定位的应用
就目前来说,被美国FDA批准上市的重定位药物有一百多种,且很多重定位药物在新适应症上表现良好。
4.1、 重定位抗菌药
随着抗生素的大量使用导致了严重的细菌耐药性,超级细菌的出现也给抗生素滥用敲响了警钟,细菌对传统抗生素的耐药性是当今世界卫生面临的最严重问题之一。解决这种需求的有效方法是研发出新的具有抗菌能力的药物。在过去几年中,新的抗菌药物在人类医学中的发展速度大大减慢,在兽医学中这种缓慢情况更为严重[25],而“老药新用”或又被称作药物重定位的想法为解决抗菌药物的耐药性提供了一种新的思路和方法。
双硫仑是一种戒酒药物,Thakare等[26]发现此药可用于抑制金黄色葡萄球菌感染,通过体内、外抑菌试验发现,双硫仑无论单独使用还是与其他抗菌药物联合用药,都能达到良好的抗菌效果。
布洛芬属于解热镇痛类,非甾体抗炎药,布洛芬作用于金黄色葡萄球菌(CECT 976)后,导致金黄色葡萄球菌细胞对碘化丙啶的渗透、细胞内钾的释放及细胞表面疏水性的变化,最终抑制其游离生长和固着生长[27]。
依布硒对临床分离的耐多药金黄色葡萄球菌,包括耐甲氧西林和万古霉素的金黄色葡萄球菌(MRSA和VRSA)表现出强大的杀菌活性,同时也证明了依布硒通过抑制细菌蛋白质合成,进而抑制MRSA中的毒素产生[28]。
通过药物重定位将一些药物应用于治疗新的疾病,在临床已经有很多成功的例子说明此种方法在发现新型抗菌药物中具有很好的应用前景。
4.2 、重定位抗病毒药物
N-乙酰半胱氨酸(NAC)是一种临床上用于治疗对乙酰氨基酚毒性的药物,Martina等[29]研究人员发现,NAC能使登革热病毒(DENV)引起的肝损伤患者受益。使用HepG2细胞进行添加试验阐明,NAC在感染前、感染中和感染后能有效减少感染性病毒体;并且在DENV感染的小鼠中,NAC改善了DENV相关的临床表现,包括白细胞减少症和血小板减少症,减少了肝损伤和肝细胞凋亡[30]。另外也有报道称,奎宁是一种抗疟疾药,具有明显的抗DENV活性,将其与未处理的对照组相比,奎宁能抑制DENV产生的毒素,大约80%;此外奎宁能抑制4种血清型DENV的毒素产生,这对开发奎宁针对DENV的抗病毒活性具有适用性[31]。
目前,FDA未批准有用于治疗裂谷热病毒(RVFV)感染的疗法,为了将药物重新用于RVFV治疗,Caroline等[32]对FDA批准的药物库进行了筛选,并确定了其抑制RVFV的能力;从中发现肝细胞和肾细胞癌药物——索拉菲尼是最有效的抑制剂,并且安全无毒,其以细胞类型和病毒株独立的方式显示出对RVFV的抑制作用,作用机理研究表明索拉菲尼靶向病毒感染周期的至少存在两个阶段,即RNA合成和病毒释放[33]。
目前,药物重定位方法已经鉴别出许多用于其他疾病的旧有药物具有抗病毒活性,并有可能用于临床治疗。
4.3、 重定位抗肿瘤抗癌药物
在癌症中,最典型的重定位药物为——沙利度胺,它是一种谷氨酸衍生物,因在使用过程中发现其存在致畸作用而被禁用,但随后发现沙利度胺对麻风结节性红斑患者有快速的疗效及抗炎作用,1998年被FDA批准治疗麻风结节性红斑[34]。另有研究表明,沙利度胺为肿瘤坏死因子的抑制剂,治疗多发性骨髓瘤有良好疗效,与其他药物联合治疗恶性黑色素瘤、Kaposi's肉瘤、肾癌、急性髓性白血病以及前列腺癌效果显着,2006年FDA批准沙利度胺能联合地塞米松能够治疗多发性骨髓瘤[35]。
双硫仑在1951年被FDA批准为第一种治疗酒精依赖的药物;自20世纪80年代以来,研究人员注意到双硫仑的肿瘤抑制作用[36],并且在过去的30年中,越来越多的证据表明双硫仑在体外和体内治疗各种人类癌症方面具有巨大潜力[37]。目前银离子和银络合物已被证明在体外具有出色的抗癌活性[38];而最近,科学家报道了银离子和双硫仑的结合可以主要通过抑制蛋白酶体功能来诱导增强的抗癌活性[39]。
阿司匹林为解热镇痛药类中的非甾体抗炎药,主要用于类风湿关节炎的治疗,但其作为环氧酶(cyclo-oxygenase, COX)的抑制剂,对COX-1有较强的亲和力,在乳腺癌、脑癌、胃肠癌、食管癌、胰腺癌、前列腺癌、肺癌等癌症中,通过COX依赖性途径及其他途径(如上调肿瘤抑制基因、下调抗凋亡基因)对上述癌症产生抗癌活性[40]。
在以后的研究中,重定位药物对相关癌症的作用会引起更多学者的关注,虽然将重定位药物用于癌症治疗存在利弊,但其依旧拥有光明的未来。
4.4 、其他
Boyapally等[41]报告了尼洛沙胺的重新用途,它是一种抗蠕虫药,目前用于治疗肺部疾病——肺纤维化(PF);该研究表明,尼洛沙胺存在多种抗纤维化作用的潜力,包括上皮到间质转化(EMT)的阻滞以及抑制细胞外基质的沉积,血小板衍生生长因子(PDGF)表达的下调,这为成功开发PF治疗候选药物提供了研究空间[42,43]。
Spitzer等[45]采用联合亚浓度的氟康唑对不同真菌病原体进行筛选,筛选出抗抑郁类药物——舍曲林[44];这种杀菌剂组合对所有测试物种均有效,包括临床分离出的耐药念珠菌,及蜡螟体内的新生隐球菌感染。事实表明,舍曲林联合亚浓度的氟康唑能够跨过血脑屏障作用于中枢神经系统受体,从而治疗真菌性脑膜炎。
以阿司匹林和布洛芬为代表的解热镇痛类非甾体抗炎药,有研究证实阿司匹林对白色念球菌有抗生物膜活性作用,并且在单独使用阿司匹林,以及阿司匹林联合传统抗真菌药物时都能观察到[46]。此外,布洛芬对念珠菌有很好的抗真菌活性,特别是与氟康唑合用时[47]。研究还发现,布洛芬能逆转某些临床分离的念珠菌株与外排活性相关的耐药性[48]。
5 、总结与展望
药物在临床使用过程中需要关注安全性、有效性以及不良反应等,其中安全性和有效性是评价药物的关键点。已上市的药物因其人体安全性明确而使得老药新用的研究周期缩短且成功率提高。药物重定位的关键是深入了解疾病的病因和病理、药物的作用靶点和作用机制,将已上市药物和新适应证相联系,从而提供更多更好的用药选择。
现存已知药物的数量可以为药物重定位提供充足的来源。而相关学科的飞速发展,为药物重定位提供了新的思路与方向,同时也驱动了相关学科的发展。多年来,生物和化学信息以前所未有的速度发展,标志着人类进入了“大数据”时代,同时也提供了将药物与疾病联系起来的新机会。而药物重定位的研究就是将已知疾病和药物的靶点、途径和配体的所有信息全部整合起来。考虑到获得实验和临床数据的条件和条件的可变性,这项任务极具挑战性;但药物重新定位策略开辟了新的机遇,它最终能引领我们开发出更安全有效的药物。
参考文献
[1]杨光,郝逸凡基于互信息算法的抗前列腺癌药物重定位分析[J]沈阳师范大学学报:自然科学版, 2019,37(1):34-37.
[2] JANICE M.Trends in development and approval times for new therapeutics in the United States[J].Nat Rev Drug Discov,2003,2(9):695-702.
[3] QU X A,GUDIVADA R C,JEGGAA G,et al.Inferring novel disease indications for known drugs by semantically linking drug action and disease mechanismrelationships[J]. BMC Bioinformatics ,2009,10(S5):S4-S4.
[4] PARVATHANENI V,KULKARNI N S,MUTH A.et al.Drug repurposing:a promising tool to accelerate the drug discovery process[J] .Drug Discov Today,2019,24(10):2076-2085.
[5] BARABASI A L,OLTVAI Z N.Network biology:understanding the cell's functional organization[J].Nat Rev Genet,2004,5(2):101-115.
[6] BADER S,SEBASTIAN K,GAVIN A C.Interaction networks for systems biology[J].Febs Lett,2008 582(8):1220-1224.
[7] HOPKINS A L.Network pharmacology[J].Nat Biotechnol,2007.251(1011101111.
[8]张永祥,程肖蕊,周文霞药物重定位一网络药理学的重 要应用领域[J]中国药理学与毒理学杂志,2012 .26(6):779-786.
[9] CHENG F X,LIU C,JIANG J,et al.Prediction of drug-target interactions and drug repositioning via Network-Based inference[J].PLoS Comput Biol,2012,8(5):e1002503.
[10] YU H,CHEN J.XU X,et al.A systematic prediction of multiple drug-target interactions from chemical,genomic ,and pharmacological data[J].PLoS One,2012,7(5):e37608.
[11] HOARE S R J,FLECK B A,WILLIAMS J P,et al.The importance of target binding kinetics for measuring target binding affinity in drug discovery:a case study from a CRF1 receptor antagonist program[J] Drug Dis Today,2020,25(1):7-14.
[12] JING Y,BIAN Y,HU Z.et al.Deep learning for drug design: an artificial itelligence paradigm for drug discovery in the big data era[J].AAPS J,2018,20(3):1-10.
[13] CHABROL E,STOJKO J,NICOLAS A.et al.VHH characterization recombinant VHHs:production.characterization and afnity[J].Anal Biochem,2019,589.:113491.
[14] YANG L,WANG K J,CHEN J A.et al.Exploring ff-targets and off-systems for adverse drug reactions via chemical-protein interactome - clozapine-induced agranulocytosis as a case study[J].PLoS Comput Biol,2011.7(3):e1002016.
[15] CHEN Y Z,ZHI D G.Ligand-protein inverse docking and its potential use in the computer search of protein targets of a small molecule[J]. Proteins ,2001,43 (2):217-226.
[16] FAN RONG M,ZHU HONG Y,XING C,et al.Prediction of drug-target interaction networks from the integration of protein sequences and drug chemical structures[J]. Molecules,2017.227.1119.
[17] LI C,JING S,YUN X,et al.An fficient drug-target interaction mining algorithm in heterogeneous biological networks[J] Springer Cham,2014,8643,65-76.
[18] HOPKINS A L.Network pharmacology:the next paradigm in drug discovery[J] Nat Chem Biol,2008.411):682-690.
[19] DUDLEYJ T,SIROTA M,SHENOY M.et al.Computational repositioning of the anticonvulsant topiramate for inflammatory bowel disease[J] Sci Transl Med,2011 ,3(96):96ra76.
[20] MOHANTY S,RASHID M H A.MRIDUL M.et al.Application of artificial itelligence in COVID-19 drug repurposing[J]. Dlabetes -metab Res,2020,14(5):1027-1031.
[21] CHIANG A P,BUTTE A J.Systematic evaluation of drug-disease relationships to identify leads for novel drug uses[J]. Clin Pharmacol Ther,2009 ,86(5):507-510.
[22] SONIA N.PEDRO,MARA G,et al.Deep eutectic solvents comprising active pharmaceutical ingredients in the development of drug delivery systems[J.Expert Opin Drug Del,2019,16(5):497-506.
[23] GOTTLIEB A,STEIN G Y,RUPPIN E,et al.Predicta method for inferring novel drug indications with application to personalized medicine[J.Mol Sys Biol,2011,7(1):496.
[24] HUANG R,SOUTHALL N,WANG Y,et al. The NCGC pharmaceutical collection:a comprehensive resource of clinically approved drugs enabling repurposing and chemical genomics[J] Sci Transl Med,2011,3(80):80ps16.
[25] MARTA, GONARA, SANTIAGO,et al.The FICI paradigm:correcting flaws in antimicrobial in vitro synergy screens at their inception[J]. Biochem Pharmaco1,2019,163:299-307.
[26] THAKARE R,SHUKL A M,KAUL G,et al.Repurposing disulfiram for treatment of Staphylococcus aureus infections[J].Int J Antimicrob Agric ,2019,53(6):709-715.
他汀类药物(statins)是羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是目前唯一降低心脑血管疾病死亡率的调脂药。近年来,随着他汀类药物的广泛应用和对其作用机制的深入研究,发现其尚有诸多具有临床意义的非降脂作用,即他汀类药物的多效性。本文中对他...
薯蓣皂苷元(diosgenin)俗称皂素,是一种植物自然合成的甾体皂苷元,属螺甾烷醇糖苷元(图1),结构式为C27H42O3,相对分子质量为414.63,广泛存在于豆科和薯蓣科植物中。薯蓣皂苷元最主要的来源是葫芦巴Trigonellafoenum-graecumL.的种子,也可通过水解...
抗菌药的发明与应用使各类严重细菌感染性疾病得到有效控制或治愈,显着降低了临床死亡率,改善患者生活质量,在20世纪初即促成了抗菌药研发与广泛应用的新浪潮。...
2型糖尿病以葡萄糖和脂类的异常代谢为特征,导致骨骼...