
复方丹参片的主要功效和主治是活血化瘀,治疗冠心病心绞痛等症状。丹参酸 B 是复方丹参片的主要活性成分,由于丹参酸 B 的半衰期较短,生物半衰期t1 /2= ( 16. 58 ±5. 768) min,因此设计复方丹参缓释片以维持血药浓度,可以提高药品的疗效和患者的依从性。因此在缓释制剂研制中,需要进行药物动力学和生物等效性研究。本试验根据( 《中国药典》2010 版)缓释、控释和迟释制剂指导原则及国家中药天然药物注册申报要求进行复方丹参膜控缓释片与复方丹参片在 Beagle 犬体内的药动学及生物利用度的比较研究。
1 仪器与材料
1. 1 仪器
仪器: 岛津 LC-10A 型高效液相色谱仪; SK300LH超声仪,上海科导超声仪有限公司; 离心机: Tdl5M 台式大容量冷冻离心机,长沙湘仪离心机仪器有限公司;TGL-20B 高速离心机,上海安亭科学仪器厂。
1. 2 试药
复方丹参缓释片,复方丹参缓释片素片( 未包衣,自制) ; 复方丹参片( 广东一力集团制药有限公司,批号为:6090612) ; 丹酚酸 B 照品( 中国药品生物制品检定所,批号为:111562-200807) ; 乙睛,甲醇( 色谱纯) ; 肝素( 上海生物化学制药厂) ; 其它试剂均为分析纯。
1. 3 试验动物
成年 Beagle 犬 6 只,雌雄各半,体质量为 9. 5 kg,由广州市医药工业研究所广东省 Beagle 犬种质资源研究开发中心( 国家 Beagle 犬种子基地) 提供。许可证号: SCXK( 粤) 2008-0007。
2 方法与结果
2. 1 复方丹参缓释片与素片单次给药药动学比较试验方法
6 只健康 Beagle1 犬称重,随机分为 2 组,一组为受试药组( 缓释片,每片含丹酚酸 B 50 mg) ,另一组为参比药组( 素片,每片含丹酚酸 B 50 mg) ,每组 3 只,雌雄不限。采用双周期两制剂交叉试验设计,洗净期为 1 周。
禁食 12 h 后,口服给予复方丹参缓释片及复方丹参缓释素片各 1 片。缓释片组于给药前及给药后 15、30、45、60、90、120、150、180、210、240、360、480、600、720min 由腿部取静脉血 3 mL; 素片组于给药前及给药后5、10、15、25、40、60、90、120、150、270 min 由腿部取静脉血 3 mL,按“2. 5”项下方法处理血浆样品。
停药 1 周后,进行交叉实验,方法同上。
2. 2 复方丹参片连续 3 次给药的药动学试验方法
将“2. 1”所用 6 只健康 Beagle1 犬,经过 7 d 洗净期后开始试验。首先分别口服 3 片复方丹参片( 每片含丹酚酸 B 6 mg) ,首次给药 4、8 h 后再次喂食 3 片复方丹参片。于首次给药后 5、10、15、30、60、120、240、245、250、255、270、300、360、480、485、490、495、510、540、600、720 min 由腿部取静脉血 3 mL,按“2. 5”项下方法处理血浆样品。
2. 3 复方丹参缓释片与复方丹参片多次给药达稳态后的药动学比较试验方法
将“2. 2”所用 6 只健康 Beagle1 犬,经过 7 d 洗净期后开始试验。分别每隔 4. 5 h 口服 1 片复方丹参缓释片( 每片含丹酚酸 B 50 mg) ,连续给药 19 次,分别于第7、13、19 次给药前由腿部取静脉血3 mL,按“2. 5”项下方法处理血浆样品后进行检测,考察是否达到稳态。
于第 19 次给药后 15、30、45、60、90、120、150、180、210、270、360、480、600 min 由腿部取静脉血 3 mL,按“2. 5”项下方法处理血浆样品。
将上步所用 6 只健康 Beagle1 犬,经过 7 d 洗净期后开始试验。分别每隔 90 min 口服 3 片复方丹参片( 每片含丹酚酸 B6 mg) ,连续给药 16 次,于第 14、15、16 次给药前由腿部取静脉血 3 mL,按“2. 5”项下方法处理血浆样品后进行检测,考察是否达到稳态。于第16 次给药后 5、10、15、20、25、30、40、55、90、120 min 由腿部取静脉血 3 mL,按“2. 5”项下方法处理血浆样品。
2. 4 血液样品测定方法
采用高效液相色谱法对样品进行检测,色谱条件如下:色谱柱 C18; 流动相: 甲醇-乙腈-甲酸-水 ( 30∶10∶1∶59) ;检测波长: 280 nm; 柱温: 30 ℃; 流速 1. 0 mL/min。
2. 5 血浆样品的处理方法
取血样3 mL,置于肝素化5 mL 离心管中,离心( 5 000r / min) 10 min,精密取血浆 1 mL,加入硫酸溶液 3 mL,加入乙酸乙酯 3 mL,涡旋混合 15 min,置振荡器上振摇30 min( 150 次 / min) ,离心( 12 000 r / min) 10 min,吸取有机层,重复萃取 2 次,合并有机层,将有机层转入尖底离心管中,置于 40 ℃ 水浴中氮气流下吹干,残渣用0. 2 mL 流动相溶解测定。
2. 6 体内分析方法的建立
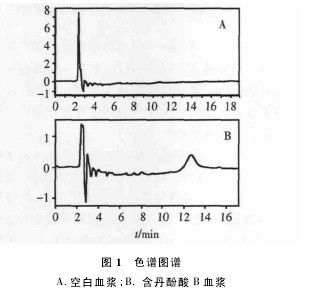
2. 6. 1 方法的专属性 分别取空白血浆、加入一定浓度对照溶液的空白血浆及受试家犬服药后采集的血浆,按“2.5”项处理,进样,得色谱图,见图 1。结果表明,空白血浆中的内源性物质不干扰丹酚酸 B 的分离测定。【图1】
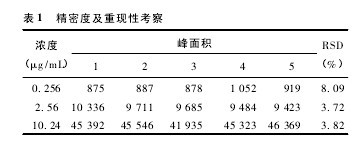
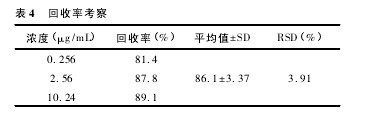
2. 6. 2 精密度与重复性 取空白血浆 800 μL,按“2. 7”项下的方法配制低、中、高浓度( 丹酚酸 B 浓度为 0. 256、2. 56、10. 24 μg / mL) 的样品,按“2. 5”项下处理后作HPLC 分析。每一浓度连续测定 5 次,计算本法的准确度与精密度。结果见表1,3 种浓度的 RSD 均小于10%。【表1】
2. 6. 3 样品稳定性试验
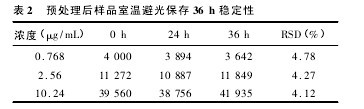
2. 6. 3. 1 室温保存稳定性试验取空白血浆 800 μL,按“2. 7”项下的方法配制低、中、高浓度( 丹酚酸 B 浓度为0.768、2.56、10.24 μg/mL)的样品,按“2.5”项下处理后作 HPLC 分析,然后于室温避光储存,在24 h 及 36 h 后再次做 HPLC 分析,考察预处理后的样品在室温下的稳定性,考察结果见表 2,可见样品在室温下 36 h 内保持稳定。【表2】
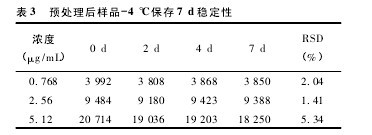
2. 6. 3. 2 低温保存稳定性试验取空白血浆 800 μL,按“2. 7”项下的方法配制低、中、高浓度( 丹酚酸 B 浓度为 0. 768、2. 56、5. 12 μg/mL) 的样品,按“2. 5”项下处理后作 HPLC 分析,然后于冰箱中-4 ℃储存,分别于 2、4、7 d 后取出样品解冻后做 HPLC 分析,考察预处理后的样品在-4 ℃条件下的稳定性,考察结果见表 3,可见样品在-4 ℃条件下 7d 内保持稳定。【表3】
2. 6. 4 回收率 取空白血浆 800 μL,按“2. 7”项下的方法配制低、中、高浓度 ( 丹酚酸 B 浓度为 0. 256、2.56、10. 24 μg / mL) 的样 品,按“2. 5 ”项下处理后作HPLC 分析。以提取后获得的色谱峰面积与未经“2.5”项下方法处理直接分析得到的色谱峰面积之比考察提取回收率,结果见表 4。【表4】
2. 7 血样标准曲线的制备
精密称取丹酚酸 B 对照品 12. 8 mg,置 50 mL 棕色量瓶中,加流动相至刻度,摇匀; 取 1 mL 该溶液于25 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸B 对照品溶液 G; 精密吸取丹酚酸 B 对照品溶液 G 5mL 于 10 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸 B 对照品溶液 F; 精密吸取丹酚酸 B 对照品溶液 F 5 mL 于 10 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸 B 对照品溶液 E; 精密吸取丹酚酸 B 对照品溶液 E 5 mL 于 10 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸 B 对照品溶液 D; 精密吸取丹酚酸 B 对照品溶液 G 1 mL 于 10 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸 B 对照品溶液 C; 精密吸取丹酚酸 B 对照品溶液 C 5 mL 于 10 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸 B 对照品溶液 B;精密吸取丹酚酸 B 对照品溶液 B 5 mL 于 10 mL 棕色量瓶中,加流动相至刻度,摇匀,制成丹酚酸 B 对照品溶液 A; 则对照品溶液 A、B、C、D、E、F、G 的浓度分别为0. 256、0. 512、1. 024、1. 28、2. 56、5. 12、10. 24 μg / mL。
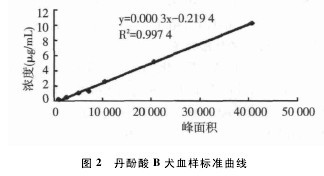
分别将7 批对照品溶液200 μL 置800 μL Beagle 犬空白血浆中,加入硫酸溶液3 mL,加入乙酸乙酯3 mL,涡旋混合15 min,置振荡器上振摇30 min( 150 次/min) ,离心( 12 000 r/min) 10 min,吸取有机层,重复萃取 2 次,合并有机层,将有机层转入尖底离心管中,置于 40 ℃水浴中氮气流下吹干,残渣用 0. 2 mL 流动相溶解测定。分别取溶液 20 μL 注入液相色谱仪,测定其峰面积,以丹酚酸 B 浓度为纵坐标,峰面积为横坐标,绘制标准曲线见图 2,结果表明,丹酚酸 B 对照品在 0. 256~ 10. 24 μg / mL 范围内线性关系良好。回归方程: y =0. 000 3x-0. 219 4,相关系数: r = 0. 997 4。【图2】
3 试验结果
3. 1 单次给药
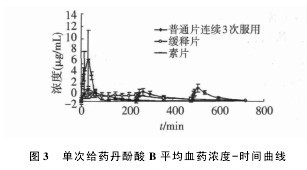
3. 1. 1 血药浓度测定与药时曲线 血浆样品按“2. 4”项下血浆样品的分析方法操作,并以标准曲线计算各时间点样品中丹酚酸 B 的浓度,6 只 Beagle 犬单剂量口服 50 mg 复方丹参缓释片和 50 mg 复方丹参缓释片素片以及连续 3 次口服 18 mg 复方丹参片后,丹酚酸 B平均血药浓度-时间曲线见图 3。【图3】
3. 1. 2 单次给药 Beagle 犬体内的药代动力学参数实验数据在电脑经 3P87 程序处理,求得 6 只 Beagle 犬单剂量口服 50 mg 复方丹参缓释片和 50 mg 复方丹参缓释片素片以及连续 3 次口服 18 mg 复方丹参片后平均药代动力学参数见表 5。【表5】
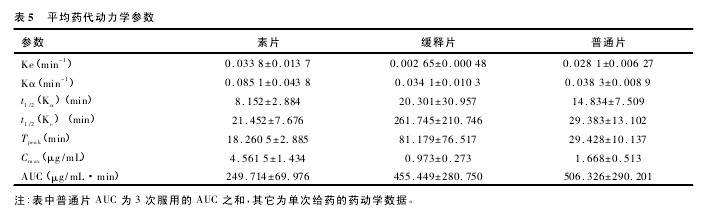
3. 1. 3 复方丹参缓释片的相对生物利用度 与未包衣的素片相比,复方丹参缓释片的 Cmax显着降低,而达逢时间明显后移; 与普通片 3 次连续服用相比,达逢时间从29. 428 min 后移至81. 179 min,消除半衰期从29.383 min 延长至 261. 745 min,缓释片与素片的相对生物利用度为 182. 4%,缓释片与普通片的相对生物利用度为 89. 9%。
3. 1. 4 体外释药与体内吸收相关性考察 复方丹参缓释片的药动学过程符合单室模型,因此采用 Wagner-Nelson 公式计算口服后不同时间丹酚酸 B 的吸收百分数 F( t) ( %) 。采用梯形面积法求出各时间点 AUC0-t,取素片的Ke= 0. 033 8 计算吸收百分数 F( t) 。结果见下表 6:【表6】
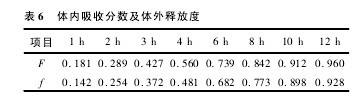
将体内吸收分数( F) 与对应的体外累计释放百分率( f) 按最小二乘法进行线性回归,得到以下方程:y = 1. 007 4 x-0. 005 2,r = 0. 994 8对直线方程相关系数进行统计检验,P<0. 01,说明复方丹参多层缓释片体内吸收与体外释放相关性显着。
3. 2 多次给药达稳态
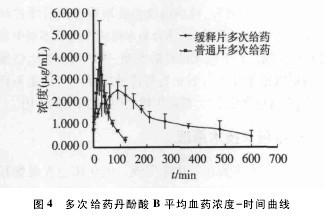
3. 2. 1 血药浓度测定与药时曲线 血浆样品按“2. 5”项下血浆样品的分析方法操作,并以标准曲线计算各时间点样品中丹酚酸 B 的浓度,6 只 Beagle 多次口服50 mg 复方丹参缓释片及 18 mg 复方丹参片后,丹酚酸B 平均血药浓度-时间曲线见图 4。【图4】
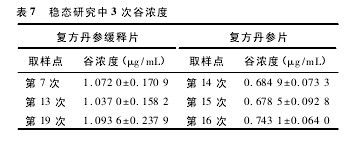
3. 2. 2 多次给药达稳态后 Beagle 犬体内的药代动力学参数 稳态研究中复方丹参缓释片及复方丹参片的3 次波谷浓度见表 7,可见此时已达到稳态。实验数据在电脑经 3P87 程序处理,求得6 只 Beagle 多次口服50mg 复方丹参缓释片及 18 mg 复方丹参片达稳态后平均药代动力学参数,见表 8。【表7.表8.略】
3. 2. 3 多次给药达稳态后复方丹参缓释片的相对生物利用度 对表中的药动学参数进行分析,复方丹参缓释片与复方丹参片相比,多次给药达稳态后达逢时间从21. 418 min 后移至83. 080 min,消除半衰期从21.802 min 延长至 219. 625 min,两者相对生物利用度为( AUC缓释片/3 AUC普通片) 93. 6%。
3. 2. 4 波动系数 DF 值 按下式计算波动系数 DF 值,缓释片为 58. 13±14. 1 而普通片为 125. 48±14. 6,有显着差异( P<0. 05) 。DF = ( Cmax-Cmin/ Cav×100%
4 结论与讨论
由药动学参数可知,Beagle 犬口服复方丹参缓释片后丹酚酸 B 的体内过程符合单室模型,单次给药与同剂量复方丹参缓释片素片相比,最大血药浓度显着降低,达峰时间明显后移,吸收半衰期和消除半衰期明显延长; 经方差分析,比较各主要药动学参数( Cmax、t1 /2、Tpeak) ,差异有显着性( P<0. 05) 。
与连续3 次服用复方丹参片相比,Beagle 犬单剂量口服复方丹参缓释片最大血药浓度由 1. 668 μg/mL 降至 0. 973 μg/mL,达峰时间由 29. 428 min 后移至 81.179 min,消除半衰期从 29. 383 min 延长至 261. 745min; 经方差分析,比较各主要药动学参数 ( Cmax、t1 /2、Tpeak) ,差异有显着性( P<0. 05) 。
多次口服复方丹参缓释片与复方丹参片达稳态后,两者最大血药浓度分别为 2. 108 μg/mL 与 3. 100μg/mL,达峰时间分别为 83. 080 min 与 21. 418 min,消除半衰期分别为 219. 625 min 与 21. 802 min,波动系数分别为 58. 13%与 125. 48%; 经方差分析,差异有显着性( P<0. 05) 。
采用双单侧 t 检验和( 1-2α) 置信区间法分析,置信区间( 90%) 为 80% ~ 125%,此时表明 2 种制剂的AUC 等效。与连续 3 次服用复方丹参片相比,Beagle 犬单剂量口服复方丹参缓释片的相对生物利用度为89.9%;而多次口服复方丹参缓释片与复方丹参片达稳态后两者相对生物利用度为 93. 6%; 提示它们之间具有生物等效性; 而单剂量口服素片的 AUC 要明显小于缓释片,这可能是由于高浓度丹酚酸 B 在吸收部位饱和造成。刘睿等人的试验证实,丹酚酸 B 在全肠道吸收良好,且在小肠内无特定吸收部位。不同浓度的丹酚酸 B在小肠的吸收情况为: 低浓度>中浓度>高浓度,说明丹酚酸 B 的小肠吸收存在高浓度饱和现象。这也进而为制备复方丹参缓控释给药系统提供了必要的生物药剂学依据。
参考文献
[1]国家药典委员会. 中华人民共和国药典[S]. 一部. 北京:中国科技医药出版社. 2010: 904-905.
[2]宋敏,杭太俊,张正行,等. 丹参提取物有效成分在大鼠体内的药代动力学和相互影响研究[J]. 药学学报,2007,42( 3) : 301-307.
[3]黄泰康. 常用中药成分与药理手册[M]. 第 1 版. 北京: 中国伊医药科技出版社. 1994: 626.
青蒿琥酯是青蒿素的重要衍生物之一,与青蒿素相比,不仅效价高、毒性小,而且溶解性好,更有利于临床应用[1].青蒿琥酯不仅具有很好的抗疟疾作用,而且还具有治疗寄生虫病[2]、抗肿瘤[3]、抗炎和免疫调节[4]等多种作用.熊果酸又名乌索酸(乌苏酸),属五环三萜类化合...
丹参为唇形科鼠尾草植物丹参SalviamiltiorrhizaBunge的干燥根及根茎,是最常用的活血化瘀中药之一,首载于《神农本草经》,被列为草部上品。丹参,味苦,性微寒,入心、肝经,具有活血调经、祛瘀止痛、凉血消痈、清心除烦、养血安神的功效。古有一味丹参...