
肝素发现于 1916 年,自 1935 年以来一直作为有效的抗凝血药物应用于临床。肝素在临床广泛用于防治血栓栓塞性疾病、弥漫性血管内凝血( DIC) 的早期治疗及体外抗凝。而研究显示,肝素除具有抗凝作用外还具有多种生物活性,包括促进胰蛋白脂酶及肝脂酶释放、抑制补体活化、抑制血管生成和肿瘤生长,以及抗病毒活性。其中,肝素对炎症过程的影响正日益受到关注。临床研究显示,给支气管哮喘、溃疡性结肠炎、皮肤烧伤患者使用肝素能明显减轻其炎症反应; 同样,早期使用肝素干预治疗能改善脂多糖( LPS) 导致的脓毒症休克鼠的急性肺损伤,下调炎症介质,提高脓毒症患者生存率。然而肝素并没有作为一种抗炎药物广泛用于临床,可能与其出血风险高以及抗炎机制不明有关。作者将从肝素的结构和功能出发,着重讨论肝素对炎症的影响及其可能的作用机制。
1 肝素的结构
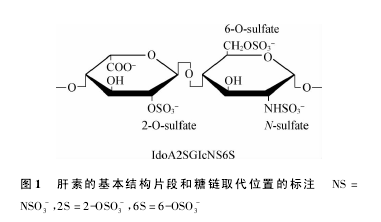
肝素是一类由糖醛酸和 D-葡糖胺二糖重复单位以 1-4 键连接形成的线性多糖。二糖单位的 N-硫酸基、O-硫酸基、N-乙酰基等多种可变取代形成了多种复杂的序列。肝素由结缔组织型肥大细胞表达,以肝素蛋白聚糖的形式被生物合成( Mr 750 ~1 000 kDa) 肝素蛋白聚糖由一个独特的核心蛋白( 丝甘蛋白) 和与其共价连接的多种肝素多糖链( Mr 60 ~100 kDa) 组成。肝素结构片段主要为 IdoA2SGIcNS6S,如图 1所示。【1】
2 肝素的抗炎作用及其机制
2. 1 肝素结合蛋白
目前已被证实的肝素结合蛋白超过 100 种,并且其数量仍在不断增长。这些蛋白可调节机体各项病理生理过程,包括参与凝血和纤溶溶解、构成细胞外基质、参与脂质代谢以及调节免疫应答。研究发现,肝素同样可以结合急性时相反应蛋白和补体蛋白,这为肝素抗炎特性提供了一定的理论依据。
大量研究资料证实,感染、创伤、休克等可激活单核-巨噬细胞,导致各种炎症介质的大量产生。肝素能够结合炎性细胞释放的特定酶和炎症介质如弹性蛋白酶、组织蛋白酶 G、嗜酸粒细胞过氧化物酶、嗜酸粒细胞阳离子蛋白、主要碱性蛋白、细胞因子和趋化因子,从而防止其与相应受体结合,加速炎症反应,引起白细胞活化、血管渗透性增加及组织损伤。有研究发现,肝素雾化吸入可降低慢性阻塞性肺疾病大鼠血清中白细胞介素-8( IL-8) 及白细胞介素-6( IL-6) 水平,使炎症细胞减少,对大鼠气道炎症具有抑制作用。Hochart等也发现,LPS 刺激后的人类单核细胞会产生大量的细胞因子,而当用肝素预处理后,肿瘤坏死因子 α( TNF-α) 、IL-8、IL-6 和白细胞介素-1β( IL-1β) 这些细胞因子水平明显下降。Handel 等发现,肝素和趋化因子结合后,抑制趋化因子所参与或引发的炎性细胞黏附、滚动、趋化、游走及局部浸润。肝素与碱性成纤维生长因子( bFGF)、转化生长因子-β( TGF-β)相互作用,抑制其导致的平滑肌细胞增生及纤维组织修复,从而延缓胃肠道肿瘤、冠状动脉粥样硬化、肝硬化等疾病的进展。
但是迄今为止,肝素结合域的结构仍未知,且缺乏有效的检测手段。然而一旦将其抗炎结构提取出来进行加工处理,将有很广阔的临床应用前景。
2. 2 肝素和肥大细胞
肝素能抑制免疫刺激或非免疫刺激诱导的肥大细胞的活化。现普遍认为其机制是: 阻断内质网膜上的1,4,5-三磷酸肌醇的受体,阻止内源性钙离子的释放,从而抑制肥大细胞脱颗粒及组胺的释放。通过这一机制,肝素同样可能阻止其他类型细胞脱颗粒。例如,肝素与嗜中性粒细胞结合能够抑制其脱颗粒,抑制超氧化物阴离子产生及溶酶体的活化,抑制嗜中性粒细胞激活血小板的能力。
2. 3 肝素和选择素介导的细胞黏附
在炎症反应过程中,大量活化的白细胞黏附于血管内皮细胞,增加内皮细胞通透性,进而引起白细胞游走出血管,释放大量蛋白酶和超氧离子,破坏组织细胞膜和细胞器的通透性与完整性,使溶酶体膜破裂,损伤组织细胞,最终引起组织器官结构损伤和功能障碍。
大量研究证据表明,肝素能抑制白细胞黏附于血管内皮。Lever 等发现: 在小鼠腹膜炎模型中,当给予肝素后,腹腔灌洗液中细胞总数和白细胞计数均明显低于对照组; 同样,将 LPS 激活的外周血单核细胞与人类脐静脉内皮细胞共培养后发现,细胞间黏附分子-1( ICAM-1) 、血管细胞黏附分子-1( VCAM-1) 和 E选择素等内皮细胞黏附分子表达上调,而肝素能明显抑制上述现象。
选择素是血管黏附分子大家族中的一大类成员,根据表达部位可分为 3 类: E-选择素表达于活化的内皮细胞表面; L-选择素表达于白细胞表面; P-选择素则表达于活化的血小板和内皮细胞表面。在感染及其他炎性反应过程中,选择素通过与相应配体结合介导白细胞与血管壁接触,并使白细胞在血管壁上缓慢滚动,最终导致白细胞在炎性反应区域集中。选择素中的凝集素样结构决定其配体是糖类,包括 SLex 和其异构体SLea。而肝素和相关的葡萄糖胺多糖能与这些凝集素样分子结合,干扰自然配体的作用,从而抑制嗜中性粒细胞与活化的内皮细胞结合。
β2 整合素( CD11 / CD18 复合物) 是整合素家族分子成员之一,表达于嗜中性粒细胞表面,在介导白细胞与内皮细胞的紧密黏附中发挥重要作用。整合素家族分子是由 α、β 两个亚单位通过非共价连接而组成的异源二聚体。血小板活化因子、C5a 和 IL-8 等炎症介质刺激能使 CD11/CD18 复合物从一个“低亲和力构象”状态转变为“高亲和力构象”状态,从而其在细胞膜表面表达增加。β2 整合素的配体是 ICAM-1,它在内皮细胞上持续表达,在受到 TNF-α、IL-1、TNF-γ 和内毒素等炎症介质的刺激后表达上调,从而与活化的β2 整合素结合,介导白细胞移行。Diamond 等发现,肝素能与 Mac-1( CD11b/CD18) 相互作用,调节白细胞的黏附; 进一步研究表明,肝素可与纤维蛋白原、凝血因子 X 和 iC3 竞争性结合 Mac-1; 低分子肝素同样能抑制纤维蛋白原与 Mac-1 的结合。大量研究资料揭示肝素与 Mac-1 的结合在抗凝、抑制炎症反应及细胞增生过程中发挥重要作用。
2. 4 肝素和核因子-κB( NF-κB)
NF-κB 是一种重要的核内转录因子,在细胞炎性反应、免疫反应以及细胞凋亡等过程中起着举足轻重的作用。研究发现,活性形式的 NF-κB 只存在于核抽提物中,胞质中的 NF-κB 与一种抑制蛋白 inhibitoryκB( IκB) 结合,以无活性状态稳定地存在于胞质中。许多免疫刺激因子如细胞因子、生长因子、丝裂原、脂多糖和某些病毒蛋白等作用于细胞后,NF-κB 活化,迅速发生核易位,与特异性 κB 序列结合而启动靶基因转录。迄今为止,已证实的 NF-κB 靶基因包括促炎症细胞因子如 TNF-α、IL-6 等,细胞黏附分子如 VCAM-1、ICAM-1、P-选择素等,趋化因子如单核细胞趋化因子、IL-8 等,生长因子如血小板源性生长因子、巨噬细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子等。
这些因子对细胞的活化、增殖、浸润、趋化和分泌功能起着直接的调控作用。
Zhao 等发现,肝素能抑制细胞内信号转导蛋白 P38 丝裂原活化蛋白激酶( P38 MAKP) 的磷酸化表达及 NF-κB 的活化,下调 TNF-α、IL-6、IL-1β 等炎症介质的水平,从而减轻 LPS 诱导脓毒症大鼠急性肺损伤。同样,离体实验也表明,肝素通过抑制 NF-κB 的活化,减轻 LPS 刺激后人肺血管内皮细胞炎症反应,下调E-选择素、ICAM-1 等水平。推测肝素可能通过结合带正电的 NF-κB 核定位信号序列,阻止核易位,从而抑制其活化引起的各种促炎基因的高度转录,减少炎症介质生成,减轻机体的组织损伤和器官功能紊乱。
2. 5 肝素和细胞凋亡
细胞凋亡是细胞在一定条件下接受刺激信号并受基因调控的一种自主性、程序性死亡过程。凋亡途径包括线粒体途径、死亡受体途径和内质网应激途径等。
这几种途径都可以激活细胞凋亡蛋白酶家族成员,最终导致细胞降解死亡。
肿瘤坏死因子受体( TNFRs) 是具有代表性的最大死亡受体家族,主要包括 TNFRⅠ( p55,CD120a) 、TNFRⅡ( p75,CD120b) 等。其共同特点是: 具有富含2 ~ 5 个半胱氨酸的细胞外重复序列和细胞内死亡区域( DD) ,DD 是转导细胞凋亡信号所必须的,其对应物称为死亡配体。配体 TNF-α 与 TNFRs 结合后,TNFRⅠ三聚体化,并激活 TNFRⅠ在质膜表面局部招募 Fas 相关死亡结构域蛋白( FADD) 、TNFRⅠ相关死亡域结合蛋白( TRADD) ,进而招募、水解活化半胱天冬蛋白酶-8,诱导细胞凋亡。半胱天冬蛋白酶在凋亡过程中起着必不可少的作用,细胞凋亡的过程实际上是半胱天冬蛋白酶不可逆有限水解底物的级联放大反应过程。Pettigrew 等将 TNF-α 转基因大鼠和正常大鼠做成脑缺血再灌注损伤模型,发现 TNF-α 转基因大鼠表达大量 TNF-α,明显加重了脑损伤。而 TNF-α敲除可显着降低小鼠急性心肌梗死死亡率,其机制与减少炎症细胞浸润、炎性细胞因子表达有关,也和抑制TNFRⅠ介导的细胞凋亡信号传导有关。然而有研究表明,在小鼠心肌缺血模型中,肝素可以降低 TNF-α基因的表达与上调。再者上文也提到肝素能抑制P-选择素和整合素介导的嗜中性粒细胞的募集,而活化的嗜中性粒细胞是 TNF-α 的主要来源。由此得出,肝素可能通过降低 TNF-α 水平,从而抑制 TNFRⅠ介导的细胞凋亡信号传导。
细胞凋亡的另一种途径为线粒体途径。任何引起线粒体膜电位改变和影响氧化磷酸化过程的因素均将导致线粒体膜通透性增加,细胞色素 C 从线粒体释放,释放到胞浆的细胞色素 C 在脱氧腺苷三磷酸( dATP) 存在的条件下能与凋亡相关因子 1( Apaf-1)结合,使其形成多聚体,并促使半胱天冬蛋白酶-9 与其结合形成凋亡小体,半胱天冬蛋白酶-9 被激活,进而激活其他半胱天冬蛋白酶,如半胱天冬蛋白酶-3等,从而诱导细胞凋亡。细胞色素 C 为一碱性蛋白,其前体从胞浆透过跨膜转运进入线粒体,并与线粒体膜间隙的血红素结合为成熟的细胞色素 C 并带上正电。而 Apaf-1 分子结构中存在带负电的色氨酸-天冬氨酸重复序列,因此当带正电的细胞色素 C 与 Apaf-1负电区结合,即能激半胱天冬蛋白酶-9。作为一个强大的聚阴离子,肝素能与 Apaf-1 竞争性结合带正电的细胞色素 C,从而抑制细胞凋亡。有研究显示,在肝素存在情况下,细胞色素 C 与抗坏血酸的反应效率下降 200 倍,说明在氧化还原反应中,肝素可以大大降低细胞色素 C 的活性。
3 无抗凝活性肝素抗炎研究的现状与展望
肝素可用于治疗炎症,但很强的抗凝血活性从根本上限制了其抗炎症的临床应用前景。为此,研制出了多种化学修饰肝素衍生物,如高碘酸盐氧化、N-位脱硫酸根、N-位脱硫酸根再乙酰化、N-位非替代肝素类似物的修饰、2-O 和 6-O 位脱硫酸根等。这些修饰肝素具有相对较低的抗凝血活性,并保留了一定的抗炎症功能。
最近研究表明,肝素的抗炎活性不依赖其抗凝血活性。Collino 等研究发现,在大鼠心肌缺血再灌注损伤模型中,N-位及 O-位脱硫酸肝素的应用能明显抑制缺血再灌注损伤导致的肥大细胞脱颗粒,抑制脂质过氧化物聚集及氧自由基的释放,抑制钙离子超载,下调炎症介质水平。另有报道指出肝素链上葡萄糖胺6-O-位的硫酸是肝素具有抗炎活性的关键基团。因此,通过采用不同的化学修饰方法,寻找最佳无抗凝活性肝素,是当前肝素抗炎症研究的重点; 另外,针对炎症反应过程中的不同靶分子,寻找肝素链上与之特异性结合的寡糖片段的结构信息,也将是研究重点之一。
肝素作为抗凝剂应用于临床已将近 80 年,其副作用已经很清楚,如内出血、血小板减少症及骨质增生。
因此,无抗凝活性肝素将是安全的、潜在的抗炎药物。4 总 结大量研究资料证实,肝素具有很好的抗炎特性,然而肝素并没有作为一种抗炎药物广泛用于临床,可能与其出血风险高有关。但是随着无抗凝活性的肝素、肝素衍生物以及肝素类似物的发现,这一顾虑将不复存在。目前的研究必须重点关注无抗凝活性肝素在各种急慢性炎症性疾病中的作用。而之前大部分的临床研究证据均不充分,并且或多或少都存在统计学方面的不足,因此设计出一系列严谨的随机临床试验至关重要。炎症反应、动脉粥样硬化形成、血栓形成以及细胞增殖之间存在相互联系,而肝素的多效性决定了其作为一个综合性药物应用于临床的前景。
1概述在炎症情况下,由于缺氧产生乳酸导致无氧糖酵解,从而产生细胞外酸化[1].有报道在哮喘合并感染的患者中,气道的pH值维持在5.2到7.1,其严重程度与皮质类固醇治疗直接相关[2,3].也有类似的报告,在类风湿性关节炎、动脉粥样硬化病变[4]及肿瘤[5]患...
藁苯内酯为当归、川芎等伞形科植物的特有活性成分,具有松弛平滑...
近几年来,臭氧(O3)治疗已成为慢性疼痛微创治疗的新方法,除了治疗椎间盘突出症已得到了广泛的应用以外,对肌肉、关节软组织慢性疼痛以及神经病理性疼痛的治疗也有明显的效果。由于臭氧本身兼具治疗作用及细胞毒性的双重特性,本实验用臭氧对实验兔股动脉...
抑郁和认知障碍共同发生的现象或者说共病的发病率较高。Meta分析显示老年抑郁、轻度认知障碍及老年痴呆可能是一个临床疾病的连续症状[1].目前,关于抑郁与认知障碍共病的具体分子机制尚不清楚,但不管是抑郁还是认知障碍,女性的发病率远远高于男性,所以雌...
七氟醚于1968年由Regan合成,1986年完成3期临床试验,1990年首先由日本的药监部门批准临床使用。近年来,被许多著名麻醉学专家誉为吸入麻醉的里程碑式药物。研究表明,七氟醚可抑制结肠癌细胞和喉癌细胞的生长,以及肺癌细胞的黏附。但七氟醚对人乳腺癌细胞株黏附...
环磷酰胺 (cyclophosphamide, CP) 是一种常用抗肿瘤药, 用于肺癌、结肠癌等疾病的治疗。一般来讲CP会特异性靶向癌细胞, 但对正常细胞也有毒害作用, 如白细胞减少, 脱发等, 而且对生殖系统的影响特别大。...
伏立康唑作为目前深部真菌感染一线药物,其血药浓度的个体差异还存在尚需研究的因素,本文收集整理相关实验室及病例资料进行统计,从基因型、年龄、性别、溶媒、感染程度及药物相互作用进行统计分析,为临床用药及血药浓度结果解读提供了依据。...