摘 要: 从果胶酶中分离出了一种内切聚半乳糖醛酸酶 (f90-1) , 经SDS-PAGE凝胶电泳测定其相对分子质量约为40. 5 kDa。该酶可以从分子内部断裂果胶大分子, 形成相对分子质量大于1000 Da的果胶片段, 催化活力达12. 5±0. 9 U;当反应温度和pH值分别为50℃和5. 0时, 酶的水解活力较高;金属离子K+、Ca2+、Mg2+和Zn2+的存在可以提高酶的活性, 而Cu2+、Ba2+和Fe3+则有抑制作用。
关键词: 内切聚半乳糖醛酸酶; 分离; 酶活性; 分子量;

Abstract: An endo-polygalacturonase ( f90-1) was isolated from the pectinase, and its relative molecular weight was estimated to be 40. 5 kDa via the SDS-PAGE gel electrophoresis. It was proven that this enzyme could break down the pectic macromolecules into small fragments ( > 1000 Da) internally, and the enzymatic activity reach to 12. 5 ± 0. 9 U. The hydrolysis activity of the enzyme was higher when the reaction temperature and pH were 50 ℃ and 5. 0, respectively. Meanwhile, the enzymatic activity could be enhanced by K+, Ca2+, Mg2+, Zn2+, and inhibited by Cu2+, Ba2+and Fe3+.
Keyword: endo-polygalacturonase; isolation; enzymatic activity; molecular weight;
果胶酶 (Pectinase) 是能够降解果胶大分子的一系列酶的总称, 包括原果胶酶、聚半乳糖醛酸酶、果胶裂解酶、果胶酯酶和其他酶组分[1], 其与果实的成熟、软化以及抗病能力有着密切的联系[2]。果胶酶存在于绝大多数植物中, 同时也是一些微生物的重要代谢产物, 如黑曲霉[3]。果胶酶在生物、纺织和饲料工业中均有着重要的应用[4], 尤其是在食品工业中, 可以提高果蔬汁的出汁率、澄清果汁[5]、改善酒的色泽和气味等[6]。
聚半乳糖醛酸酶 (Polygalacturonase, PG) 是果胶酶中一种主要的水解酶, 可进一步分为内切聚半乳糖醛酸酶 (endo-PG) 和外切聚半乳糖醛酸酶 (exoPG) [7]。内切聚半乳糖醛酸酶可以随机断裂果胶主链内部非酯化半乳糖醛酸间的α-1, 4糖苷键, 产生不同聚合度的果胶分子, 果胶低聚糖被认为是一种良好的益生元, 可以促进双歧杆菌和乳酸菌的生长, 增加直肠真杆菌数量并促进丁酸盐的产生, 提高肠道的吸收和消化能力[8]。低分子果胶则被证明为一种生物功能性物质, 具有抗肿瘤、增强免疫力、改善肥胖和降低血糖等功效[9]。利用内切聚半乳糖醛酸酶定向水解果胶大分子不仅提高了果胶分子的生物活性, 同时也拓展了果胶的利用范畴。
目前, 市场上销售的内切聚半乳糖醛酸酶多与果胶酶 (EC.3.2.1.15) 混淆, 纯化的内切聚半乳糖醛酸酶仅见于一些实验室报道, 且存在一些不同的结论[10,11]。本研究以黑曲霉 (Aspergillus niger) 发酵生产的果胶酶制剂为原料, 采用逐级盐析、离子交换吸附和凝胶电泳技术分离、鉴定出了一种内切聚半乳糖醛酸酶, 采用透析与3, 5-二硝基水杨酸 (DNS) 相结合的方法对该内切酶进行了鉴定, 并对影响该酶催化活性的因素进行了分析。
1、 材料与方法
1.1、 试剂和仪器
果胶酶 (黑曲霉Aspergillus niger发酵生产) 购自山东丰泰生物科技有限公司;果胶 (半乳糖醛酸>74%) 购于麦克林有限公司;丙烯酰胺购自寰宇科技 (北京) 有限公司;N, N-亚甲基双丙烯酰胺购自上海麦克林生化科技有限公司;Tris、过硫酸铵 (APS) 、四甲基乙二胺 (TEMED) 及十二烷基磺酸钠 (SDS) 购自国药集团化学试剂有限公司;DEAE-纤维素D-52阴离子交换树脂购自Sigma公司。其他试剂均为分析纯。
UV-1600型紫外-可见分光光度计:上海美谱达仪器有限公司;TGL-16G高速离心机:上海安亭科学仪器厂;DYCZ-24DN型电泳装置:北京六一生物科技有限公司;24位平行合成仪:岩征仪器有限公司;透析袋 (MWCO为1000 Da、3500 Da和100 k Da) :北京Solarbio科学和技术有限公司。
1.2、 实验方法
1.2.1、 粗酶的制备
称取5.0 g果胶酶粉剂溶于100 m L蒸馏水中, 充分溶解后3000 rpm离心10 min, 取上清液, 加入适量的饱和硫酸铵溶液使体系的最终浓度为70%, 静置过夜;缓慢将上清液倒入另一个烧杯中, 备用;沉淀物 (少量液体溶解) 用透析袋 (MWCO为3500Da) 对自来水透析24 h, 然后再对蒸馏水透析24 h, 冷冻干燥后, 备用。向上述的清液中加入适量的饱和硫酸铵, 使硫酸铵浓度分别为80%和90%, 重复以上操作, 制得相应的粗酶。
以1% (w/v) 的果胶溶液为底物, 利用3, 5-二硝基水杨酸 (DNS) 法测定不同组分的酶活[12]。酶活的单位:1 mg粗酶在50℃, p H值6.0下, 1 h水解果胶产生1μmol还原糖定义为1个酶活单位。利用考马斯亮蓝法[13], 以牛血清白蛋白为标准品测定不同盐析组分中蛋白质的含量, 计算比活。
1.2.2、 粗酶的分离
利用DEAE-纤维素D-52阴离子交换树脂进一步分离沉淀组分:预处理好的阴离子树脂加入层析柱 (35 mm×500 mm) , 树脂高度15 cm。粗酶配置成5.0 mg/m L的水溶液, 上样量为5 m L, 依次用蒸馏水, 0.1、0.2、0.3、0.4、0.5 mol/L的Na Cl溶液进行洗脱, 洗脱速率为5 m L/min, 每个梯度洗脱30min。洗脱液用部分收集器收集, 每管收集10 m L。分别测定不同试管中溶液在280 nm处的吸光度, 绘制洗脱曲线。根据洗脱曲线进行收集, 透析后冷冻干燥, 备用。
1.2.3、 酶的活力测定
配制0.5% (w/v) 的果胶溶液, 装入透析袋 (MWCO为100 k Da) 对蒸馏水透析48 h, 适当浓缩后, 冷冻干燥, 制得相对分子质量大于100 k Da的果胶。配制成浓度为0.5% (w/v) 的果胶溶液, 作为酶活性测试的底物。
取10 m L的上述底物溶液, 加入1 mg不同的酶组分, 在50℃, p H6.0条件下, 利用平行合成仪催化反应6 h, 每个酶组分设置3个平行样。反应结束后, 100℃水浴加热10 min, 使酶失活。利用DNS法测定反应前后底物中还原糖的摩尔质量, 计算酶的总活力。底物装入透析袋 (MWCO为1000 Da) 置入一定量的双蒸水中透析48 h, 期间换水两次。合并透析袋外的双蒸水, 减压浓缩至5.0 m L。利用DNS法分别测定反应前底物还原糖摩尔质量, 以及酶促反应后透析袋内、外的还原糖摩尔质量。
1.2.4、 酶的纯度和相对分子质量
采用SDS-聚丙烯酰胺凝胶电泳 (PAGE) 法测定各酶组分的纯度和相对分子质量。浓缩胶和分离胶的质量分数分别为3%和12%, 120 V电压下电泳2h。
1.2.5、 影响酶催化活性的因素
(1) p H值的影响。
利用HCl和Na OH调节底物溶液的p H, 测定酶组分在p H值为3-11底物溶液中的酶活, 具体条件同1.2.3小节。
(2) 温度的影响。
测定酶组分在30℃、40℃、50℃、60℃和70℃下的催化活性, 其他条件同第1.2.3小节。
(3) 金属离子的影响。
测定了Ka+、Ca2+、Cu2+、Mg2+、Zn2+、Ba2+和Fe3+离子 (0.01 mol/L) 对酶催化活性的影响, 反应条件如第1.2.3小节所述。
1.2.6、 数据分析
样品设置3个平行, 测定结果以平均值±标准差表示。数据用Origin Pro 8.0软件进行分析, p<0.05为差异显着。
2、 结果与分析
2.1、 果胶酶的初步分离
利用饱和硫酸铵溶液逐级增加酶液的硫酸铵浓度至70%、80%和90%, 得到三种不同的沉淀物。结果显示, 80%和90%饱和度下产生的沉淀物具有较高的酶活, 且蛋白质含量较高。70%沉淀物中仅含有0.03%的蛋白物质, 杂质较多。由以上结果可见当硫酸铵浓度达到80%以上时, 果胶酶中的蛋白开始沉淀析出;当硫酸铵浓度达到90%以上时, 酶组分的比活显着升高 (见表1) 。
表1 不同沉淀物的活性
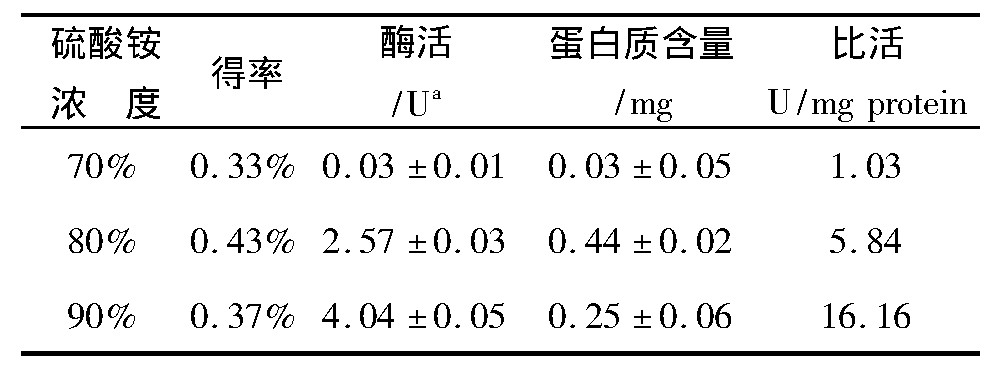
a酶活单位的定义:1 mg沉淀物在50℃, p H 5.0条件下, 1h水解果胶产生1μmol还原糖定义为一个酶活单位。
2.2、 酶组分的分离
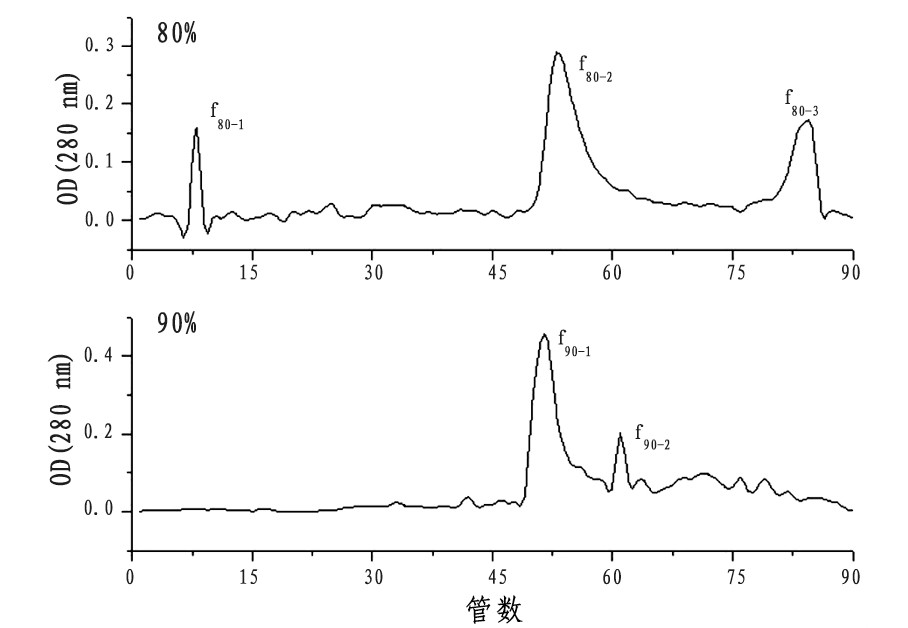
如图1所示, 80%饱和度盐析制得的沉淀物出现了三种组分, 分别对应着双蒸水 (f80-1) 、0.3 mol/L的Na Cl溶液 (f80-2) 和0.5 mol/L的Na Cl溶液 (f80-3) 的洗脱。而90%饱和度得到的沉淀物则仅提供了两种蛋白组分, 分别对应着0.3 mol/L的Na Cl溶液 (f90-1) 和0.4 mol/L的Na Cl溶液 (f90-2) 的洗脱。两种沉淀物出现的主要蛋白组分均由0.3 mol/L的Na Cl溶液洗脱获得, 但是80%沉淀物包含的酶组分更为复杂。
图1 不同饱和度盐析制得沉淀物的阴离子交换色谱图
2.3、 不同酶组分的活性分析
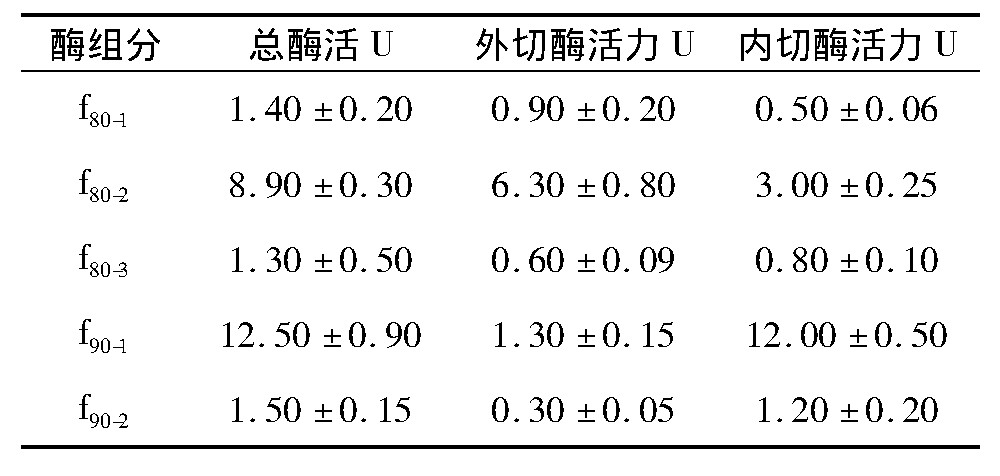
本研究将DNS法与透析法相结合, 预先对果胶底物进行透析处理, 使底物的相对分子质量大于100 k Da。酶催化反应后, 先用透析袋 (MWCO=1000 Da) 进行透析, 透析袋外的单 (寡) 糖可被认为是由外切聚半乳糖醛酸酶水解形成的产物, 而透析袋内还原糖摩尔质量的增加则被认为是由内切聚半乳糖醛酸酶水解引起的。分别测定了5种蛋白组分的催化能力 (见表2) , 结果显示组分f80-2和f90-1具有较强的果胶降解活性, 其他三种组分的活性则较小。酶组分f80-2催化形成的果胶产物分别存在于透析袋 (MWCO=1000 Da) 内和透析液中, 这表明该组分可能具有内切和外切聚半乳糖醛酸酶;相比较而言, f90-1催化形成的产物则主要存在于透析袋内, 这表明该组分是从果胶分子内部断开糖苷键, 形成的果胶片段具有较高的相对分子质量。
表2 不同蛋白组分的水解活性
2.4、 酶组分的电泳分析
利用聚丙烯酰胺凝胶电泳法分析了f80-2和f90-1的纯度和相对分子质量, 如图2所示。结果表明, f80-2由两种蛋白组成, 其分子量分别为15 k Da (f80-2-1) 和40.5 k Da (f80-2-2) , f90-1则呈现单一的条带, 相对分子质量为40.5 k Da。结合表2可知, f80-2-1为外切聚半乳糖醛酸酶, 而f80-2-2和f90-1则为内切聚半乳糖醛酸酶。
图2 f80-2和f90-1的SDS-PAGE电泳图
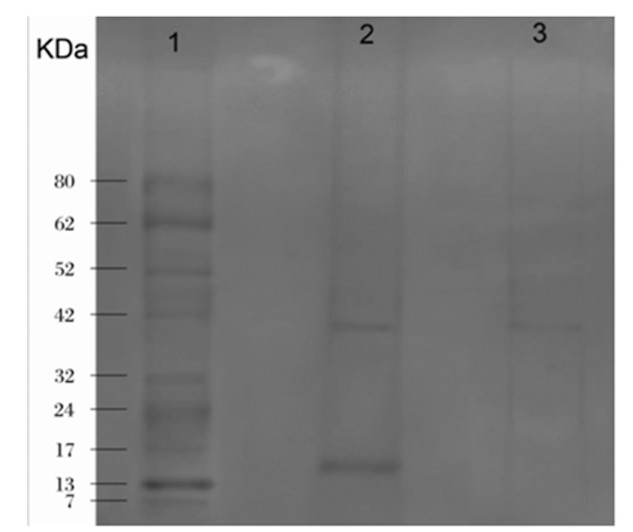
1.Marker;2.酶组分f80-2;3.酶组分f90-1.
2.5、 不同因素对酶活性的影响
2.5.1、 温度对酶f90-1活性的影响
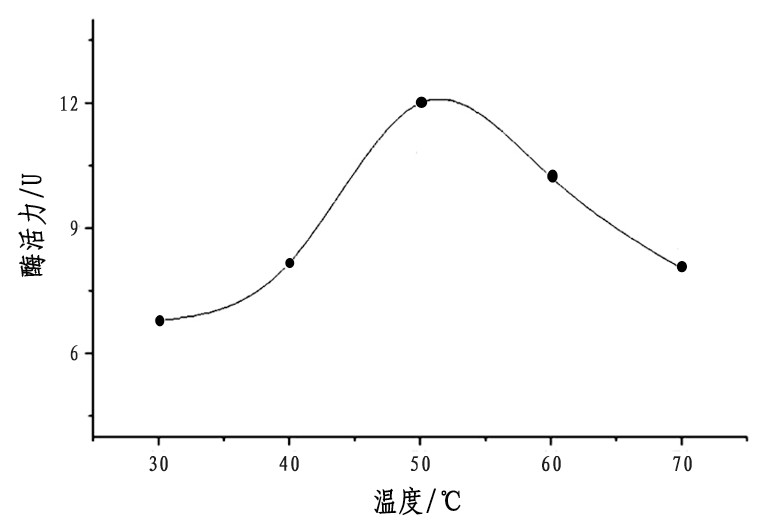
温度是影响酶催化活性的一个重要因素, 研究发现在50℃时, 酶组分f90-1的催化活性最好, 随着温度的降低和升高, 催化活性均显着下降, 如图3所示。
图3 温度对酶f90-1活性的影响
2.5.2、 p H值对酶f90-1活性的影响
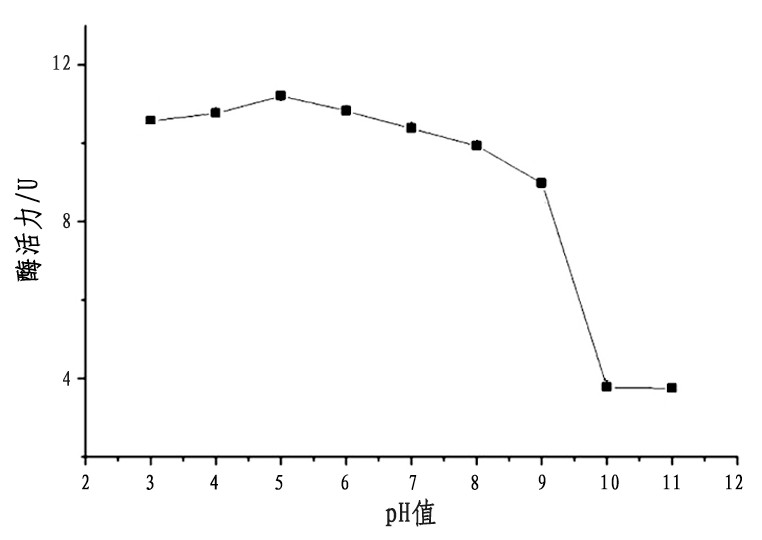
由图4可知, 酶f90-1在酸性条件下具有较好的水解能力, p H为5.0时, 酶的活性最高。当反应体系的p H值大于6.0时, 酶的活性开始降低, 当p H值高于9.0时, 酶的活性急剧下降。之前的研究也发现, 真菌产生的内切聚半乳糖醛酸酶在酸性条件下具有较高的活性, 而细菌产生的则在碱性条件下活性较高[14,15]。
图4 p H值对酶f90-1活性的影响
2.5.3、 金属离子对酶f90-1活性的影响
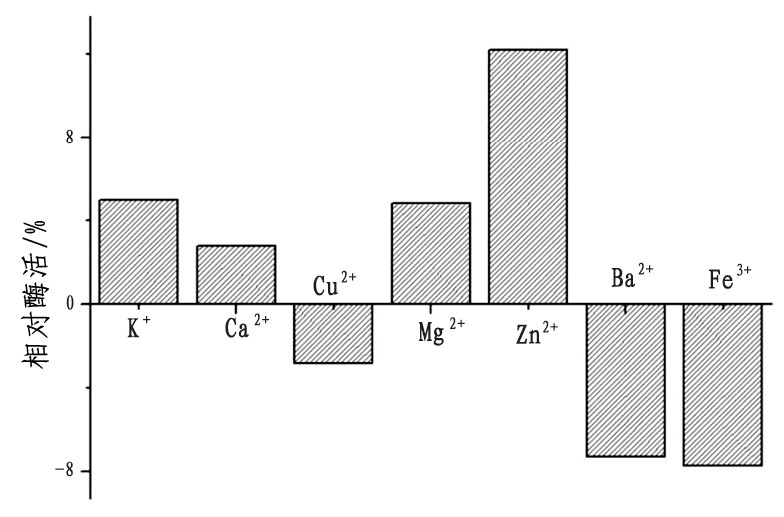
金属离子可以诱导蛋白正确的折叠, 从而增强酶与底物的结合。如图5所示, K+、Ca2+、Mg2+和Zn2+离子可以增强酶f90-1的催化活性。在Zn2+离子存在的情况下, f90-1酶组分的活性可增至控制组的148%;Cu2+、Ba2+和Fe3+离子的加入则对酶的催化有抑制作用。
图5 金属离子对酶f90-1活性的影响
3、 结论
内切聚半乳糖醛酸酶的活性多采用DNS法进行测定, 即通过测定反应体系中还原糖量的变化来表征酶的活性。然而, 果胶酶中不仅含有内切聚半乳糖醛酸酶, 同时还含有外切聚半乳糖醛酸酶, 其同样会增加反应体系中的还原糖。因此, 单一的DNS法不能直接说明内切聚半乳糖醛酸酶的活性大小。本研究将DNS法与透析法相结合, 分别测量了外切和内切聚半乳糖醛酸酶催化形成的还原糖含量, 其数据可以更真实地用于酶活性的评价。
采用逐级沉淀、离子交换吸附和凝胶电泳的方法从黑曲霉发酵产生的果胶酶制剂中分离、筛选出了一种相对分子质量为40.5 k Da的蛋白组分 (f90-1) , 该蛋白可以催化降解大分子果胶, 增加反应底物中还原糖的浓度, 形成的果胶片段相对分子质量大于1000 Da, 具有内切聚半乳糖醛酸酶的催化特征。该酶的最佳水解温度和p H值分别为50℃和5.0, 金属离子K+、Ca2+、Mg2+和Zn2+ (尤其是Zn2+) 的存在可以提高其催化活性, 而Cu2+、Ba2+和Fe3+离子的存在起到抑制作用。
参考文献:
[1]康晶, 刘晓兰, 郑喜群, 等.黑曲霉YY-22产酸性果胶酶的分离纯化[J].现代食品科技, 2014, 30 (5) :191-195.
[2]冯浩, 何媛媛, 甄伟, 等.苹果树腐烂病菌胞外果胶酶分离纯化及性质[J].微生物学通报, 2017, 44 (3) :639-647.
[3]陈永强, 严芬, 叶秀云, 等.高产果胶酶菌株的筛选鉴定及其发酵条件研究[J].中国食品学报, 2014, 14 (2) :138-145.
[4]李琦, 李国高, 刘绍, 等.果胶酶应用的研究进展[J].中国农学通报, 2014, 30 (21) :258-262.
[5]张东亚, 王静, 刘凤兰, 等.果胶酶澄清高酸海棠果汁工艺研究[J].食品工业, 2014, 35 (1) :62-65.
[6]李虎, 赵爱辉, 周辉, 等.果胶酶对慕萨莱思葡萄酒澄清效果的研究[J].中国食品添加剂, 2014 (5) :100-104.
[7]张飞, 岳田利, 费坚, 等.果胶酶活力的测定方法研究[J].西北农业学报, 2014, 13 (4) :134-137.
[8]黄林华, 吴厚玖, 马亚琴, 等.果胶低聚糖的研究进展[J].食品科学, 2015, 36 (19) :277-281.
[9]尹颖, 陆胜民, 陈建兵, 等.柑橘皮渣制备低分子果胶及其抗癌活性的评价[J].浙江农业学报, 2013, 25 (3) :614-618.
[10]林洪宝, 傅蓉, 薛伟明, 等.从黑曲霉发酵的果胶粗酶中分离纯化内切聚半乳糖醛酸酶[J].福州大学学报, 2002, 30 (5) :632-635.
[11]刘明启, 戴贤君, 白兰芳.黑曲霉内切聚半乳糖醛酸酶A基因在大肠杆菌中的表达及产物酶学性质研究[J].中国计量学院学报, 2012, 23 (4) :403-409.
[12]李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J].食品工业科技, 2013 (18) :75-77.
[13]邓丽莉, 潘晓倩, 生吉萍, 等.考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J].食品科学, 2012, 33 (22) :185-189.
[14]傅玲琳, 富舒洁, 王彦波, 等.凡纳对虾肌球蛋白硫酸铵沉淀分离纯化方法的优化[J].食品科学, 2017, 38 (18) :187-192.
[15]YANG J, LUO HY, LI J, et al. Cloning, expression and characterization of an acidic endo-polygalacturonase from Bispora sp. MEY-1 and its potential application in juice clarification[J]. Process Biochemistry, 2011, 46:272-277.
1引言DNA纳米结构由于精确可控的几何外形而在众多领域有着潜在应用[1].与无机纳米材料相比,DNA纳米结构的合成遵循Watson-Crick碱基互补配对原则,自下而上制备,具有很多独特的性质:尺寸和形状精确可控、化学反应活性、空间可寻址性等.迄今为止,研...
制备型高效液相色谱的发展和推广对加速天然生物碱的发现具有重大意义, 多维正交分离的方式在复杂生物碱的分离上表现出良好的前景, 相信随着新技术和新方法的发展, 高效液相色谱技术将在生物碱的分离制备领域具有更加广阔的应用空间。...
手性现象在自然界中广泛存在,诸如L-构型的天然氨基酸(甘氨酸无手性碳)、D-构型核糖以及右旋的DNA等[1].手性化合物的对映异构体,尤其是手性药物,通常具有不同的药物活性、作用机理、代谢途径和毒理作用等,因而获得单一对映异构体至关重要,这也是分...