
水分是植物生长的必要条件,土壤水分是影响植物体内水分状况的重要因素.迄今关于植物在干旱胁迫下生理生化特征变化的研究较多,大量研究表明:干旱胁迫会导致植物细胞内活性氧自由基产生和清除的不平衡,从而出现活性氧自由基的大量积累,并由此引发和加剧了细胞的膜脂过氧化,对植物造成伤害.植物体内为保护自身免受伤害形成相应的抗氧化保护系统,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)等,在清除超氧自由基、过氧化氢和过氧化物以及阻止或减少羟基自由基形成等方面起着重要的作用,保护植物细胞膜和敏感分子免受活性氧的伤害[1-3].
红花玉兰(MagnoliawufengensisL.Y.Ma et L.R.Wang)[4]为2004年被首次发现的木兰科木兰属玉兰亚属新种,在发现红花玉兰新种的同时发现了与红花玉兰处于相同与相近分布区的多瓣红花玉兰(Magnolia wufengensisvar.multitepalaL.Y.Ma etL.R.Wang)[5]类群,具有极高的观赏价值和科研价值,可作为城市绿化树种和山地造林树种,具有广阔的推广应用前景.由于红花玉兰仅发现一株且很少结实,所以本研究中选用多瓣红花玉兰为材料.近年来对红花玉兰的抗逆性研究多集中在抗寒性方面,且表现为低温胁迫下质膜相对透性升高,可溶性糖及脯氨酸含量增加[6];随着温度的降低,红花玉兰枝条的SOD、POD、CAT 3种酶的活性逐渐增强,具有一定的耐寒潜力[7].但至今关于红花玉兰抗旱性方面的研究还未见报道.本实验以一年生多瓣红花玉兰幼苗为材料,通过盆栽试验研究不同干旱胁迫对红花玉兰幼苗生长和生理生化特性的影响,以探讨红花玉兰对不同土壤水分条件的反应和适应能力,为红花玉兰的引种和推广利用提供依据.
1、 材料和方法
1.1 材 料
以红花玉兰种子为试验材料进行盆栽试验.盆栽选用直径10 cm、高15 cm的塑料容器,每盆装风干土1.0 kg,土壤为椰绒B腐质土=1B3,选取籽粒饱满、大小一致、无病虫害的种子于2009年3月23日播种,每盆播种3粒,播种后置于三峡大学温室内进行培养,保证土壤水分充足,使之不会成为苗木生长的限制因子,使其萌芽,幼苗出土后通过间苗每盆保留1株,缓苗生长3个月,于7月中旬选取长势一致的苗木进行控水处理.
1.2 处 理
采用完全随机区组试验设计,设置对照(CK)、轻度胁迫(T1)、中度胁迫(T2)和重度胁迫(T3)4个水分处理梯度,每处理5次重复.采用称重法进行控水处理,CK、T1、T2和T3处理土壤水分含量依次为田间最大持水量的75%~80%、55%~60%、40%~45%和25%~30%.
1.3 测定指标及方法
1.3.1 生理生化指标 各处理在胁迫的第10、20、30、40、50天的早上取第3~5叶位成熟叶片,立即带回实验室进行超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性及相对含水量(RWC)、丙二醛(MDA)和游离脯氨酸(Pro)含量测定,在第50天时测定叶绿素和可溶性蛋白含量,均重复3次.其中,SOD活性采用NBT还原法[8]测定,POD活性采用愈创木酚显色法[9]测定,CAT活性采用紫外线分光光度计吸收法[10]测定,APX活性采用紫外分光光度法[8]测定;叶片RWC采用烘干法[11]测定,MDA含量采用硫代巴比妥酸法[11]测定;脯氨酸(Pro)含量采用磺基水杨酸提取茚三酮显色法[9]测定;叶绿素含量采用紫外分光光度计比色法[12]测定;可溶性蛋白含量采用李合生的考马斯亮蓝法[13]测定.
1.3.2 生长指标 在处理的第50天,每处理水平于标记处测定苗高(H,cm)、地径(D,cm);分别用流水冲松盆土,轻取幼苗,洗净吸干,在万分之一天平上称单株鲜重,最后在105e杀青20 min后,于80e烘箱中烘干至恒重,分器官称其根、茎、叶干重,并进一步计算生物量和根冠比,每处理测定样株5株,取平均值.
1.4 数据统计分析
用SPSS 16.0进行方差分析,Excel统计并制图.
2 、结果与分析
2.1 干旱胁迫对红花玉兰幼苗生长的影响
从表1可以看出,随着干旱胁迫的加剧,红花玉兰单株苗高、地径和根、茎、叶生物量均逐渐减少.其中,株高在T1、T2、T3处理与CK相比分别显著下降21%、23.64%、34.22%(P<0.05);地径在T1处理下与CK无显著差异,在T2和T3处理中分别比CK显著下降22.78%、27.84%(P<0.05);地上部分茎、叶生物量及总生物量在T1处理下与CK无显著差异,在T2和T3处理下极显著低于CK(P<0.01),而地下部分根(包括主根和侧根)生物量仅在T3处理下较CK受到显著抑制(P<0.05);根冠比在各水分处理条件下与CK均无显著差异,在T1处理下比CK下降10.30%,在T2和T3处理下分别比CK上升3.5%、6.8%.以上结果表明,干旱胁迫抑制红花玉兰单株生物量累积,并在一定程度上能抑制其地上部分生长、促进地下部分生长,从而使光合产物分配到根的比例增多,并通过提高根冠比来适应土壤干旱胁迫.
2.2 干旱胁迫对红花玉兰幼苗叶绿素含量和叶片组织相对含水量的影响
2.2.1 叶绿素含量 表2显示,各干旱胁迫处理对红花玉兰幼苗叶绿素含量产生一定的影响,其Chla、Chl b、Chl含量在T1处理下较CK无显著差异,三者在T2处理中分别比CK显著降低33.52%、15.35%和29.40%,在T3处理中分别比CK显著下降64.28%、23.95%和55.08%(P<0.05);Chla/Chl b在T1和T2处理下与CK差异不显著,在T3处理下显著降低53.84%(P<0.05).以上结果表明,轻度干旱胁迫对红花玉兰叶片光合潜力的影响不大,在中度和重度干旱胁迫时红花玉兰叶片的光合潜力受到显著抑制;叶绿素a对活性氧的反应较叶绿素b敏感,使得叶绿素a的降低幅度高于叶绿素b,导致叶绿素a/b比值下降;叶绿素含量降低抑制了光合作用中的光能吸收与转化作用.
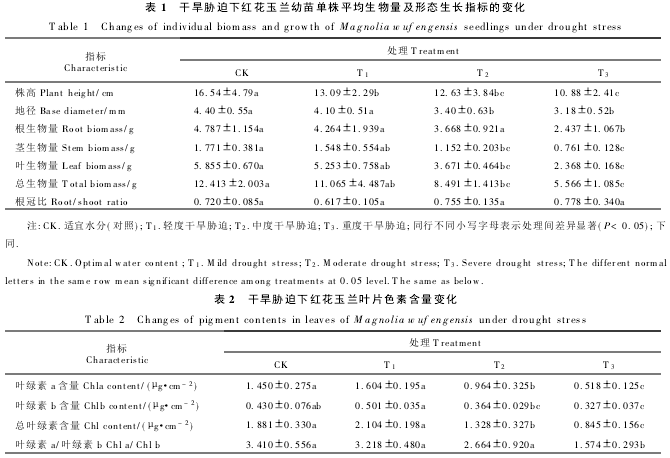
2.2.2 叶片组织相对含水量(RWC) 如图1所示,红花玉兰幼苗叶片组织相对含水量均随着干旱胁迫程度的加剧而有所下降,且其在同一处理水平下随着胁迫时间的延长也呈逐渐下降的趋势.其中,在T1处理下各处理时间与CK相比均无显著差异;T2和T3处理在胁迫初期各处理叶片相对含水量下降缓慢,与CK之间无显著差异,而在胁迫第50天时,T2和T3处理相对含水量分别为69.68%、58.47%,与同期对照相比分别下降了17. 99%、31.19%,差异达到极显著水平(P<0.01).以上结果表明,干旱胁迫程度越重,胁迫时间越长,红花玉兰幼苗叶片的相对含水量下降得越快,即叶片受影响程度与干旱胁迫程度呈正比.
2.3 干旱胁迫对红花玉兰幼苗可溶性蛋白、脯氨酸和丙二醛含量的影响
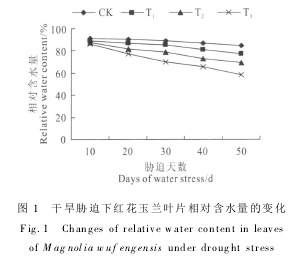
2.3.1 可溶性蛋白含量 从图2,A可以看出,红花玉兰幼苗叶片可溶性蛋白含量随着干旱胁迫程度的加剧而逐渐积累升高,且在T1处理下与CK相比无显著差异,而在T2和T3处理下分别高出对照60.69%和167.35%,差异达到极显著水平(P<0.01).可见,干旱胁迫对红花玉兰叶片的可溶性蛋白含量影响较大,可溶性蛋白在其抵御干旱逆境时起到了重要的调节作用.
2.3.2 脯氨酸(Pro)含量 由图2,B可知,红花玉兰幼苗叶片Pro含量均随着干旱胁迫程度的加剧而有所上升;在同一处理水平条件下,随着胁迫时间的延长,叶片Pro含量也呈现逐渐升高的趋势.其中,T1处理在胁迫后的前40 d内Pro含量与CK相比无显著差异,而在胁迫处理50 d时差异显著(P<0.05);T2和T3处理Pro含量在胁迫20 d时与CK相比差异显著(P<0.05),随着胁迫时间的延长,Pro含量逐渐升高,在胁迫50 d时,T2和T3处理Pro含量较CK分别极显著上升了137.96%、146.88%(P<0.01).表明随着干旱胁迫时间的延长,红花玉兰幼苗叶片表现出明显的脯氨酸积累现象,而且胁迫程度越强,脯氨酸的积累现象越明显.
2.3.3 MDA含量 如图2,C所示,红花玉兰幼苗叶片MDA含量在各处理水平变化趋势大体相同,即随着胁迫时间的延长,MDA含量呈现先升后降再升的趋势.其中,在胁迫处理第20天时,各处理的MDA含量都升高到第一个峰值,此时T1、T2、T3处理的MDA含量分别显著高于对照28. 71%、36.40%和62.14%(P<0.05),且T2、T3处理达到极显著水平(P<0.01);在胁迫第30天时,各处理MDA含量降低到低谷值后开始回升,且各处理间无明显差异.表明干旱胁迫下红花玉兰叶片膜脂过氧化作用逐渐加强,膜系统受到破坏,膜透性增加.
2.4 干旱胁迫对红花玉兰幼苗保护酶活性的影响
大量研究证据表明,干旱诱导的膜脂过氧化是造成植物细胞膜受到损伤的关键因素,而膜伤害是导致植物组织伤害和衰老的重要诱导因素,但植物在干旱胁迫时可以动员保护酶来有效清除自由基,保护细胞膜免遭氧化伤害.干旱胁迫下,保护酶活性的变化因植物品种、胁迫方式、胁迫强度和胁迫时间而不同,整个保护酶系统的防御能力的变化取决于这几种酶彼此协调的综合结果[14].
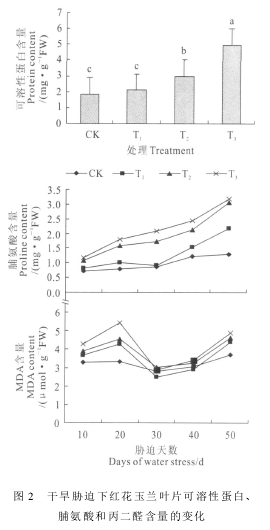
2.4.1 SOD活性 图3,A显示,在干旱胁迫期间,CK红花玉兰叶片的SOD活性基本保持稳定,T1、T2、T3处理的叶片SOD活性均明显高于同期对照.
其中,在胁迫处理初期,各处理叶片SOD活性呈现上升的趋势,在胁迫30 d时增至最高点,此时T1、T2、T3的SOD活性分别显著高于CK 50.77%、101.57%和131.05%(P<0.05),且T2、T3处理达到极显著水平(P<0.01),即SOD在清除活性氧方面起到重要的作用;在干旱胁迫后期,各处理叶片的SOD活性逐渐下降,但其SOD活性仍明显高于对照且维持在较高水平,这说明长时间干旱胁迫将使各处理红花玉兰幼苗抗氧化能力逐渐衰退,从而对红花玉兰幼苗产生伤害,但SOD仍具有一定的清除效应.2.4.2 POD活性 从图3,B可以看出,POD活性的变化趋势与SOD活性一致,随着不同处理胁迫时间延长,POD活性基本呈现先升后降的变化趋势,在整个胁迫过程中T1处理与CK相比无显著差异,T2、T3处理的POD活性在胁迫前期明显升高,在胁迫30 d时达到最大值,此时T2和T3处理与CK相比分别显著升高62.56%(P<0.05)和82.97%(P<0.01).这说明红花玉兰叶片保护酶POD活性在干旱胁迫下增强,能通过增强POD活性来抵御干旱逆境对其所造成的伤害.
2.4.3 CAT活性 由图3,C可以看出,在整个干旱胁迫期间,T1、T2、T3处理叶片的CAT活性均明显高于同期对照;随着胁迫时间的延长,不同处理的CAT活性表现出先升后降的总体趋势,并在胁迫30 d时均达到最大值,此时T1、T2、T3处理CAT活性分别为25.78、26.23和33.74 U!g-1FW!min-1,分别较CK高44.58%、47.11%和89.23%,且与CK差异极显著(P<0.01).可见,红花玉兰有较强的清除活性氧的能力,但长时间的胁迫也会造成一定的伤害;同时,干旱胁迫处理末期红花玉兰的CAT活性仍维持在较高的水平,表明此时的CAT仍有一定的有效性,从而将活性氧的伤害限制在一定的范围内.
2.4.4 APX活性 图3,D显示了干旱胁迫各处理
梯度的APX活性变化情况.其中,在干旱胁迫期间,CK处理的APX活性基本保持稳定,T1、T2、T3处理均高于同期CK;在整个胁迫过程中,各处理APX活性呈先上升后下降的趋势,T2、T3处理在胁迫30 d时增至最高点,而T1处理在胁迫40 d时增至最高点;在干旱胁迫30 d时,T1、T2、T3的APX活性分别显著高于同期CK的44.24%、90.09%和99.33%(P<0.05),且T2、T3处理达到极显著水平(P<0.01).结果表明,红花玉兰幼苗叶片中APX活性在干旱胁迫下保持较高水平,在清除活性氧的过程中发挥着重要作用,使红花玉兰幼苗表现出较强的干旱伤害修复能力.
3、 讨 论
3.1 干旱胁迫下红花玉兰幼苗生长指标变化特征
生长量是植物对干旱胁迫的综合反应,也是评估干旱胁迫程度和植物抗旱能力的可靠标准.大量研究表明,干旱胁迫条件下,植物生长受到抑制,且胁迫程度越高,受抑制现象越明显[15].本研究结果表明,干旱胁迫对红花玉兰幼苗的生长和生物量分配具有明显的影响,但仍维持其缓慢生长,保持一定的生物量增加,通过不断调整其生长和生物量的分配策略来适应干旱胁迫.
同时,叶片相对含水量(RWC)是植株叶片细胞水分生理状态的反映,在一定程度上反映了植物组织水分亏缺程度[16].许多研究证实:植物叶片RWC随着胁迫程度增加而逐渐降低[17],相对较高的RWC可以有效地保持叶绿体的结构和PS?功能,使植物进行有效的光合作用[18].本试验结果表明,红花玉兰幼苗在干旱胁迫条件下,土壤中可利用水分减少,导致根系吸水困难,植株组织水分亏缺,胁迫程度越高,亏缺越严重,但仍维持在较高水平.这说明红花玉兰幼苗在干旱胁迫下通过维持较高的RWC来保持其PS?功能的完整性,从而使植株保持较高水平的光合作用.
此外,叶绿素含量是植物对干旱胁迫反应敏感性的生理指标,大量的研究结果表明,干旱胁迫通过抑制叶绿素合成,并加速其分解,导致叶绿素含量直线下降[19-20].本试验结果表明,随着胁迫程度加剧,Chl a、Chl b和Chl含量先升高后降低,在T1条件下最高,这种变化可能是植物生长受到抑制,对叶面积减小有补偿作用,是幼苗维持光合速率的生理适应机制;在T2、T3条件下大幅降低,可能与干旱胁迫下诱导叶绿体发生膜脂过氧化而产生的活性氧、丙二醛对叶绿素的破坏有关.
3.2 干旱胁迫下红花玉兰幼苗渗透调节物质含量变化特征
可溶性蛋白具有较强的亲水胶体性质,影响着细胞的保水力,植物通过可溶性蛋白的主动积累来降低渗透势,进行渗透调节.有研究结果表明,随着干旱胁迫的加重,植物幼苗叶片可溶性蛋白含量先减少后增加,可溶性蛋白含量降低可能是由于蛋白酶的活性升高,使其水解加快,干旱使RNA转录和翻译受到抑制,蛋白质合成减少[21].本实验结果表明,红花玉兰叶片可溶性蛋白含量在3个胁迫程度下持续增加,可能是因干旱胁迫下,红花玉兰幼苗体内正常的蛋白质合成受到抑制,一些与适应胁迫有关的基因启动表达,从而引起蛋白质的合成并产生胁迫诱导蛋白.
脯氨酸是植物体内重要的渗透调节物质,脯氨酸含量的增加对防止细胞内水分的过分丢失、维持细胞膜的完整性起重要作用.当植物受到干旱胁迫时,通过积累大量的脯氨酸来提高细胞的渗透调节能力,从而保证组织水势下降时细胞膨压得以维持[22,23].本试验结果表明,红花玉兰叶片在干旱胁迫下通过脯氨酸的积累来保持一定的含水量和膨压势,以维持细胞正常的功能,说明红花玉兰在干旱胁迫下能有效地积累脯氨酸来提高自身抗旱能力.
3.3 干旱胁迫下红花玉兰幼苗丙二醛含量和保护酶系统变化特征
丙二醛含量的变化是反映膜脂过氧化作用的一个重要指标,其含量可以反映植物遭受逆境伤害的程度[21].前人研究表明,脂质过氧化产物和保护酶活性存在一定的相关性[14,21,24].本试验结果表明:在水分处理初期,红花玉兰叶片MDA的含量逐渐增加,表明干旱胁迫下膜脂过氧化作用逐渐加强,对红花玉兰幼苗造成伤害;胁迫中期由于保护酶活性的增强,有效地清除活性氧,3个水分处理组的MDA含量显著降低,在胁迫后期,保护酶活性降低,但由于前期的抗旱锻炼,对干旱胁迫已具有一定的适应性,3个干旱胁迫处理组与对照相比MDA含量又有所增加,但增加的幅度不是很大,表明受到的伤害程度较小,这与喻晓丽[25]对火炬树(Rhus typhin)的研究结果一致.
SOD、POD、CAT和APX是细胞抵御活性氧伤害的酶保护系统,在清除超氧自由基、控制膜脂过氧化作用,保护细胞膜正常代谢方面起重要作用[26].
SOD、POD、CAT和APX具有协同作用,从而有效清除植株体内过多的自由基,提高了苗木适应干旱胁迫的能力[13].本实验表明:随着干旱胁迫程度的加重,叶片SOD、CAT、POD和APX活性逐渐增强,说明在干旱胁迫下,叶片通过增强保护酶活性来抵御干旱逆境对其所造成的伤害,从而使红花玉兰表现出较强的抗旱能力.在胁迫初期,4种保护酶活性增大,能有效清除活性氧,降低了对细胞膜的膜脂过氧化水平,通过自身的保护酶活性变化来保护其内部组织,防止其受到由于活性氧积累带来的伤害;随胁迫时间的延长,4种酶活性有所下降,但多数情况下保护酶活性仍高于对照,这可能是红花玉兰幼苗已经形成了一定的耐旱机制,维持较高的保护酶活性水平,使活性氧代谢处于一定的平衡状态,避免了活性氧和氧自由基对细胞的毒害作用.本研究发现SOD、POD、CAT和APX的变化规律基本一致,说明在干旱胁迫下4种保护酶活性具有一定的协同作用,从而有效清除植株体内过多的自由基,提高了红花玉兰苗木适应干旱胁迫的能力.
综上所述,红花玉兰幼苗能通过调整自身生长和保护酶活性、叶绿素含量和丙二醛、可溶性蛋白、脯氨酸含量等来提高其抗旱性,从而有效防止了膜脂过氧化对植株的伤害,表现出较强的抗旱耐旱潜力,可以作为城市园林绿化和山地造林树种在长江两岸及华中、华东地区广泛推广应用.
引言【研究意义】菊花(ChrysanthemummorifoliumRamat.)是中国传统名花,深受人们的喜爱。在世界范围内,菊花是市场上主要的鲜切花之一,也是重要的盆花、地被花卉。菊花起源于中国,是菊属部分野生种天然杂交再经人工选育形成的,其主要亲本为毛华菊(C.v...
百合(Liliumspp.)是世界着名切花之一,具有很高的观赏价值,一直深受人们喜爱,是重要的商品花卉和园林绿化植物。自Robb首次离体培养百合鳞茎以来,组织培养技术在百合上的应用已取得了显着的进展,但百合种类繁多,类型各异,目前很多品种尚未形成规模化生...
植物在生长过程中往往受到各种非生物因子的胁迫,其中温度是影响植物生长的重要因子。近年来,全球气温不断升高,在盛夏由于温度高于植物生长的最适温度,甚至超过了植物生长的最高温度,对植物生长发育甚至生命都造成了严重威胁。因此,研究植物在高温胁迫...
1、育种目标近年来随着人们生活水平的提高,人们的健康意识不断增强,而食物中转基因食品、农药残留、环境污染等因素使人们对食品安全的担忧不断加剧,所以人们希望食到健康、天然、保...
蝴蝶兰又称蝶兰,属于兰科,因其花形如彩蝶飞舞而得名。蝴蝶兰是一种多年生附生植物。多年常绿草本,单轴分枝。无假鳞茎,叶短并肥厚,多肉。根系发达,成扁平丛状,从节部长出。蝶状花序腋生,下垂,花开10~20朵。花色常见的有白色、紫色、粉色,现在还有黄色等等。...
大丽花(Dahliapinnata)原产于墨西哥、危地马拉及哥伦比亚一带,是菊科大丽花属的多年生球根草本花卉,花期长,色彩绮丽,具有极高的观赏价值.目前对大丽花的研究主要集中在栽培技术、花芽分化、品种资源与分类、组织培养技术、突变体和病虫害防治等方面,对...
野生植物,是指原生地天然生长的植物。野生观赏植物,从广义上说是具有观赏价值,可在园林中进行应用的野生植物,其观赏特性包括观花、观叶、观果等。野生植物资源是一个地区自然资源的重要组成部分,系统地开展野生植物资源调查,有助于了解一个地区植物资源的基...
花菖蒲(IrisensataThunb)别名玉蝉花,多年生草本,根状茎短粗,须根多数细条形,属鸢尾科鸢尾属。花大直径可达15cm以上旗瓣短于垂瓣,有黄色、鲜红色、蓝色、紫色等,并具蓝色、灰色、黑色带斑点和条纹,色彩多变,园艺品种达数百之...
暴马丁香(Syringareticulatavar.mandshu-rica),俗称暴马子、荷花丁香,木犀科丁香属落叶大灌木或小乔木,高4~15m。主要分布于黑龙江的大小兴安岭、吉林东部山区、辽宁、华北、西北、华中地区,朝鲜、俄罗斯、日本也有分布。暴马丁香喜温暖湿润气候,耐严寒,对...
植物化感作用是植物通过淋溶、挥发、残体分解和根系分泌等方式向环境释放化学物质,从而对周围植物产生直接或间接的、有害或有利的作用。植物间的这种化学作用对作物增产、森林抚育、植物保护和生物防治等方面有着广泛的影响。目前,植物化感作用已...