
慢性缺氧时出现局部肺血管收缩,通气不足的肺组织区域内动脉收缩、血流减少,肺通气相对充足的肺组织血流增加,从而提高氧利用率,有助于维持血氧浓度。持续的肺血管收缩将导致肺动脉高压、右心功能不全。目前对肺动脉高压尚无有效的治疗药物,深入研究肺血管收缩机制有益于提高对该病的防治水平。慢性缺氧性肺血管收缩与多种因素有关,如细胞色素P450、白三烯等,但肺血管收缩的分子机制尚未完全阐明。有报道缺氧可诱导肺小动脉15-脂氧化酶的表达,使其产物15-羟廿碳四烯酸(15-hydroxyeicosatetraenoic acid,15-HETE)生成增加,15-HETE很有可能作为缺氧所诱导的初始因子参与肺血管收缩。由于15-HETE在体内不稳定,极易被氧化,通过对其代谢终产物的比较研究,发现15-酮基二十碳四烯酸(15-ketoeicosatetraenoic acid,15-KETE)具有更强收缩肺血管的作用,因此,15-KETE可能是缺氧诱导肺血管收缩中的重要参与因子。目前尚未见15-KETE引起肺血管收缩的信号转导途径的研究报道。本研究拟探讨15-KETE对缺氧大鼠肺动脉环的收缩是否与细胞外调节蛋白激酶1/2(extracel lularregulated protein kinases1/2,ERK1/2)通路和血管内皮细胞有关,以揭示慢性缺氧性肺血管收缩的机制。
1、材料和方法
1.1材料
1.1.1试剂:15-KETE购于美国Biomol公司,U0126购于Calbiochem公司,其他试剂均为市售国产分析纯。
1.1.2主要仪器设备:肌肉张力换能器(JZ101,高碑店市新航机电设备有限公司);生物信号采集处理系统(Medlab-U-6.0,南京美易科技有限公司),体式解剖显微镜(SMZ-168,Motic)。
1.1.3实验动物:实验用清洁级雄性Wistar大鼠,体质量为(220±20)g,由哈尔滨医科大学实验动物学部提供[SCXK(黑)2013-001]。
1.2方法
1.2.1缺氧动物模型制备:参见文献,将16只健康的Wistar大鼠随机分为两组(n=8),一组置于正常的培养箱中,其吸入氧(FiO2)浓度为21%,作为正常对照组;一组置于缺氧的培养箱中,其吸入氧浓度为10%作为缺氧组,连续饲养9d,培养箱内大鼠呼出的CO2、水蒸气分别用氧化钙和无水氯化钙吸收,排出的氨气由硼酸吸收,大鼠自由采食和饮水。
1.2.2肺动脉血管环张力测定:9d后,用戊巴比妥钠40mg/kg腹腔注射麻醉,开胸取出肺脏,游离直径0.5—1.0mm肺动脉(PA),剪成长约3mm血管环,悬挂在两个钨丝三角环上,一端挂在塑料支架下面的铁钩上,另一端挂在张力换能器的电极上,置于盛有4mL含95%O2-5%CO2混合气的Krebs液中(mmol/L:NaCl118,KCl4.7,CaCl22.5,MgSO40.57,KH2PO41.2,NaHCO324,葡萄糖10,pH7.4,37℃)的恒温浴槽内。在30min内逐渐给肺动脉环负荷0.3g的基础张力,平衡1h。肺动脉环的收缩张力信号通过Medlab-U-6.1生物信号采集处理系统的多通道接头传输到计算机相应处理软件进行数据记录和分析。
1.3实验设计
1.3.115-KETE对正常对照组和缺氧组大鼠肺动脉血管环张力的影响:Krebs液中加入15-KETE的浓度依次从10-8mol/L增加至10-6mol/L,当血管环的张力在一浓度下达到峰值5min后,再加入另一浓度的15-KETE,根据血管环的张力变化绘制出15-KETE浓度反应曲线。
1.3.2去除内皮对15-KETE诱导缺氧大鼠离体肺动脉环收缩力的影响:在上述试验的基础上,选择15-KETE收缩肺动脉环的最佳浓度,观察内皮完整和除去血管内皮后,15-KETE对肺动脉血管环收缩作用的影响。用表面粗糙的金属丝在血管腔内来回穿动5—8次去除内皮,用重酒石酸去甲肾上腺素10-6mol/L收缩血管,然后加入10-6mol/L的乙酰胆碱,若引起舒张反应小于10%,可认定为内皮失去功能。用上述去内皮血管作为实验组,加入收缩肺动脉环最佳浓度的15-KETE,以内皮完整的正常血管环作为对照组,比较张力变化。
1.3.3抑制剂U0126对15-KETE诱导缺氧大鼠离体肺动脉环收缩力的影响:在上述试验的基础上,选择15-KETE收缩肺动脉环的最佳浓度,观察15-KETE收缩大鼠离体肺动脉环的作用,然后用Krebs液冲洗浴槽3—4次,基线恢复到0.3g的基础张力,平衡1h后,在Krebs液中加入ERK1/2抑制剂U0126作用15min,在上述抑制剂存在的条件下,再加入缩肺动脉环最佳浓度的15-KETE,观察抑制ERK1/2后,15-KETE对大鼠肺动脉环收缩力的影响。
1.3.4除内皮动脉环并经U0126孵育对15-KETE诱导缺氧大鼠离体肺动脉环收缩力的影响:机械法去除血管内皮,检测内皮是否完整去除的方法是乙酰胆碱产生的血管舒张幅度小于异丙肾上腺素预收缩幅度的10%。选择收缩肺动脉环的最佳15-KETE浓度,观察其收缩大鼠离体肺动脉环的作用,然后用Krebs液冲洗浴槽3—4次,基线恢复到0.3g的基础张力,平衡1h后,在Krebs液中加入ERK1/2抑制剂U0126作用15min,在上述抑制剂存在的条件下,再加入缩肺动脉环最佳浓度的15-KETE,观察抑制ERK1/2后,15-KETE对去内皮的大鼠肺动脉环收缩力的影响。
1.4统计方法
血管环数据以对静息张力的百分数表示,即收缩率以用药后收缩幅度/用药前收缩幅度×100%来表示;所有数据均以x珋±s表示;组内比较采用单因素方差分析,组间比较采用Dunnett-t检验分析,P<0.05为有显著差异。
2、结果
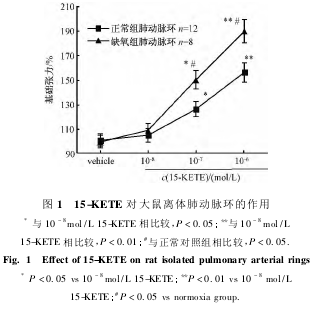
2.115-KETE对正常对照组和缺氧组大鼠肺动脉血管环张力的影响
在pH7.4含95%O2-5%CO2混合气的37℃Krebs液中,15-KETE以浓度(10-8mol/L—10-6mol/L)依赖方式收缩缺氧大鼠离体肺动脉环,其中10-6mol/L15-KETE、10-7mol/L15-KETE对缺氧组离体肺动脉环的收缩力影响显著高于正常组(P<0.05);10-6mol/L15-KETE对离体肺动脉环的收缩力影响极显著高于10-8mol/L15-KETE的收缩力(P<0.01);10-7mol/L15-KETE对离体肺动脉环的收缩力影响显著高于10-8mol/L15-KETE的收缩力(P<0.05)(见图1)。
2.2去除内皮对15-KETE诱导缺氧大鼠离体肺动脉环收缩力的影响
为了明确血管内皮细胞在15-KETE收缩缺氧大鼠肺动脉血管环中的作用,在pH7.4含95%O2-5%CO2混合气的37℃Krebs液中,加入终浓度为10-6mol/L15-KETE后,肺动脉环收缩率为(191.67±15.92)%;我们通过机械法除去血管内皮细胞,在Krebs液平衡1h后,再给予10-6mol/L15-KETE后,肺动脉环收缩率为(145.96±9.53)%,与去除内皮前给予10-6mol/L15-KETE的结果有显著性差异(P<0.05),说明内皮细胞在15-KETE收缩缺氧大鼠离体肺动脉环中起一定作用(见图2)。
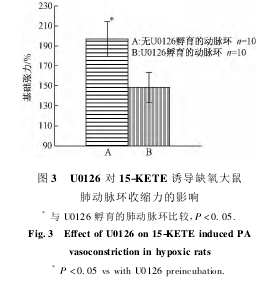
2.3抑制剂U0126对15-KETE诱导缺氧大鼠离体肺动脉环收缩力的影响
为了明确ERK1/2通路在15-KETE收缩缺氧大鼠肺动脉血管环中的作用,在pH7.4含95%O2-5%CO2混合气的37℃Krebs液中,加入终浓度10-6mol/L15-KETE,肺动脉环收缩率为(196.87±17.46)%;当肺动脉环用150nmol/LERK1/2抑制剂U0126孵育30min后,再给予10-6mol/L15-KETE,结果肺动脉环收缩率为(148.57±15.16)%,与孵育前给予10-6mol/L15-KETE的结果差异显著(P<0.05),说明ERK1/2通路参与15-KETE诱导的缺氧大鼠肺动脉环收缩(见图3)。
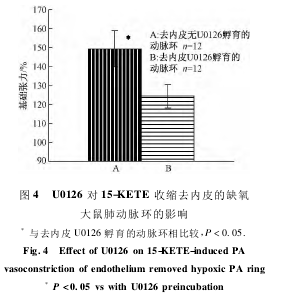
2.4检测除内皮动脉环并经U0126孵育。
对15-KETE诱导缺氧大鼠离体肺动脉环收缩力的影响通过机械法除去血管内皮细胞,在pH7.4含95%O2-5%CO2混合气的37℃Krebs液中,加入终浓度10-6mol/L15-KETE,结果其收缩为(149.43±9.63)%;当肺动脉环用150nmol/LERK1/2抑制剂U0126孵育30min后,再给予10-6mol/L15-KETE,肺动脉环收缩率为(124.34±6.21)%,与孵育前给予10-6mol/L15-KETE的结果差异显著(P<0.05),说明位于平滑肌的ERK1/2通路参与了15-KETE诱导缺氧大鼠肺动脉环的收缩(见图4)。
3、讨论
目前慢性缺氧性肺血管收缩机制尚不完全清楚。15-KETE是动脉的15-脂质氧化酶(15-LO)一种代谢终产物。由于缺氧可上调肺动脉平滑肌细胞15-LO的表达,因此,15-KETE在肺动脉平滑肌细胞上有其相应的细胞分布及相应的作用位点。我们先前研究表明,15-KETE以浓度依赖性方式强烈收缩离体肺动脉环,并且收缩作用依赖于Kv通道、细胞外液钙离子和L–型钙离子通道,15-KETE可能是缺氧情况下介导肺血管收缩的因子。由此推论慢性缺氧诱导15-KETE产量增加,进而可能调节与血管收缩有关的信号转导系统或收缩蛋白的表达或活性,使肺动脉环反应性增强。我们还发现15-KETE阻断电压依赖钾通道(Kv通道)引起膜去极化,增加细胞内钙离子浓度,但15-KETE引起缺氧性肺动脉环收缩的信号转导通路的研究尚未见报道。
有丝分裂素活化蛋白激酶(mitogenactivated protein kinase,MAPK)级联途径是哺乳动物细胞中重要的信号通路。MAPK途径大致分为4种:ERK1/2途径、JNK途径、p38途径和ERK5途径。
它们参与了多种神经递质、激素、生长因子、细胞因子及应激刺激对细胞生理活动的调节。
ERK1/2途径是脊椎动物中克隆的第1个MAPK途径,也是阐述最完全的经典途径。它的激活需要其Tyr和Ser/Thr基团同时被磷酸化。U0126是ERK1/2上游激酶的抑制剂,可抑制ERK1/2的活化,阻断ERK1/2信号转导通路。我们用U0126孵育内皮完整的缺氧性肺动脉血管环,发现15-KETE的缩血管作用明显受到抑制,说明15-KETE经ERK1/2通路收缩慢性缺氧性大鼠肺动脉环。去除内皮以后,U0126仍可抑制15-KETE的缩血管作用,说明此通路位于血管平滑肌内,由此提示15-KETE经血管平滑肌内ERK1/2通路收缩慢性缺氧性大鼠肺动脉。
本研究通过血管环和离子通道特异性抑制剂的应用,从功能上探讨了15-KETE收缩肺动脉血管的可能的离子通道机理,揭示ERK1/2通路和内皮细胞在15-KETE收缩缺氧大鼠肺动脉环中起一定作用,上述结论尚需从基因和蛋白质水平加以证实。
激活素A(ActivinA,ActA)是转化生长因子(transforminggrowthfactor-,TGF-)超家族成员之一,其作为ActA/Smads信号通路的第一信使,通过触发下游细胞内Smads级联反应,完成具有一定生物学功...
特发性肺纤维化(idiopathicpulmonaryfibrosis,IPF)病因未明、好发于成人、局限于肺部、进行性进展,以寻常型间质性肺炎为病理特征的一种间质性肺疾...
动脉粥样硬化(AS)是一种累及全身血管的慢性病变。AS不仅仅是脂质代谢紊乱,同时也是一种慢性炎症性疾病,多种免疫细胞及细胞因子参与了其发生与进展。单核细胞迁移到内皮下转化为具有吞噬作用的巨噬细胞,通过清道夫受体(scav-engerre...
肺动脉高压(pulmonary、artery、hypertension,PAH)是一类严重的进展性疾病,其主要特征是肺血管阻力进行性升高,持续发展可导致患者右心衰竭而死亡[1]。肺血管重构是肺血管阻力进行性升高的重要病理生理基础,肺动脉平滑肌细胞(pulmonaryarterialsmooth...
尽管各种治疗手段的改进,缺血性心脏病仍是目前全球致死性疾病的首要病因。缺血预处理(IPC)被公认为有效的心肌保护方式,但IPC必须在缺血前应用,因此临床应用受到限制。研究人员发现缺血后处理可以通过减小缺血心肌梗死面积,提高血管内皮细胞功能等途径发挥心...
内皮素-1(endothelin-1,ET-1)是心血管系统中ET的主要形式,可由内皮细胞、血管平滑肌细胞、心肌细胞、肝细胞和星形胶质细胞等合成。ET-1在心律失常、慢性心力衰竭、动脉粥样硬化等多种心血管疾病发病中都起着重要作用。氧自由基是机体内氧分子的不完全...
缺血后处理(ischemicpostconditioning,IPO)即通过在心肌的再灌注早期经过反复短暂的缺血与再灌注,能减少心律失常的发生,改善心功能,缩小梗死面积,减少心肌细胞凋亡[1]。Murry等[2]提出的预处理不同,IPO是在缺血后、再灌注之前进行反复短暂的缺血与再灌注。...
动脉粥样硬化(atherosclerosis,As)是一个慢性炎症性疾...
生长分化因子15(growthdifferentiationfactor-15,GDF-15)是转化生长因子-(transforminggrowthfac-tor-,TGF-)超家族中的一员。有研究认为,GDF-15与心血管疾病相关,GDF-15是反映心血管功能和疾病的独立生物化学标志物[1].目前中国关...
已有研究[1]显示,心肌梗死的发生与炎症反应相关.炎症反应是组织能够愈合的条件,但同时也能引起组织的进一步损伤,影响心室重塑,导致心肌梗死和心肌功能的下降[2].越来越多的证据表明,心肌组织损伤反应与先天免疫系统相关,包括多种受体家族.目前研究较多的是...