载脂蛋白 E( apolipoprotein E,Apo E) 是一种多态性蛋白,参与脂蛋白的转化与代谢过程,其基因可以调节多种生物学功能。Apo E 基因敲除后,小鼠的 B 淋巴细胞及 T 淋巴细胞发生改变,ApoE 在造血干祖细胞中表达丰富,Apo E 基因敲除小鼠喂饲高脂、高胆固醇饲料后,造血干祖细胞显着增多,这说明在高脂、高胆固醇可以诱导 Apo E基因敲除小鼠造血干祖细胞增殖。那么在没有高脂、高胆固醇诱因下,Apo E 基因对小鼠造血干祖细胞有没有影响呢?
造血干细胞是所有成熟血细胞维持的重要因素。在生理状态下,造血干细胞面临多种命运选择: 自我更新、分化、凋亡、静息或迁移,这些选择之间的平衡决定了造血干细胞的功能。不同命运的选择是由内在( 细胞周期、凋亡等相关基因) 和外在( 微环境) 的调控机制共同决定的。但是造血干细胞维持自我更新和选择分化的具体机制还不清楚。
那么 Apo E 对造血系统有怎样的作用,是否会影响骨髓造血干细胞( hematopoietic stem cell,HSC)的发育分化呢? 为了解 Apo E 基因敲除是否会影响HSC,我们应用 Apo E 基因敲除小鼠及同窝野生对照小鼠进行了相关分析。
1 材料和方法
1. 1 动物与设备
Apo E 基因敲除小鼠来自北京协和医学院比较医学中心,遗传背景为 C57B6/L,对照小鼠为同窝野生型小鼠,动物生产及使用许可证号: SCXK( 京)2009 - 0007; SYXK ( 京) 2011 - 0022。动物饲养在SPF 动物房,喂饲 SPF 级小鼠维持饮料。主要实验设备为美国 BD 公司 Aria 流式细胞仪。
1. 2 PCR 方法鉴定 Apo E 基因敲除小鼠基因型
用 10 日龄小鼠尾尖提取基因组 DNA,普通PCR 鉴定基因型。反应条件: 94℃ 预变性 3 min;94℃ 30 s,68℃ 30 s,72℃ 30 s,35 个循环; 72℃ 延伸10 min。 基 因 敲 除 小 鼠 的 PCR 鉴 定 引 物:OIMR0180: 5` GCC TAG CCG AGG GAG AGC CG 3`,OIMR 0181: 5` TGT GAC TTG GGA GCT CTG CAG C3`,OIMR 0182: 5` GCC GCC CCG ACT GCA TCT 3`,PCR 产物长度,野生型为 155 bp,Apo E 敲除为 245bp,杂合子同时有上述 2 条片段。引物由上海英骏生物工程技术有限公司合成,PCR 试剂购自宝生物工程有限公司。
1. 3 流式分析
小鼠 2 月龄时脱颈椎处死,取外周血、胸腺、脾脏、后肢骨,置于冰上预冷的染色缓冲液( 含 1%BSA 的 PBS) 中。胸腺、脾脏用磨砂玻片研磨成细胞悬液; 后肢骨用 5 mL 注射器将骨髓细胞冲出,并吹打成细胞悬液。将细胞悬液用 50 μm 尼龙滤膜过滤后收集到 15 mL 离心管中,用 PBS 定容至10 mL,混匀后,取 10 μL 细胞悬液,稀释 10 倍后计数细胞数。细胞悬液离心,1000 r/min,10 min,将细胞浓度调整为 1 ×108个细胞/mL。分别取 106细胞标记荧光抗体( BD 公司) 。
骨髓造血干细胞的分析中用如下抗体进行标记: CD34-FITC、Flt3-PE、CD16/32- Pcrcp-cy5. 5、Sca1- PE-Cy7、cKit- APC、Ter-119- Biotin、Gr-1-Biotin、Mac-1- Biotin、B220- Biotin、IL-7R- Biotin、CD4- Biotin、CD8- Biotin、Biotin - APC-Cy7。骨髓造血干细胞( HSC) 表面标记为: lin-c-kit+sca1+,长期造血干细胞 ( LT-HSC) 表面标记为: Lin- c-Kit+Sca1+CD34-Flt3-,短期造血干细胞( ST-HSC) 表面标记为: Lin-c-Kit+Sca1+CD34+Flt3-,髓系祖细胞( MP) 表面标记为: Lin-c-Kit+Sca1-,共同髓系祖细胞( CMP) 表 面 标 记 为: Lin- c-Kit+Sca1-CD34+CD16 /32low,粒单系祖细胞( GMP) 表面标记为: Lin-c-Kit+Sca1-CD34+CD16 /32high,巨核单系祖细胞( MEP) 表面标记为: Lin-c-Kit+Sca1-CD34-CD16 /32low,淋系共同祖细胞( CLP) 的表面标记为: Lin-c-kitlow Sca1lowCD34+IL - 7R+。IgD-FITC、CD43-PE、B220-PE-Cy7、IgM-APC,标记不同发育阶段的 B 淋巴细胞。脾脏及外周血细胞标记抗体: CD4-FITC、CD8- Pcrcp-cy5. 5、B220-PE-Cy7、CD11B- APC-Cy7。
上述抗体加入细胞悬液,冰上避光,30 min; 加 1 mL染色缓冲液,离心,2600 r/min,5 min,弃上清,加200 μL 染色缓冲液重悬细胞,用 50 μm 尼龙滤膜过滤,冰上避光备用。
1. 4 统计分析方法
数据分析采用 SPSS13. 0 软件包进行统计分析,各组数据均采用 x珋 ± s 表示。组间资料分析采用 t检验。以 P < 0. 05 表示差异有统计学意义。
2 结果
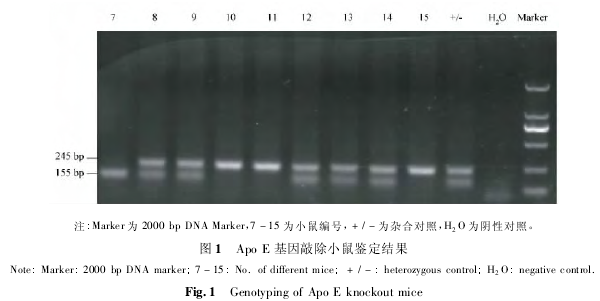
2. 1 PCR 鉴定结果
剪取 10 日龄小鼠脚趾,采用饱和氯化钠法提取小鼠基因组 DNA,进行 PCR,产物经2%琼脂糖凝胶电泳,野生型产物长度为 155 bp,Apo E 缺失产物长度 245 bp。基因型鉴定结果( 图 1) 。
2. 2 Apo E 基因敲除小鼠外周血 B 细胞、T 细胞减少
我们取 Apo E 基因敲除小鼠及同窝野生对照小鼠的外周血进行分析,发现 Apo E 基因敲除小鼠外周血中 B220+细胞( P < 0. 05) 及 T 淋巴细胞( P <0. 01) 显着减少,而 CD11b+细胞则没有显着变化( P> 0. 05) 。
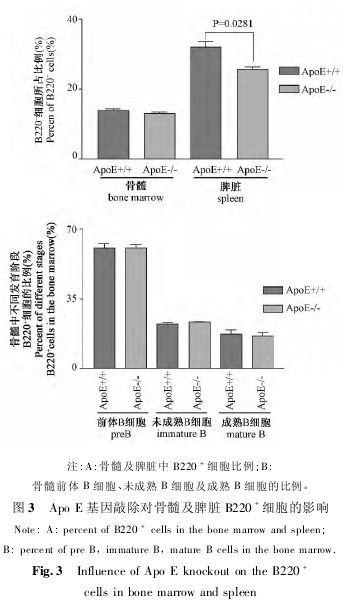
2. 3 Apo E 基因敲除对小鼠骨髓及脾脏中 B220+细胞的影响Apo E 基因敲除小鼠外周血中 B220+细胞减少,本研究对骨髓及脾脏的细胞进行了分析,同时对骨髓中前体 B 细胞的发育也进行了分析。结果发现,Apo E 基因敲除小鼠脾脏 B220+细胞减少( P< 0. 05) ,但是骨髓中 B220+细胞无显着改变( P >0. 05) 。同时,骨髓中前体 B 细胞的发育也没有显着变化( P >0. 05) 。
2. 4 Apo E 基因敲除小鼠 T 细胞变化
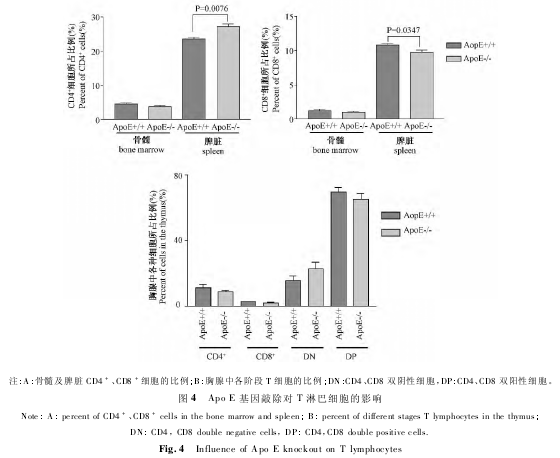
Apo E 基因敲除小鼠外周血 T 淋巴细胞减少,为了解骨髓及脾脏 T 淋巴细胞的变化,本研究分析了骨髓、脾脏中 CD4+、CD8+细胞。结果发现,脾脏中 CD4+细胞比例增多( P <0. 01) ,而 CD8+细胞比例降低( P <0. 05) ; 骨髓中则未发现显着变化( P >0. 05 图 4A) 。为进一步了解 Apo E 基因敲除对小鼠 T 淋巴细胞发育的影响,我们分析了胸腺 T 淋巴细胞,结果显示,各阶段 T 淋巴细胞的比例没有显着变化( P >0. 05) 图4B) 。这说明,Apo E 基因敲除对 T 淋巴细胞发育没有显着影响。
2. 5 Apo E 基因敲除对骨髓造血干细胞的影响
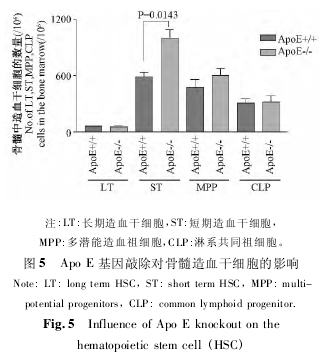
为了解 Apo E 基因敲除对小鼠骨髓造血干细胞的影响,本研究分析了 Apo E 基因敲除小鼠及同窝野生对照小鼠骨髓造血干细胞的数量,发现 Apo E基因敲除小鼠短期造血干细胞( ST-HSC) 数量显着增加( P < 0. 05) ,长期造血干细胞( LT-HSC) 、多潜能造血祖细胞( MPP) 及淋系共同祖细胞( CLP) 则没有显着变化( P >0. 05) 。造血干细胞的功能是否改变,则需进行骨髓移植实验来深入研究。
3 讨论
已有研究表明,Apo E 基因参与免疫调节作用,Apo E 基因敲除小鼠的体液免疫及细胞免疫均发生改变。Apo E 基因敲除小鼠在 3 月龄时已出现脂肪条纹,即动脉粥样硬化早期的损伤性表现。本研究中采用 2 月龄小鼠作为研究对象喂饲正常小鼠维持饲料,避免了 Apo E 基因敲除所致疾病对研究目标的影响。本研究发现,Apo E 基因敲除后小鼠造血系统 B220+、CD4+、CD8+淋巴细胞在外周组织中发生变化,骨髓短期造血干细胞显着增加( P <0. 05) ,但是骨髓长期造血干细胞及胸腺 T 细胞则没有显着变化( P >0. 05) 。这说明 Apo E 基因可能通过免疫调节作用影响 B220+、CD4+、CD8+淋巴细胞。Apo E 基因对骨髓造血干细胞的自我更新及分化功能是否有影响,尚需应用竞争性骨髓移植、体外克隆形成实验等进一步深入研究。
参考文献:
[1] Reue KL,Quon DH,O 'Donnell KA,et al. Cloning andregulation of messenger RNA for mouse apolipoprotein E. TheJournal of biological chemistry [J]. 1984, 259 ( 4 ) : 2100- 2107.
[2] Ali K,Middleton M,Pure E,et al. Apolipoprotein E suppressesthe type I inflammatory response in vivo. Circulation research[J]. 2005,97( 9) : 922 -927.
[3] Murphy AJ,Akhtari M,Tolani S,et al. . ApoE regulateshematopoietic stem cell proliferation,monocytosis,and monocyteaccumulation in atherosclerotic lesions in mice. The Journal ofclinical investigation[J]. 2011,121: 4138 - 4149.
[4] Kobayashi M,Srour EF. Regulation of murine hematopoieticstem cell quiescence by Dmtf1. Blood[J]. 2011,118: 6562- 6571.
[5] Pietras EM,Warr MR,Passegue E. Cell cycle regulation inhematopoietic stem cells. The Journal of cell biology[J]. 2011,195: 709 - 720.[6] Laskowitz DT,Lee DM,Schmechel D,et al. . Altered immuneresponses in apolipoprotein E-deficient mice. Journal of lipidresearch[J]. 2000,41: 613 - 620.