
C1qTNF 相关蛋白(C1qTNF-related protein,CTRP)隶属脂肪细胞因子家族,现已确定这个家族有15 个成员。其中的脂联素已经具有将近 20 年的研究历史,在肥胖、II 型糖尿病发生、胰岛素抑制,以及在由肥胖引起的慢性炎症发生过程中具有重要的作用,目前研究发现,在代谢与炎症的交叉领域中,CTRP 家族发挥了非常重要的作用。
CTRP4(C1q TNF-related protein 4)是 CTRP 脂肪细胞因子家族成员之一,由本室与国家基因组北方中心利用反向生物学的方法,通过 DLR(dualluciferase report assay)平台筛选出的对 NF-κB 通路具有明显活化作用的一个功能未知的新基因。我们于 2011 年首次在国际上进行了报道。前期的研究发现人 CTRP4 重组蛋白在肝癌细胞系 HepG2 中可以上调 IL-6、TNFα 的表达,促进 STAT3 的磷酸化。还可以提高 HepG2 对化疗药的抵抗,促进细胞的克隆形成。
我们体外研究已经证明 CTRP4 具有多种重要功能,进一步研究该分子在体内的生理功能及病理作用是十分必要的。为了更深入研究 CTRP4 体内的作用和机制,我们构建了人 CTRP4 转基因小鼠,并进行了鉴定,结果表明转基因鼠的构建是成功的。
1、 材料和方法
1. 1 实验动物
CTRP4 的转基因小鼠购自中国医学科学院医学实验动物研究所【SCXK(京)2009 -0004】。小鼠品系:C57BL/6J,使用级别为 SPF 级。用于交配的C57BL /6J 小鼠均购自维通利华公司【SCXK (京)2011 - 0012】,遗传背景为表面分子 CD45. 2 阳性。
动物饲养环境:SPF 级,北京大学医学部动物部【SYXK(京)2011 -0039】。
1. 2 实验试剂
限制性内切酶 XbaI、XhoI 等购自 TaKaRa 公司,KpnI 等购自 NEB 公司;RevertAid First Strand cDNASynthesis Kit 购自 Fermentas 公司;基因特异性引物由北京擎科生物公司合成;硝酸纤维素膜(NC 膜)购自 Amersham-Pharmacia biotech 公 司; IRDTMye800-偶联的抗鼠或抗兔的 IgG 二抗购自 LICORBioscience 公司;聚丙烯酰胺凝胶电泳 Marker 购自Fermentas;2TAQ PCR MASTERMIX 购自博迈德公司;RIPA 裂解液、PMSF 购自碧云天公司;鼠尾裂解液配方:1 mol/L Tris-HCl 5 mL;0. 5 mol/L EDTA2. 5 mL;NaCl 5. 844 g;10% SDS 25 mL。
1. 3 转基因载体构建
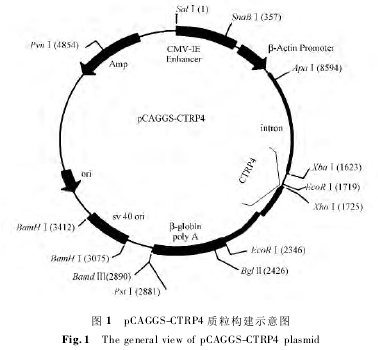
真核细胞表达质粒 pcDNA3. 1-CTRP4-Myc/His由本室构建,pCAGGS 质粒由美国 Vanderbilt 大学吴冠青教授馈赠。克隆方案中,上下游引物具体序列分别为:CTRP4-PCAGGS-F: 5 ’-CCGCTCGAGATGCTGCCGCTTCTGCT-3’;CTRP4-PCAGGS-R: 5’-CCGCTCGAGTCAATGATGATGATGATG-3’。
1. 4 转基因鼠的制备:
选用性成熟的野生型 C57BL/6J 雌性小鼠。腹腔依次注射孕马血清(50 U/mL,0. 1 mL)及人绒毛膜促性腺激素(50 U/mL,0. 1 mL),置于单笼饲养的正常雄性小鼠笼内,取有精栓雌性小鼠输卵管。受精卵置显微镜注射平台 M2 液滴内,选有原核的受精卵为注射对象,用显微镜操作仪将有目的基因的线性化片段注入小鼠受精卵雄性原核中,再移植到 6 周龄 ICR孕母鼠输卵管中,待其发育后产仔。此项工作由中国医学科学院医学实验动物研究所完成。
1. 5 鼠尾基因组 DNA 提取
剪取鼠尾0. 5 cm 左右,用500μL 含有 0. 1 mg/mL 蛋白酶 K 的鼠尾裂解液 55℃ 裂解过夜,之后加入 300 μL 饱和 NaCl 冰浴 15 min,12000 r/min 转速室温离心 15 min,收上清后加入700 μL 异丙醇颠倒混匀直至形成絮状沉淀,12000 r/min 室温离心 15min 后弃上清加入 70% 乙醇洗涤沉淀,弃乙醇,晾干。50 μL 水 65℃溶解沉淀得鼠尾基因组 DNA。
1. 6 PCR 鉴定 CTRP4 转基因小鼠
以 2. 5 中所述提取的鼠尾基因组 DNA 为模板,利用 pCAGGS 载体的启动子序列 chicken β-actin 的特异性引物进行 PCR 扩增。在 10 μL PCR 体系中加入:2 × PCR Mix 5 μL,ddH2O 4 μL,PCR 上下游引物各 0. 2 μL,模板 DNA 0. 6 μL。反应条件为:94℃变性 5 min,进入循环(94℃变性 30 s,退火 58℃,30s,延伸 72℃,30 s)。共 35 个循环,最后一个循环在72℃ 延 伸 10 min,4℃ 保 存。 上 游 引 物 为: 5 ’-CCCATAGTAACGCCAATAGG-3’; 下游引物为 5 ’-GGGAGAGTGAAGCAGAACG-3’。取 5 μL PCR 产物进行 1%琼脂糖凝胶电泳,凝胶图像分析系统分析结果。
1. 7 转基因小鼠各个组织蛋白的提取
分离小鼠各器官组织,每种组织取 100 mg,用500 μL 的 RIPA 裂解液匀浆 20 s 后冰上裂解 30min,随后 4℃离心,12000 r/min,20 min,吸取上清,BCA 定量法对裂解液进行蛋白定量。
1. 8 western blot 检测 CTRP4 转基因小鼠各个组织的表达
收集上一步的组织匀浆液上清,加入 SDS 加样缓冲液,99℃ 加热 10 min,经 12. 5% 聚丙烯酰胺凝胶电泳,电泳分离蛋白样品后,将蛋白转移至硝酸纤维素膜上,5%脱脂牛奶封闭 2 h 后,用 TBS-T 以1∶ 800 比例配置 CTRP4 一抗,将膜与抗体封入杂交袋中,4℃ 过夜,之后用 TBS-T 洗膜三次,每次 10min,再加入相应的 IRDyeTM 800/700 标记的二抗避光反应 1 h,TBS-T 重复洗膜三次,最后用 OdysseyImaging System 仪器扫描成像分析。
1. 9 CTRP4 转基因动物繁殖及纯合子筛选
1. 9. 1 转基因小鼠 F1 代的繁殖
我们将 CTRP4 转基因鼠首建鼠(Founder)(雄性 5 只,雌性 8 只)分别与育龄期的野生型 C57BL/6J 小鼠交配,交配大约两周之后观测小鼠腹部并用指揉法判断小鼠的胚胎情况,如果证实确已受孕,即把雌鼠分笼。小鼠一代生育的子鼠在 6 ~12 只左右,在 F1 代小鼠出生 12 d 左右对小鼠编号并鉴定小鼠的基因型,得到 CTRP4 杂合子转基因小鼠,在4周时将新生小鼠离乳。
1. 9. 2 F2 代转基因小鼠的繁育
用 F1 代鉴定阳性的 CTRP4 杂合子小鼠进行近亲交配,即同窝阳性小鼠的雌雄交配,根据最适的雌雄比例(雄:雌 = 1:2)进行,编号及鉴定方法同F1 代。
1. 9. 3 F2 转基因纯合子小鼠的筛选
根据孟德尔遗传定律,F2 代小鼠中有一定概率出现纯合子,因此通过测交的方法来筛选 F2 代中的纯合子小鼠,即把得到的每一只 CTRP4 阳性 F2代小鼠与野生型的 C57BL/6J 小鼠进行交配,通过子代小鼠判断 F2 代小鼠是否为纯合子,如果子代小鼠经过 PCR 鉴定 100%为 CTRP4 阳性,则表明亲代小鼠为纯合子小鼠,否则为杂合子小鼠。PCR 鉴定方法同 1. 6 中所述。
阴性鼠的来源:F1 代小鼠中的阴性小鼠进行交配,并大量繁殖,进而得到用于实验对照的阴性小鼠。
2、 结果
2. 1 转基因载体构建
以1. 3 中所述真核表达质粒 pcDNA3. 1-CTRP4-Myc / His 为模板,以 pCAGGS 质粒为载体进行转基因载体构建,pCAGGS-CTRP4 质粒的构建方案基本过程如下:设计包含 Xho1 酶切序列的 CTRP4 基因特异性引物(即如 1. 3 中所述引物),以 pcDNA3. 1-CTRP4-Myc / HisB(-) 质粒为模板,PCR 扩增得到的片段连同真核表达载体 pCAGGS 采用同样的限制性内切酶进行酶切。酶切产物通过琼脂糖凝胶电泳进行分离,切胶回收目的条带。回收的载体和PCR 片段用 T4 DNA 连接酶连接,16℃ ,12 h。连接产物转化入大肠杆菌 XL1-BLUE 中,使用 LA(Amp抗性)固体培养基培养 14 ~ 16 h,挑取克隆扩增培养,提质粒进行鉴定。鉴定是否有插入片段、插入片段的大小、片段插入的方向。对符合目的要求的阳性克隆进行质粒测序,测序结果与 NCBI 标准数据库中的 CTRP4 CDS 序列进行比对,准确无误后进行质粒大量提取,最终所得质粒结构如图 1 所示。
质粒线性化,定量除菌后提供给中国医学科学院医学实验动物研究所制作转基因小鼠。
2. 2 转基因小鼠的繁殖与鉴定
通过首建鼠和野生型 C57BL/6J 小鼠交配,得到 F1 代小鼠 135 只,经观察雌雄比例并没有异常,通过 1. 5 和 1. 6 中所述鉴定方法对 F1 代小鼠进行鉴定,经 1%琼脂糖凝胶电泳,最终鉴定有 30 只阳性小鼠。以首建鼠 66 号为例。如图 1A 所示,66 号小鼠所生子代(F1 代)12 只小鼠的 PCR 鉴定结果显示,1 号和 6 号为阳性鼠。
随后我们选择 F1 代小鼠同窝并且至少有1 只雄性,1 只雌性的小鼠进行同窝交配,最终我们筛选出 4窝小鼠进行繁殖,以其中一窝 F1 代小鼠为例,如图1B 所示,其生产的 7 只小鼠中 1 号和 6 号为阳性。
经过上述繁殖我们总共获得28 只阳性 F2 代小鼠。通过 1. 9. 3 中所述测交方法鉴定,得到两个品系纯合子转基因小鼠共 8 只。以其中一系纯合子小鼠鉴定结果为例,图 1C 中所示结果,F2 代 4 号小鼠与野生型小鼠交配生成的7 只 F3 代小鼠均为阳性,证实该转基因小鼠为纯合子。
2. 3 CTRP4 转基因小鼠体内表达的鉴定
为了验证外源 CTRP4 在小鼠体内的表达水平,我们取 CTRP4 纯合子小鼠的心脏,肝,脑,肾等组织进行匀浆处理后 western blot 检测 CTRP4 表达水平,同时取同窝阴性小鼠相应组织作对照,CTRP4 纯合子小鼠表达水平在各组织中明显高于同窝阴性小鼠。
2. 4 CTRP4 转基因小鼠血生化分析结果
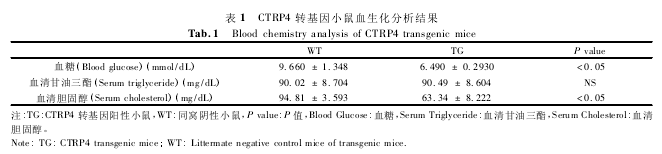
CTRP4 作为潜在的脂肪因子,很可能对机体的血糖血脂等具有调控作用。为了验证这种猜测,我们对 CTRP4 转基因小鼠进行了血生化检测,包括血糖,胆固醇和甘油三酯三项,结果显示转基因小鼠体内血清胆固醇和血糖水平相对较低,如表 1 所示。
2. 5 CTRP4 转基因小鼠体重曲线,脂肪比例与脂肪形态
CTRP 家族成员中有半数以上是脂肪因子,根据目前研究表明,脂肪因子有可能对机体体重、脂肪组织占体重比例以及脂肪细胞大小发挥一定的影响。为了检测 CTRP4 是否具有类似的作用,我们检测了 CTRP4 转基因小鼠自出生后 16 周的体重变化,同时测量了其脂肪比例,观察了脂肪 HE 染色结果。在正常饮食条件下,上述指标均没有明显变化。
3、 讨论
脂肪细胞因子是一类在肥胖和由肥胖诱导的慢性炎症过程中发挥重要作用的细胞因子,通过对代谢调控通路、炎症信号通路、中枢神经系统等进行调节,在多种生理及病理过程中发挥重要作用。近 20 年来,脂肪因子越来越受到人们的关注,通过对脂肪因子的研究,人们逐渐对代谢的调节、肥胖、II 型糖尿病、炎症的关系有了更深一步的认识。
CTRP 家族是目前脂肪因子研究领域中被广泛关注的一类分子,包括脂联素在内已有 16 个成员被发现,其中大部分成员均已有功能研究报道,脂联素在肥胖,胰岛素抵抗和由肥胖介导的慢性炎症过程中的重要作用已经被确认。该家族主要特征是具有 N 端胶原样结构域和 C 端 C1q 球状结构域。CTRP4 是该家族中较为特殊的一个成员,它并不具有 N 端胶原样结构域,同时,它是唯一一个具有两个 C1q 结构域的成员。这一结构上的特殊性也提示我们,CTRP4 在该家族中或许有较为特殊的地位。
NF-κB 在细胞炎症信号的诱发和调节中具有核心作用。在固有免疫系统识别病原模式分子后NF-κB 在巨噬细胞中的活化可以启动下游一系列的炎症级联反应。NF-κB 可以对炎症过程进行调控,研究已经证明肥胖与炎症的关系非常密切。我们前期的研究表明 CTRP4 在 NF-κB 信号通路中可能具有重要的调节作用,因此对 CTRP4 进行深入研究对于阐释炎症、肥胖以及 NF-κB 信号通路都具有非常重要的意义。
本文共获得了两系 CTRP4 转基因纯合子小鼠,通过在 mRNA 和蛋白水平的鉴定,证明其在全身多种组织中均呈现高表达,表明转基因鼠的构建是成功的。这为我们对 CTRP4 的体内功能和机制研究提供了有力的工具。
随着疾病谱的变化,慢性病已引起人们的关注。慢性疾病,其特点是进展缓慢,病程长,死亡率高,占全世界死亡原因的60%以上。心脑血管病、糖尿病是常见的慢性病,严重影响人们的身体健康。...
非酒精性脂肪肝(non-alcoholicfattyliverdisease,NAFLD)包括了肝脏损伤的一个广泛的疾病谱。从单纯性脂肪变性到非酒精性脂肪性肝炎(non-alcoholicsteatohepatitis,NASH),随后可进展为肝硬化和终末期肝...
0引言非酒精性脂肪性肝病(non-alcoholicfattyliverdisease,NAFLD),是一种以肝脏脂肪浸润、肝细胞炎症坏死为特征的慢性疾病,可以由单纯性脂肪肝进展至非酒精性脂肪性肝炎(non-alcoholicsteatohepatitis,NASH)、肝硬化,甚至肝细胞肝癌.NAFLD在...