脑内神经炎症与慢性神经退行性疾病如阿尔茨海默病( Alzheimer’s disease,AD) 、帕金森病( Parkinson’sdisease,PD) 和多发性硬化( multiple sclerosis,MS) 等的发生和发展密切相关。而炎症反应介导的神经元退行性病变主要是胶质细胞的激活及神经毒性因子的释放。在致炎因素作用下,星形胶质细胞被激活成反应性星形胶质细胞,可释放多种细胞因子和趋化因子,包括肿瘤坏 死 因 子 α ( tumor necrosisfactor-α,TNF-α ) 、白细胞介素 1β ( interleukin-1β,IL-1β) 、IL-6 以及单核细胞趋化蛋白 1 ( monocytechemoattractive protein 1,MCP-1) 和巨噬细胞炎性蛋白 1α( macrophage inflammatory protein-1α,MIP-1α) ,促使神经元凋亡和坏死。炎性细胞因子和趋化因子还可以诱导外周淋巴细胞和单核细胞通过血脑屏障( blood brain barrier,BBB) 进入脑内,诱发二次炎性反应,加重神经元损伤。但研究也发现,星形胶质细胞除上述致炎作用外,还具有抗炎的功能,包括形成胶质瘢痕防止神经元继发变性以及释放神经营养因子等。因此,研究星形胶质细胞在神经系统炎症中的双重作用机制,对理解 MS、AD 和 PD 等的发病机制和对其治疗具有重要意义。硫辛酸( lipoic acid,LA) 化学名称为 1,2-二硫戊环-3-戊酸,分子式为C8H14O2S2,广泛分布于动植物以及微生物的肝脏、肾脏等组织中。LA 以两种不同的异构体存在,即R-LA( 右旋) 和S-LA( 左旋) ,药用 LA 通常为左旋和右旋的混旋体。
LA 是目前已知唯一的同时在脂溶性和水溶性环境中都能发挥抗氧化性能的物质,被医学界誉为“万能抗氧化剂”。研究发现,LA 可以下调脂多糖( lipopolysaccharide,LPS) 诱导的单核细胞的激活及急性炎性反应。LA 通过增加 cAMP 和激活蛋白激酶A( protein kinase A,PKA) 减轻 MS 的炎性反应,LA 可通过增加星形胶质细胞谷氨酸的摄取、谷氨酸合成酶的活性和谷胱甘肽的含量起保护作用,CC亚族趋化因子20( CC chemokine ligand-20,CCL20) 对表达 CCL20 受体 CCR6 的细胞具有趋化作用,如Th17 细胞、调节性 T 细胞等,而上述细胞在 MS 的动物模型实验性自身免疫性脑脊 髓炎( experimentalautoimmune encephalomyelitis,EAE) 中发挥重要作用。
EAE 发病期间,星形胶质细胞是 CCL20 的主要来源,本研究主要观察 LA 对 LPS 激活的星形胶质细胞分泌 TNF-α、IL-1β、IL-6 和 IL-10 及相关趋化因子的影响。
1 材料和方法
1. 1 材料 C57BL /6J 小鼠( 体质量 16 ~ 18 g) ,由中国医学科学院实验动物中心提供。LA、LPS( 来自 E. coli 0111: B4)购自 Sigma 公司; TNF-α、IL-1β、IL-6 和 IL-10 ELISA 测定试剂盒购自 PeproTech 公司; M-MLV 逆转录酶购自 Promega 公司; GADPH 引物、CCL20、MCP-1 和 MIP-α 引物由生工生物合成; TRIzol 试剂、DMEM、胎牛血清、高糖培养基购自Gibco-BRL公司。
1. 2 方法
1. 2. 1 小鼠原代星形胶质细胞的培养 新生 C57 / BL6J 小鼠( 出生 48 h 以内) ,无菌条件下取中脑及大脑皮质; PBS 洗涤去除血污,仔细剥除残余脑膜及血管; 然后将其剪碎成小于1 mm × 1 mm × 1 mm的小块。1. 25 g / L 的胰酶消化 15 min,并用吸管柔和吹打制成单细胞悬液,加入适量胎牛血清终止消化。200 目筛网过滤,收集细胞悬液,1 200 r/min 离心5 min吸弃上层; 然后加入 DMEM 培养基( 含 200 mL / L 胎牛血清) ,制成单细胞悬液,调整细胞密度为 1. 5 ×106/ mL,种入预先用多聚-D-赖氨酸包被的培养瓶中,置于 37℃ 50 mL/LCO2培养箱中培养,24 h 后去除未贴壁的死亡细胞及残余组织碎片。每 3 d 换液 1 次,9 d 后细胞铺满瓶底,然后置于恒温摇床,37℃、180 r/min 离心 18 h,去除小胶质细胞及少突胶质细胞。2. 5 g/L 的胰酶消化后,进行常规传代培养,用于后续实验。
1. 2. 2 星形胶质细胞的鉴定 采用免疫荧光法检测星形胶质细胞纯度。将传至第 2 代的星形胶质细胞接种于盖玻片上,2 ~3 d 后,将铺满细胞的盖玻片取出,40 g/L 的多聚甲醛固定 30 min,PBS 漂洗 5 min ×3 次,10 g/L 的 BSA 室温封闭 1 h,加入兔抗小鼠胶质细胞纤维酸性蛋白( glial fibrillaryacidic protein,GFAP) 抗体( 1∶800) ,4℃ 孵育过夜。次日,PBS漂洗5 min ×3 次,加入 FITC 标记的抗兔 IgG ( 1∶1 000) ,室温孵育1 h,PBS 漂洗5 min ×3 次,500 mL/L 甘油封片,荧光显微镜下随机观察 10 ~12 个视野,采用图像分析软件Image-ProPlus 分析并计算荧光阳性细胞的百分比。
1. 2. 3 实验分组及给药方法 大脑皮质星形胶质细胞纯化后,接种于6 孔细胞培养板中,调整细胞密度为1.5 ×106/ mL,培养 24 h后换基本培养液 ( 含 200 mL/L 胎 牛 血 清 的DMEM) ,分 3 组: 对照组,加 PBS; LPS 刺激组,加入 1 μg /mL LPS; LA 干预组,加 1 μg / mL LPS 后,加 100 μg / mL LA;共同作用 24 h 后收集培养上清。
1. 2. 4 Griess 法测定星形胶质细胞培养上清液中 NO 含量以 NO 的稳定性代谢产物-亚硝酸盐作为检测 NO 的指标,采用 Griess 法测定培养液中 NO 的含量。简述如下: 收集各组细胞培养上清液,分别取 100 μL 上清液至 96 孔酶标板,然后分别加入 50 μL Griess 试剂Ⅰ和50 μL Griess 试剂Ⅱ,充分混匀后室温静置 10 min,于 540 nm 处检测各组吸光度值,以不同浓度亚硝酸钠( NaNO2) 建立标准曲线确定 NO 浓度,结果用 μmol/L 表示。
1. 2. 5 星形胶质细胞培养上清液 TNF-α、IL-1β、IL-6 和IL-10的检测 星形胶质细胞进行传代、分组,药物处理 24 h后,收集培养上清液,按 TNF-α、IL-1β、IL-6 和 IL-10 ELISA检测试剂盒说明书进行操作,测定样品在 450 nm 的吸光度( A) 值,根据不同浓度标准品的结果,绘制出标准曲线,得出直线回归方程。将所测各组样本的 A 值,代入相应的直线回归方程中,计算出的 TNF-α、IL-1β、IL-6 和 IL-10 含量,以pg / mL 表示。
1. 2. 6 反转录 PCR 法检测 CCL20、MIP-1α 和 MCP-1 mRNA表达 各组细胞药物处理 24 h 后,用 PBS 洗涤细胞,按照TRIzol 试剂盒说明书提取细 胞 总 RNA; RT-PCR 法 扩 增CCL20、MIP-1α 和 MCP-1 mRNA: 按逆转录酶 MMLV 试剂盒说明书方法进行逆转录,取逆转录产物进行 PCR。GADPH 上游引物序列为 5'-CAGTGGCAAAGTGGAGATTGTTG-3',下游引物序列为 5'-CTCGCTCCTGGAAGATGGTGAT-3'; MCP-1 上游引物序列为 5'-CTTCTGGGCCTGCTGTTCA-3',下游引物序列5'-CCAGCCTACTCATTGGGATCA-3'; MIP-1α 上游引物序列为 5'-TGCCCTTGCTGTTCTTCTCT-3', 下 游 引 物 序 列 为5'-CAGGCATTCAGTTCCAGGTC-3'; CCL20 上游引物序列为:5'-GACTGTTGCCTCTCGT-3',下游引物序列为: 5'-TGACTCT-TAGGCTGAGGA-3'; PCR 反应条件: 95℃ 10 min,94℃ 45 s,60℃ 1 min,72℃ 1 min,共 30 个循环,72℃ 5 min。
1. 2. 7 统计学分析 实验结果均以 x ± s 表示,采用 SPSS15. 0统计学软件,组间比较用单因素方差( analysis of variance,ANOVA) 进行统计学分析,P < 0. 05 为差异有统计学意义。
2 结果
2. 1 大脑皮层星形胶质细胞培养及纯度鉴定结果将传至第 2 代的星形胶质细胞按照 1 ×106/ 孔的密度接种至多聚赖氨酸包被的盖玻片上,37℃、50 mL/LCO2培养箱中培养 2 ~ 3 d 后,取出盖玻片,经过GFAP 免疫组化染色鉴定,盖玻片上的星形胶质细胞纯度达 95%以上( 图 1) 。
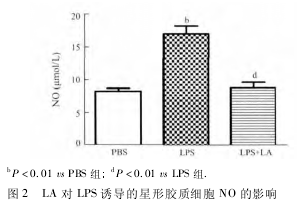
2. 2 LA 对 LPS 刺激细胞释放 NO 的作用 经 LA预处理、加入 LPS 刺激细胞 24 h 以后,用 Griess 法检测 NO 水平。结果显示,与 PBS 组比较,LPS 引起星形胶质细胞分泌 NO 明显增加( 图 2,P <0. 01) 。与 LPS 组相比,LA 组 NO 分泌明显降低( P <0. 01) 。LA 可显着抑制 LPS 诱导的原代培养小鼠星形胶质细胞释放 NO。
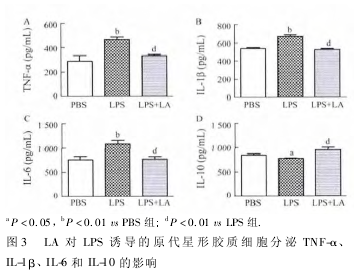
2. 3 LA 对 LPS 激活的星形胶质细胞分泌 TNF-α、IL-1β、IL-6 和 IL-10 的影响 应用 ELISA 检测细胞培养上清液中 TNF-α、IL-1β、IL-6 和 IL-10 的含量,结果表明,LPS 诱导后星形胶质细胞分泌 TNF-α、IL-1β、IL-6 明显增加( P < 0. 01) ,IL-10 分泌减少 ( 图3,P < 0. 05) ,与 PBS 组相比,差异有统计学意义;与 LPS 组相比,LA 干预组 TNF-α、IL-1β、IL-6 的分泌显着下降,IL-10 分泌增加( P < 0. 01) ,差异有统计学意义。
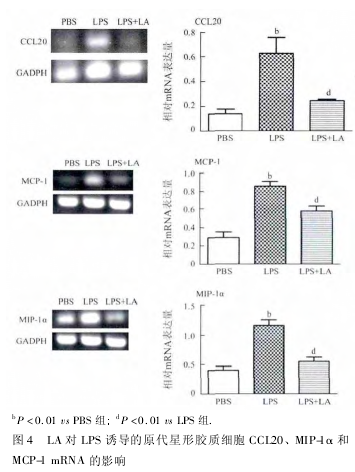
2. 4 LA 对 LPS 诱导星形胶质细胞 CCL20、MIP-1α 和 MCP-1 mRNA 的影响 采用反转录 PCR 法观察 LA 对 LPS 刺激的星形胶质细胞 CCL20、MIP-1α和 MCP-1 mRNA 分泌水平的影响,实验结果表明,LPS( 1 μg / mL ) 刺激 24 h 后,星形胶质细胞的CCL20、MIP-1α 和 MCP-1 的 mRNA 分泌水平升高,与 PBS 组相比,差异有统计学意义( P <0. 01,图4) 。LA ( 100 μg / mL) 可抑制 LPS 诱导的 CCL20 mRNA、MIP-1α mRNA ( P < 0. 01 ) 和 MCP-1 mRNA 的分泌( P <0. 05) ,与 LPS 组相比,差异有统计学意义。
3 讨论
近年来的研究发现,星形胶质细胞不仅作为神经元的支持细胞,同时在中枢神经系统退行性疾病、炎性疾病和缺血性疾病如 AD、PD、MS 和脑梗死中发挥神经毒性和神经保护双重作用。本研究发现在 LPS 刺激下,星形胶质细胞释放NO、TNF-α、IL-1β 和 IL-6 明显增加。过量的 NO 可导致神经元去极化及谷氨酸盐释放增加,继而产生神经兴奋毒性。本研究结果显示,LA 可显着抑制LPS 刺激星形胶质细胞引起的 NO 产生,继而发挥神经保护作用。TNF-α、IL-1β 除直接或间接地引起神经元损伤或死亡外,还是触发免疫和炎症反应的重要介质,TNF-α 可进一步刺激星形胶质细胞产生更多的细胞因子和化学因子,加快并扩大炎症反应的发生,从而导致神经细胞的损伤。IL-1β 可以激活炎症信号通路 NF-κB,我们前期的研究发现,在 EAE小鼠脊髓组织中星形胶质细胞存在较高的NF-κB的表达,而且随着炎症信号的抑制,由此启动的炎性细胞因子如 TNF-α、IL-1β 和 IL-6 明显下降。本研究结果也显示,LA 可明显下调炎性刺激下星形胶质细胞所产生的 TNF-α、IL-1β 和 IL-6,减少细胞因子及化学因子的进一步释放,终止恶性循环。与上述致炎性细胞因子相反,IL-10 为经典的免疫调节和抗炎性细胞因子,能有效地抑制 LPS 诱导的胶质细胞分泌致炎性细胞因子。Gresa-Arribas 等的研究结果也证明,IL-10 能抑制 LPS/IFN-γ 诱导的胶质细胞 IL-6 和 TNF-α 的释放。本研究发现,在 LPS 刺激下,星形胶质细胞 IL-10 分泌减少。而 LA 可增加抗炎性因子 IL-10 的分泌,这可能是 LA 发挥抗炎作用及星形胶质细胞具有神经保护的机制之一。
病理条件下的星形胶质细胞除了释放细胞因子外,还释放 MCP-1( CCL2) 、MIP-1α( CCL3) 、CCL20等趋化因子。这些趋化因子一方面可吸引和活化单核细胞、中性粒细胞及其他免疫细胞穿过 BBB,进一步加重炎性反应; 另一方面可直接激活神经元表面的趋化因子受体,或间接激活小胶质细胞杀伤机制诱导神经元的死亡。本实验结果显示,在 LPS 刺激下,星形胶质细胞 CCL20 mRNA、MIP-1α mRNA和 MCP-1 mRNA 显着升高。IL-1β 可刺激 CD4+T 细胞产生 IL-9,而 IL-9 诱导的星形胶质细胞 CCL20 二次高表达使更多的 Th17 细胞迁移进入 EAE 炎性病灶。CCL2、CCL3 可促使不同的 CD4+T 细胞亚群与 BBB 内皮细胞结合,并穿过 BBB,并在 MS 炎性浸润的不同阶段发挥重要作用。此外,AD 患者脑脊液中 MCP-1 显着升高,而且 MCP-1 的显着升高能加速 AD 患者认知能力的下降。可见趋化因子在多种神经系统退行性疾病的发病机制中具有重要作用。本实验结果显示,LA 可明显抑制 LPS 诱导的趋化因子 CCL20、MIP-1α、MCP-1 mRNA 的表达,这可能是 LA 在神经系统退行性疾病中发挥抗炎及神经保护作用的另外一个机制。值得注意的是,除 LPS直接诱导趋化因子的释放外,TNF-α、IL-1β 和 IL-6也能间接诱导星形胶质细胞 MCP-1( CCL2) 、MIP-1α( CCL3)和 CCL20 mRNA的表达,从而形成细胞因子与趋化因子间复杂的级联网络,使炎症反应不断放大,加重神经元的损伤。
综合以上实验结果,LA 能显着抑制 LPS 诱导的星形胶质细胞 NO、致炎性细胞因子及趋化因子的释放,证明 LA 通过抗炎抗氧化在神经系统退行性疾病中发挥一定的保护作用,但其具体的分子机制还需要进一步探讨。
参考文献:
[1] van Neerven S,Regen T,Wolf D,et al. Inflammatory chemokinerelease of astrocytes in vitro is reduced by all-trans retinoic acid[J].J Neurochem,2010,114 ( 5) : 1511 - 1526.
[2]Bélanger M,Magistretti PJ. The role of astroglia in neuroprotection[J]. Dialogues Clin Neurosci,2009,11( 3) : 281 -295.
[3]Salinthone S,Yadav V,Schillace RV,et al. Lipoic acid attenuatesinflammation via cAMP and protein kinase A signaling[J / OA].PLoS One,2010,5( 9) : e13058.
[4]Kleinkauf-Rocha J,Bobermin LD,Machado Pde M,et al. Lipoicacid increases glutamate uptake,glutamine synthetase activity andglutathione content in C6 astrocyte cell line[J]. Int J Dev Neurosci,2013,31( 3) : 165 - 170.
[5]辛 岗,苏 芸,张 娟,等. 星形胶质细胞纯化方法改良及脂多糖刺激后一氧化氮系统的表达[J]. 广东医学,2011,32( 4) :429 - 431.
[6]陈新华,谢 明. 星形胶质细胞与神经退行性疾病[J]. 社区医学杂志,2012,10( 7) : 17 -19.
[7]彭珊瑛,廖文辉,聂珍贵,等. 银杏内酯 B 对星形胶质细胞 NO、IL-6 及趋化因子 RANTES 的影响[J]. 药学学报,2010,45( 9) :1103 - 1108.
[8]Renner NA,Sansing HA,Inglis FM,et al. Transient acidificationand subsequent proinflammatory cytokine stimulation of astrocytesinduce distinct activation phenotypes[J]. J Cell Physiol,2013,228( 6) : 1284 -1294.
[9]李艳花,刘春云,章培军,等. Fasudil 对实验性自身免疫性脑脊髓炎小鼠小胶质细胞和星形胶质细胞的作用[J]. 细胞与分子免疫学杂志,2012,28( 12) : 1242 -1245.
[10]Gresa-Arribas N,Viéitez C,Dentesano G,et al. Modelling neuroinflammationin vitro: a tool to test the potential neuroprotective effect ofanti-inflammatory agents [J / OA]. PLoS One, 2012, 7 ( 9 ) :e45227.
[11]Ramesh G,Maclean AG,Philipp MT. Cytokines and chemokines atthe crossroads of neuroinflammation,neurodegeneration,and neuropathicpain[J / OA]. Mediators Inflamm,2013,2013: 480739.
[12]Zhou Y,Sonobe Y,Akahori T,et al. IL-9 promotes Th17 cell migrationinto the central nervous system via CC chemokine ligand-20 producedby astrocytes[J]. J Immunol,2011,186( 7) : 4415 - 4421.
[13]Liu KK,Dorovini-Zis K. Differential regulation of CD4+T cell adhesionto cerebral microvascular endothelium by the β-chemokines CCL2and CCL3[J]. Int J Mol Sci,2012,13( 12) : 16119 - 16140.
[14]Westin K,Buchhave P,Nielsen H,et al. CCL2 is associated with afaster rate of cognitive decline during early stages of Alzheimer ’sdisease[J / OA]. PLoS One,2012,7( 1) : e30525.
[15]Chui R,Dorovini-Zis K. Regulation of CCL2 and CCL3 expression inhuman brain endothelial cells by cytokines and lipopolysaccharide[J]. J Neuroinflammation,2010,7: 1.
[16]Meares GP,Ma X,Qin H,et al. Regulation of CCL20 expression inastrocytes by IL-6 and IL-17[J]. Glia,2012,60( 5) :771 - 781.