巨噬细胞迁移抑制因子( macrophage migrationinhibitory factor,MIF) 是第一个被发现的具有多效炎性介质功能的细胞因子,同时也是重要的内分泌激素,具有变位酶和氧化还原酶两大酶活性。MIF预先合成储存于胞质中,可由免疫细胞如单核/巨噬细胞、B 细胞、T 细胞,以及非免疫细胞如内皮细胞、上皮细胞、内分泌细胞、血管平滑肌细胞等合成; 甚至在下丘脑-垂体-肾上腺皮质轴中都有储存,以便在信号刺激时快速释放。MIF 的产生释放受多种因素调节,包括细菌代谢产物、增殖信号、低氧、其他炎性因子( 如 IFN-γ、TNF-α、糖皮质激素等)。MIF无论是在胞内或者胞外都具有相应的功能,在正常情况下 MIF 的血清浓度为 2 ~10ng/ml,且有昼夜波动现象。
MIF 具有独特的分子结构,与其他促炎因子有很大不同,仅在拓扑结构上与 D-多巴胺变位酶同源。Lue 等( 2002) 发现 MIF 的功能性分子为同源三聚体,其单体为 12. 5kD,具有 2 个 α 螺旋和 6 个 β折叠。在 MIF 单体中,氨基酸片段 50 ~ 68 与 86 ~102 最为重要,二者都属于 β 折叠区,其中第 57 ~ 60位氨基酸为氧化还原活性中心位点。当上述两个MIF 片段突变或被特异性受体阻断时,相应的 MIF酶活性降低,其诱导炎性因子释放的能力下降。
一、MIF 介导的信号通路
MIF 作为多功能的趋化因子,其可在胞内和胞外发挥相应的功能。因此,MIF 既可作为信号分子作用于其他细胞,又可通过自分泌和旁分泌的形式进行自体调节和微环境调节。MIF 通过与 CXC家族、CD74 等受体结合,通过与 AKT、AMPK、ERK等受体通路介导,发挥相应的作用。
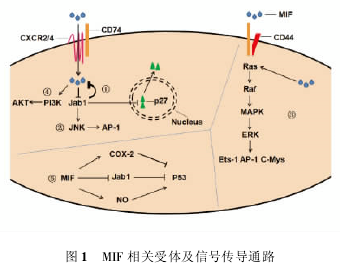
( 一) MIF 的相关受体 与 MIF 相关的受体分
子有 CXC 趋化因子受体家族的 CXCR2、CXCR4 和CXCR7,以及 CD74 和 CD44。这些受体并不是孤立的,而是以受体复合物的形式( 图 1) 结合 MIF,传递信号。受体复合物包括 CXCR2/CD74 复合物和CXCR4 / CD74 复合物。CD74 是在 MHCII 型抗原传递蛋白中起固定抗原肽作用的跨膜糖蛋白,无胞内活性部分,需与 CD44 构成复合物才能完成信号的转导; CD44 无磷酸酶活性,MIF 与 CD74/CD44 复合物结合后,使得其丝氨酸磷酸化,激活 Src 酪氨酸激酶通路,介导信号传递。
不同的细胞系表达受体类型不同。单核细胞表面主要表达 CXCR2; T 细胞表面主要表达 CXCR4;白细胞表面主要表达 CXCR2 和 CXCR4。以上的这些受体均是 G 蛋白偶联受体。胞外的 MIF 只有在 CXCR2 存在的情况下,才能完成对白细胞的招募。MIF 具有伪 LR 结构,因此可模拟 ELR 结构来代替相应 CXCLs 的功能,与 CXCR2 受体结合。研究证实,CXCR2 可介导 MIF 的炎性趋化作用,以及动脉粥样硬化等疾病发生。CXCR4 与 AKT 信号通路相关。
MIF 通过受体介导的信号传导不仅与质膜型受体( plasma membrane receptor) 有关,而且最新研究表明与内吞型受体( endocytosis of the ligated recep-tor) 也有很大关系。在三种主要的内吞型受体中,与 MIF 相关的属于网格蛋白依赖型受体,与LDL 胞吞机制有相似之处。MIF 与细胞表面 CX-CR4 / CD74 受体结合后,通过胞吞作用进入细胞,形成信号传导型胞内体,可参与信号传导。这一途径在单核细胞、T 细胞等细胞系均有发现。这一胞内体途径与 PI3/AKT 信号通路有很大关系。当然,关于 AKT 通路的受体信号传导途径与具体细胞系有关。同时,ROS 相关基因也与 MIF 内吞相关,Th1相关细胞因子如 IFN-γ、TNF-α、IL-12 等可促进 MIF内吞; Th2 相关细胞因子如 IL-4、IL-10 可阻止 MIF内吞。
上述这些受体信号通路为经典通路。更多的研究显示,在无 CXCR2/4 表达或 CD74 缺失的情况下,MIF 的信号传递功能将相应降低或中断。但在横纹肌肉瘤细胞系( RMS) 中,无 CXCR2 和 CD74 的表达,但 MIF 仍能通过 CXCR4 和 CXCR7 介导信号传递,调节细胞对其他趋化因子的反应性及细胞增殖与血管新生。同样,在无 CD74 表达的早幼粒细胞时期 MIF 也可以发挥功能。这些情况都有待于进一步的研究。
( 二) 与 MIF 相关的信号分子通路 与 MIF 相关的信号分子包括 Jab1/JNK 通路,PI3K 通路、Akt、p53、ERK1 /2 等( 图 1 ) ,下面将针对这些分子做简要阐述。
1. Jab1: Jab1 是一可溶性胞浆蛋白,是 CSN 的亚单位,在 N-末端含有 MPN 结构域,MIF 与 MPN 结构域相结合。Jab1 存在于胞浆内和核内。MIF 与Jab1 两者的影响是相互的。细胞自分泌或通过CD74 受体胞吞摄入细胞体的 MIF 与胞内的 Jab1 直接结合,对 Jab1 有反向调节的作用,可抑制 Jab1 对JNK、AP-1 等的磷酸化。Jab1 可与核内 p27 结合,诱导 p27 出核,促进 p27 降解; MIF 可阻止 Jab1与 p27 的结合,导致 p27 的聚集,使细胞处于 G1 期。
Jab1 与 MIF 的结合导致 MIF 的移位与内在化,反馈抑制胞内 MIF 的合成。Jab1 也可抑制 MIF 对 Akt通路的活化作用。Jab1 对多条信号通路都有调控作用,其可以调控 β2 整合素信号通路、MAPK 信号通路以及 JNK 信号通路。
2. JNK: JNK 是 MAPK 家族成员,属于丝 / 苏氨酸蛋白激酶蛋白激酶,能结合 c-Jun 的氨基末端并激活 c-Jun。c-Jun 和 c-Fos 共同组成 AP-1。AP-1 是细胞核内重要的转录因子,通过 MAPK 信号传导通路活化。AP-1 可调控细胞生长转化、上调炎性因子,调控癌细胞迁移等。MIF 对 JNK 既有抑制作用又有促进作用,这一效果取决于细胞的类型。
Jab1 可使 JNK 磷酸化,进而激活 AP-1。MIF 与Jab1 的结合可反向调节 Jab1 的作用,抑制其对 JNK与 AP-1 的作用,且呈剂量依赖性。AP-1 的下调会导致多种信号分子如 Bcl-2、p53 等的表达量下调。在缺氧情况下,心肌细胞通过这一通路下调JNK 通路活性,进而下调 bcl-2 的表达,从而阻止心肌细胞凋亡,保护受损心肌。Bcl-2 的下调可使得BAD 等细胞凋亡蛋白下降,从而抑制细胞凋亡,这一效果在癌症的发生发展中也有重要作用。同时,存在 MIF 通过 CD74 受体活化 JNK 的通路: 在 T 细胞中 MIF 与细胞表面的 CXCR4/CD74 受体结合,通过 Src 酪氨酸激酶活化,使得 JNK 上游分子 PI3K 激活,进而使得 JNK/c-Jun/AP-1 通路有一个快速、短暂的激活。这一反应使得下游的信号分子相应调整,如 IL-8 表达上调等。
3. ERK1 /2: MIF 通过 CD74 / CD44 介导上调ERK1 /2 通路的表达,这一通路主要由 G 蛋白偶联受体介导 Ras-Raf-MAPK/ERK kinase-ERK 途径传导,也可经由酪氨酸激酶传导通路。Ras 通路是连接 MIF 受体与 Ets-1、Ap-1 和 c-Myc 的信号通路。
胞外的 MIF 也可通过内吞进入,与胞浆内的 MLCK结合以发挥作用。MIF 对 ERK1/2 的激活有持续激活和快速短暂激活两种不同的机制。在持续激活通路中,Jab1 的过表达会抑制 MIF 的活性,阻碍 ERK的磷酸化。同时,PI3K 的抑制剂也可以抑制 MIF 对ERK1 /2 的活化。相关研究表明,血清中 MIF 过高会阻碍这一通路的表达,而内分泌型 MIF 则会诱导该通路的持续活化。
ERK 信号分子的上调可促进 cox-2、PGs、p53、MSK 等一系列分子水平的提高。在脊髓小神经细胞系中,MIF 通过这一通路促进 PGE2 的表达上调,从而诱导 cox-2 的表达,这在炎症反应中有重要作用。同时,cox-2 可抑制 p53 在细胞内的聚集,从而抑制细胞凋亡,这在自身免疫病与癌症发生中有重要作用。ERK1/2 通路还含有促进血管新生的作用,并通过对 IL-8 及 MSK1 和 RSK1 等下游因子的释放,来调节细胞活性。
在短暂快速激活通路中,胞核内 Elk-1 转录因子的表达量明显上调。血清中 MIF 的量对 ERK 的激活量效关系呈钟形,且受温度、pH 等的影响。当给予短暂胞外 MIF 处理后,胞内 ERK 通路会快速激活,这在持续激活通路中是不曾见到的。微量 Jab1对 ERK1/2 的上调是必须的。相关实验证实在短暂快速通路中 MIF 通过酪氨酸激酶传递信号,可使MEK1 /2 磷酸化,且应用其上游激酶 Raf-1 的拮抗剂并不能完全阻断这一通路,说明存在 MEK1/2 上游的其他激酶参与了这一通路的发生。
4. PI3K / Akt: MIF 通过与 CD74 受体的结合使得 Src 酪氨酸激酶磷酸化,从而激活 PI3K; PIP3 表达量上调,招募丝/苏氨酸激酶 Akt 于细胞膜并磷酸化。无论是胞内还是胞外的 MIF 均可调控 Akt 的表达,Akt 受质膜型受体或内吞型受体传导信号,但具体情况要依据细胞系而定。Akt 通路与 MIF 的抗细胞凋亡以及血管新生等作用相关。PI3K 可促进 IL-8、ICAM-1、VCAM-1 等细胞因子的释放,从而促进血管新生; 同时,ICAM-1 与炎性细胞的粘附与动脉粥样硬化的发生也有很大关系。Akt 可使BAD 蛋白磷酸化,从而使其不能阻止 Bcl-2 和 Bcl-xL 抗凋亡的功能。同时 Akt 通路的激活还可以抑制 caspase-3 的活化,抑制细胞凋亡。这在癌症的发生以及治疗中有很大的提示作用。
5. p53 和其他分子: MIF 与 p53 的关系非常复杂,要依据细胞的特性而定。Jab-1 可与 p53 结合,诱导 p53 进入细胞质中降解,MIF 与 Jab-1 的结合可抑制 p53 降解; 同时,MIF 也可诱导 NO 的产生,从而促进 p53 的产生,促进细胞凋亡。但是,MIF 也有阻碍 p53 产生,促进其降解的效果。MIF 的第 81 位半胱氨酸可与 p53 结合,介导 p53 降解; 同时,MIF也可通过对 cox-2 的调控抑制 p53 聚集,而 p53 也可抑制 MIF 的功能。
MIF 还可上调 TLR-4 的表达。MIF 可通过作用于一种转录因子 ETS 家族成员 PU. 1 来激活 TLR-4的基因,其可编码与 LPS 结合的受体复合物。TLR-4 具有信号传导功能,有类似 NF-κB 的活性,可引起巨噬细胞活化、增生、释放炎症因子,因此其在固有免疫中有重要作用。MIF 可上调基质金属蛋白酶( MMPs) 的功能,这一调控机制是通过 MEK1/2-JNK( AP-1) -MMPs 通路进行,而不是经由 MMPs 活化经典通路。该功能与癌细胞浸润,粥样硬化斑块不稳定,以及自身免疫疾病有重要关系。MIF 与 NF-κB可以形成正性环路。许多炎性因子如 TNF-α、IL-1β、oxLDL等可经由此通路促进 MIF 的释放。MIF 通过 CD74/CD44 受体介导,经由Akt 通路激活 NF-κB 的释放。NF-κB 可调节多种炎性因子的表达量,其可诱导 IL-1β、IL-8 生成,保证 B细 胞 存 活 等 。同 时 MIF 也 连 接 了 NF -κB 与 p53之间的关系,在细胞衰老与炎症反应中有重要作用。
由以上研究可以看出,MIF 与各通路间的关系并不是孤立的,而是以调节网络的形式存在。MIF对单一的信号分子的调控也要依据不同的细胞系而定。目前,MIF 的机制研究还未完全清楚,需要进一步的探索证明。
二、MIF 的功能
MIF 作为炎性趋化因子,在许多疾病如代谢性疾病( 如动脉粥样硬化) 、自身免疫病、癌症、传染性疾病( 如败血症) 以及伤口愈合中都有非常重要的作用,因此可作为这些疾病的生物标记物或据此靶点研究新的治疗方案。同时,MIF 也是重要的内分泌激素,具有调节血糖、调控糖皮质激素( GCs) 的功能。本节将依据 MIF 的基本功能以及其在各重要疾病中的功能作详细介绍。
( 一) MIF 的基本功能
1. 与激素的相互作用: GCs 在人体具有免疫抑制的作用,好处是可以增强人体各器官对紧张、炎性刺激的容许作用; 坏处是降低人体免疫力,抑制蛋白质合成等一系列问题,浓度过高可导致库欣式综合症。MIF 与 GCs 间的作用是相互的。虽然 GC 对免疫细胞中其他炎性因子具有抑制作用,但是其对MIF 释放的促进作用要大于拮抗作用; 相反 MIF 对GCs 具有拮抗作用,调节 GCs 浓度使其不致过高。
MIF 可在紧张以及生理条件下伴随 GCs 而释放,且每日 MIF 与 GCs 在体内的浓度曲线有很好的契合度。生理浓度的 GCs 可刺激 MIF 的释放,但是高浓度的 GCs 可抑制 MIF 释放。MIF 通过与 CD74/CD44 受体结合,从而介导 MAPK 受体通路,通过对磷脂酶 A2及花生四烯酸的调节,从而拮抗 GCs 作用。虽然 MIF 与 GCs 在免疫功能上是拮抗关系,但是二者的精确调整也维持了免疫的平衡。而尽管MIF 与 GCs 有重要关系,但在库欣式综合症患者及胰岛素过高引起的低血糖患者中,MIF 的表达量并没有提高,这个问题还有待于研究。
MIF 可调节胰岛素的释放以及糖代谢。MIF 可由胰岛 β 细胞合成,其与胰岛素在共同的释放颗粒中释放入血,并且有自分泌和旁分泌激素功能。当局部环境葡萄糖水平过高时,可促进 MIF 的释放,从而促进胰岛素释放,降低血糖和 MIF 的含量。
MIF 可促进骨骼肌、心肌对葡萄糖的摄取和利用。在分子水平上,MIF 上调葡萄糖转运体 4 和磷酸果糖激酶 2 的浓度; 同时其可通过上调 TNF-α 促进糖酵解,这一效果在应激情况下更明显。在全身炎性反应导致的血糖改变现象中,MIF 与胰岛素受体 1 和 Akt 通路有关。
2. 促炎性作用: MIF 是多功能促炎性因子,同时其可调节固有免疫与特异性免疫。MIF 可促进巨噬细胞的活化,从而形成正性反馈环路。MIF 通过多种途径完成炎症细胞的招募: 通过上调 VCMA-1 与ICAM-1 的量促进白细胞与血管内皮粘附; 通过与CXCR2 /4 受体结合,从而促进炎性部位对白细胞的招募; 通过促进单核细胞趋化蛋白-1( MCP-1) 的表达。同时,MIF 通过促进 cox-2、抑制 p53 通路从而阻止巨噬细胞因激活导致的凋亡,维持炎性反应。MIF 的促炎性功能可由 TLR4 调节,其可促进 IL-6、IL-1β、TNF-α 等一系列炎性因子的释放,并经由MAPK 通路激活致炎相关基因的转录因子,同时拮抗抗炎物质( 如糖皮质激素) 的作用。
( 二) MIF 在相关疾病中的功能
1. MIF 在动脉粥样硬化中的作用: 随着研究的进展,人们发现动脉粥样硬化与慢性炎症有十分重要的关系,低密度脂蛋白( LDL) 在血管内膜的沉积有助于促进内皮细胞与平滑肌细胞的增生。而 MIF作为多向炎性因子,其与 LDL 的关系十分密切,可促进动脉粥样硬化的发生与发展。在正常的血管中,有轻微的 MIF 表达; 然而在炎性部位血管中,MIF 的表达量显着上调。MIF 主要由血管内皮细胞、巨噬细胞、T 细胞和平滑肌细胞分泌。这些细胞在炎症反应之前即可储存 MIF,受到刺激后在 MIF转录还未开始即可释放 MIF。这些细胞在分泌MIF 的同时,还至少分泌一种 MIF 的受体,如 CD74、CXCR2、CXCR4 等,表明这些细胞不仅仅是 MIF 的储存、分泌代谢池,而且是 MIF 的受体细胞,接受MIF 的信号刺激。
MIF 在粥样硬化的各个时期均有表达,促进其发展。研究表明,在 MIF 缺乏的鼠模型中,斑块的大小和炎症程度均有减低。同样,应用 MIF 的中和抗体可减少斑块损伤,降低血管的狭窄程度。因此 MIF 在急性冠脉综合征与慢性心脏病中有重要作用。
在斑块中,TNF-α、IFN-γ、CD40L、血管紧张素 II( AngII) 以及氧化低密度脂蛋白( oxLDL) 等可促进MIF 的分泌,尤其是 oxLDL 对 MIF 的释放及动脉粥样硬化的形成都有决定性的作用。在斑块中单核/巨噬细胞的募集与 MIF 相关。MIF 可通过以下三个途径诱导白细胞进入斑块: ( 1) 诱导血管内皮细胞中 ICAM-1 与 CCL-2 的合成; ( 2) MIF 也具有趋化因子的功能,可与单核细胞上的 CXCR2 受体,及 T 细胞生的 CXCR4 受体结合; ( 3) MIF 可上调血管内皮细胞膜上整合素。在斑块形成的脂纹期,MIF便可促进中性粒细胞趋化于内皮细胞,这在粥样硬化早期斑块的形成起重要作用。进入斑块内的单核细胞进而转化为巨噬细胞,最终转化为泡沫状细胞。
斑块内的 MIF 可促进炎性因子如 TNF-α、IL-1β、iNOS、NO 等的释放,增加斑块局部炎性作用,进而为白细胞的进一步招募奠定基础。MIF 可抑制p53 的功能,从而促进炎症反应,抑制细胞凋亡,p53的缺失可导致动脉粥样硬化斑块的自发形成。
MIF 可促进斑块内平滑肌细胞基质金属蛋白酶( MMPs) 的释放,其中 MMP1、MMP9 和 MMP12 可以导致斑块的活动,增加破裂的危险。同时,MIF 可拮抗血管平滑肌细胞释放的血小板衍生生长因子,从而阻止其对斑块的稳固作用。
目前,已经拥有了针对 MIF 三聚体的拮抗剂,其具体临床效果还在研究之中。针对正在研究的 MIF 拮抗剂,有以下一些拮抗机制: ( 1) 结合于MIF 活性位点; ( 2) 变构抑制; ( 3) 共价修饰 MIF 活性位点残基; ( 4) 通过对 MIF 单体-三聚体互变异构的破坏; ( 5) 稳定 MIF 单体,阻止其向有活性的三聚体转化。
2. MIF 在自身免疫病中的功能: 与 MIF 相关的自身免疫病包括风湿性关节炎、系统性红斑狼疮( SLE) 等。相关研究表明,在风湿性关节炎中,不仅仅是血液与关节滑液中 MIF 的含量会上升,甚至在炎症部位的关节滑膜鞘、滑膜囊等组织中 MIF 含量多有显着上升,并且与疾病发病的严重程度呈正相关。应用抗 MIF 抗体作用于发炎的关节部位,相应的炎性因子如 TNF-α 等的含量下降。在炎症发生部位,MIF 能够提高 VEGF( 内皮细胞生长因子)的含量,因此具有促进血管新生的作用。研究表明,在风湿热中,MIF 发挥功能与甘露糖结合凝集素相关。MIF 在自身免疫性肾病中的作用十分巨大。
在 IgA 型肾病与血管球性肾炎的患者中,MIF 的量表达上调。MIF 还可以促进肾血管内皮的活化,从而促进慢性肾脏疾病的发生。
研究表明在慢性胃病中,MIF 的释放与氧化应激相关,而与肾脏的病变程度无关,同时慢性肾病与心血管疾病相关。MIF 通过活化 T 细胞诱导肾脏疾病,机制有 MIF 可募集 T 细胞到肾脏,诱导炎症反应; MIF 可诱导 T 细胞的增殖和活化。同时 MIF 可通过刺激炎性因子诱导巨噬细胞活化; MIF 对糖皮质激素的抑制作用加重了慢性炎症对肾脏的损伤。
MIF 可在系统性红斑狼疮( SLE) 中高表达,而这一原因部分与 GCs 治疗相关。体内高浓度 MIF的 SLE 患者中,其预后与并发症情况均不良,对血清 MIF 量的监测可以很好地评估 SLE 的严重程度。
MIF 介导的 SLE 恶化是由 CD74 / CD44 受体介导,B、T 细胞参与下完成的。GCs 治疗为 SLE 治疗的经典方法,但是近来有几组研究报道 GCs 对 SLE 的预后有不良作用,而这一结果与 MIF 有很大关系。
GCs 通过上调 IF-κBα 蛋白从而抑制 NF-κB 的活性,抑制炎性作用; 而 GCs 又可激活 MIF 的释放,MIF可激活 NF-κB 环路,从而诱导 GCs 抵抗,促进炎症反应发生,使 SLE 的病情恶化。对于给予大量糖皮质激素治疗的患者来说,查看 MIF 与类固醇的水平关系,可诊断患者是否有潜在炎性反应的风险,对患者尿中 MIF 水平监测可判断其肾脏是否受累。
3. MIF 在癌症中的作用: 癌症的发生与多种因素有关,包括生物因素与非生物因素,其中慢性炎症对癌症发生的刺激作用已经被人们证实。癌症具有以下六个特点: 自我诱导增殖能力; 对抗增殖的信号分子不敏感; 抗凋亡能力; 潜在的无限增殖能力; 促进血管新生的能力; 以及周围组织浸润及转移的能力。研究证实 MIF 在多种癌症中均有表达,而 MIF对癌细胞的六个特点都有一定的促进作用,从而促进了肿瘤的发生。MIF 在胰腺癌的恶化中有很重要的作用。MIF 通过拮抗 p53 的功能从而阻止癌细胞的凋亡; 通过促进 ERK1/ERK2 的级联信号通路,从而促进 NOS2 和 NF-κB 通路,进而阻止 p27 的降解,从而使癌细胞分化程度更低,恶性程度更明显。
ZEB1 /2 可促进上皮间质化生 ( EMT) ,从而导致细胞分化程度低,促进肿瘤发生; 而 miR-200b 可与ZEB1 /2 结合,形成负反馈环路,抑制 ZEB1 /2 活性,形成间质上皮化生( MET) 。MIF 可促进 ZEB1/2 的活性,抑制 miR-200b 的活性,降低 E-钙粘素的含量,提高波形蛋白的活性,从而导致胰腺癌细胞上皮间质化生。同时,MIF 还与胰腺癌细胞的浸润能力呈正相关。MIF 可作为胰腺癌独立的诊断和评测预后的指标。
相关研究表明,在宫颈癌的淋巴转移过程中,不同亚型的 MIF 对癌细胞淋巴转移的促进作用不同,第 173 位核苷酸突变为胞嘧啶后,其对癌症的促进作用及淋巴转移都大大增强,而这一效果在野生型MIF 中没有体现。MIF 对癌症的发生发展的促进作用还有很多方面,在这里不一一列举。
4. MIF 在代谢性疾病中的作用: MIF 可通过其激素样作用,对胰岛素及糖皮质激素等进行调控,可导致的疾病包括肥胖、糖尿病及动脉粥样硬化。目前,肥胖患者逐渐增多,并呈年轻化趋势。研究表明,MIF 可促进青少年肥胖症的发生。高 BMI 的患者其 MIF 含量高,并且与血中 FFA 代谢、及 CRP 相关。MIF 对糖尿病的发生及进展有重要作用。肥胖又是 2 型糖尿病发病的重要因素,研究表明,MIF 在妊娠糖尿病的发病中有重要作用。MIF 介导的TNF-α 调控紊乱使得胰岛素抵抗,这一功能由 Akt通路介导,从而促进了糖尿病的发生。MIF 对胰岛也具有损伤作用,其可使胰腺中炎性细胞增多,最终导致胰岛细胞受损,促进 2 型糖尿病的发生。该通路由 CXCR4 受体及 G 蛋白偶联受体 2 激酶介导。近来也有体外实验表明,MIF 的缺失可阻止炎性因子如 INF-γ、TNF-α、IL-1β 等的作用,从而保护胰岛细胞免于凋亡; 该作用是通过下调线粒体凋亡通路、ERK1/2 通路及 NF-κB 通路完成的。
5. MIF 在其他疾病中的作用新进展: MIF 可诱导心房纤颤。T 型钙离子通道缺失是心房纤颤发生的重要机制。介于 MIF 对钙离子通道的功能,MIF可通过酪氨酸激酶通路降低 T 型钙通道的 α1G 和α1H 亚单位,从而诱导心房纤颤的发生。MIF 可辅助抗抑郁治疗。MIF 可在神经细胞中分泌,其抗抑郁的功能在近期被发现。目前针对抑郁症的发病机制有五羟色胺学说,谷氨酸学说等,最为公认的发病机制是由于脑内蓝斑五羟色胺合成减少导致色氨酸羟化酶 2( Tph2) 和脑神经营养因子( Bdnf) 是脑内针对抗抑郁常规治疗后升高的两个生化指标。
在脑内提高 MIF 的表达量后,这两个生化指标明显上升。同时,脑内 Dcx 和 Pax6 的浓度也有所上升,证明脑内新生神经元的发生。MIF 具有提高脑内五羟色胺浓度的功能,其可增强活动疗法和电击疗法等抗抑郁治疗的效果。MIF 的这一功能是经由CD74 / G 蛋白偶联受体、RhoA-ERK1 /2 通路介导的,应用 MIF 抗体或特异性通路阻滞剂可阻碍抗抑郁治疗的敏感性。
三、展望
随着对 MIF 研究的日渐深入,对其功能的了解也有了进一步的发展,这大大促进了与其相关疾病的了解,也为新靶点的治疗奠定了基础。目前针对MIF 的功能已经有了部分临床的应用,如作为相关疾病的诊断标志物,及作为相关疾病的治疗靶点。但是对于 MIF 的研究还没有完全清楚,其应用范围还有进一步的扩大空间,有待于我们进一步的研究。
参 考 文 献
1 Simons D,Grieb G,Hristov M,et al. Hypoxia ‐ inducedendothelial secretion of macrophage migration inhibitory fac-tor and role in endothelial progenitor cell recruitment. J CellMol Med,2011,15668 ~ 678.
2 Rosado Jde D,Rodriguez-Sosa M. Macrophage migration In-hibitory factor ( MIF) : a key player in protozoan infections.Int J Biol Sci,2011,71239 ~ 1258.
3 Grieb G,Merk M,Bernhagen J,et al. Macrophage migra-tion inhibitory factor ( MIF) : a promising biomarker. DrugNews Perspect,2010,23257 ~ 264
4 Lue H,Thiele M,Franz J,et al. Macrophage migration in-hibitory factor ( MIF) promotes cell survival by activation ofthe Akt pathway and role for CSN5 / JAB1 in the control ofautocrine MIF activity. Oncogene,2007,265046 ~ 5059.
5 Bernhagen J,Krohn R,Lue H,et al. MIF is a noncognateligand of CXC chemokine receptors in inflammatory andatherogenic cell recruitment. Nat Med,2007,13 587 ~596.
6 Schwartz V,Krüttgen A,Weis J,et al. Role for CD74 andCXCR4 in clathrin-dependent endocytosis of the cytokineMIF. Eur J Cell Biol,2012,91435 ~ 449.
7 Lue H,Dewor M,Leng L,et al. Activation of the JNK sig-nalling pathway by macrophage migration inhibitory factor( MIF) and dependence on CXCR4 and CD74. Cell Signal,2011,23135 ~ 144.
8 Gesser B,Rasmussen M,Raaby L,et al. Dimethylfumarateinhibits MIF-induced proliferation of keratinocytes by inhibi-ting MSK1 and RSK1 activation and by inducing nuclear pc-Jun ( S63 ) and p-p53 ( S15 ) expression. Inflamm Res,2011,60643 ~ 653.
9 Sivaram G,Tiwari SK,Bardia A,et al. Macrophage migra-tion inhibitory factor,Toll-like receptor 4,and CD14 poly-morphisms with altered expression levels in patients with ul-cerative colitis. Hum Immunol,2012,73201 ~ 205.10 Salminen A,Kaarniranta K. Control of p53 and NF-κB sig-naling by WIP1 and MIF: role in cellular senescence andorganismal aging. Cell Signal,2011,23747 ~ 752.
11 Miller EJ,Li J,Leng L,et al. Macrophage migration in-hibitory factor stimulates AMP-activated protein kinase inthe ischaemic heart. Nature,2008,451578 ~ 582.
12 Emonts M,Sweep FC,Grebenchtchikov N,et al. Associa-tion between high levels of blood macrophage migration in-hibitory factor,inappropriate adrenal response,and earlydeath in patients with severe sepsis. Clin Infect Dis,2007,441321 ~ 1328.
13 Amin MA,Volpert OV,Woods JM,et al. Migration inhib-itory factor mediates angiogenesis via mitogen-activated pro-tein kinase and phosphatidylinositol kinase. Circ Res,2003,93321 ~ 329.
14 Amin MA,Haas CS,Zhu K,et al. Migration inhibitoryfactor up-regulates vascular cell adhesion molecule-1 andintercellular adhesion molecule-1 via Src,PI3 kinase,andNFκB. Blood,2006,1072252 ~ 2261.
15 Veillat V,Lavoie CH,Metz CN,et al. Involvement of nu-clear factor-κB in macrophage migration inhibitory factorgene transcription up-regulation induced by interleukin-1βin ectopic endometrial cells. Fertil Steril,2009,91 2148 ~ 2156.
16 Cao W,Morin M,Sengers V,et al. Tumour necrosis fac-tor-α up-regulates macrophage migration inhibitory factorexpression in endometrial stromal cells via the nuclear tran-scription factor NF-κB. Hum Reprod,2006,21 421 ~428.
17 Benigni F,Atsumi T,Calandra T,et al. The proinflamma-tory mediator macrophage migration inhibitory factor in-duces glucose catabolism in muscle. J Clin Invest,2000,1061291 ~ 1300.
18 Atsumi T,Cho YR,Leng L,et al. The proinflammatorycytokine macrophage migration inhibitory factor regulatesglucose metabolism during systemic inflammation. J Immu-nol,2007,1795399 ~ 5406.
19 Weber C,Noels H. Atherosclerosis: current pathogenesisand therapeutic options. Nat Med,2011,171410 ~ 1422.20 Tillmann S,Bernhagen J,Noels H. Arrest functions of theMIF ligand / receptor axes in atherogenesis. Front Immunol,2013,4115.
21 Verschuren L,Kooistra T,Bernhagen J,et al. MIF defi-ciency reduces chronic inflammation in white adipose tissueand impairs the development of insulin resistance,glucoseintolerance,and associated atherosclerotic disease. CircRes,2009,10599 ~ 107.
22 Herder C,Illig T,Baumert J,et al. Macrophage migrationinhibitory factor ( MIF) and risk for coronary heart disease:results from the MONICA / KORA Augsburg case-cohort。study,1984-2002. Atherosclerosis,2008,200380 ~ 388.
23 Müller II,Müller KA,Schnleber H,et al. Macrophagemigration inhibitory factor is enhanced in acute coronarysyndromes and is associated with the inflammatory re-sponse. PLoS One,2012,7e38376.
24 Lin SG,Yu XY,Chen YX,et al. De novo expression ofmacrophage migration inhibitory factor in atherogenesis inrabbits. Circ Res,2000,871202 ~ 1208.
25 Gregory JL,Morand EF,McKeown SJ,et al. Macrophagemigration inhibitory factor induces macrophage recruitmentvia CC chemokine ligand 2. J Immunol,2006,177 8072 ~ 8079.
26 Ouertatani-Sakouhi H,El-Turk F,Fauvet B,et al. Identi-fication and characterization of novel classes of macrophagemigration inhibitory factor ( MIF) inhibitors with distinctmechanisms of action. J Biol Chem,2010,285 26581 ~26598.
27 Xu L,Li Y,Sun H,et al. Current developments of macro-phage migration inhibitory factor ( MIF) inhibitors. DrugDiscov Today,2013,18592 ~ 600.
28 Col-Araz N,Pehlivan S,Baspinar O,et al. Association ofmacrophage migration inhibitory factor and mannose-bindinglectin-2 gene polymorphisms in acute rheumatic fever. Car-diol Young,2013,23486 ~ 490.
29 Wang FF,Zhu LA,Zou YQ,et al. New insights into therole and mechanism of macrophage migration inhibitory fac-tor in steroid-resistant patients with systemic lupus erythe-matosus. Arthritis Res Ther,2012,14R103.
30 Funamizu N,Hu C,Lacy C,et al. Macrophage MigrationInhibitory Factor ( MIF) induces epithelial to mesenchymaltransition,enhances tumor aggressiveness and predicts clin-ical outcome in resected pancreatic ductal adenocarcinoma.Int J Cancer,2013,132785 ~ 794.