研究发现 Wnt/β-catenin 信号传导通路涉及骨骼发育的各个方面,激活 Wnt/β-catenin 信号通路能促进成骨细胞始祖细胞增殖和分化,增加成骨细胞的活性,从而促进新骨形成,增加骨密度。骨质疏松发生的分子生物学机制可能涉及 Wnt/β-catenin 信号通路的改变。本研究观察去卵巢对 SD 大鼠Wnt / β-catenin 信号通路中的低密度脂蛋白受体相关蛋白 5( LRP5) 、β-catenin mNRA 表达的影响。
1 材料与方法
1. 1 材料与设备 双能 X 线骨密度测量仪( Dexa,美国) ; 奥林巴斯光学显微镜( 日本) ; Laica 切片机( 德国) ; FTC2000 实时荧光定量基因扩增仪( Funglyn,加拿大) ; 雌二醇( E2) 、骨源性碱性磷酸酶( BALP) 、抗酒石酸酸性磷酸酶( TRACP5b) 酶联免疫法试剂盒( 罗氏公司,美国) ; LRP5 单克隆抗体( Genetex ,美国) ,β-catenin 单克隆抗体( 武汉博士德生物工程有限公司,中国) ; Trizol 试剂( Invitrogen,美国) ; RevertAidTMFirst Strand cD-NA Synthesis kit ( Fermentas,德国) ,Taq DNA PCR 反应试剂盒( Takara,中国) ,其余试剂均为市售分析纯。3 月龄未育雌性SD 大鼠 20 只,由四川大学华西医院实验动物中心提供。
1. 2 方法
1. 2. 1 分组与造模 实验动物饲养于四川大学华西医院动物实验中心,清洁级环境。适应性饲养 1 w 后,按随机数字表法把 20 只实验大鼠随机分为正常对照组和去势组,每组 10 只。参照 Gregory 等〔5〕对去势组大鼠施行双侧卵巢切除术,术后每只大鼠肌肉注射青霉素 4 万 U,1 次/d,连用 3 d 以预防感染。正常对照组大鼠不作任何处理。每只实验大鼠分笼饲养在温度 20℃ ~26℃,湿度 60% ~70%,12 h 间隔照明自由摄食。
1. 2. 2 标本采集及处理 去势手术后 12 w,眼眶取血 2 ml,室温静置2 h,低温3 000 r/min 离心15 min,每份分3 次用移液管取上层血清约 300 ~500 μl,分别置于 3 个 1. 5 ml EP 管中,于-70℃ 冰箱中保存备用。
1. 2. 3 血清 E2、BALP 和 TRACP5b 检测 采用 ELISA,严格按照试剂说明书操作,测定血清 E2、BALP 和 TRACP5b 水平。
1. 2. 4 骨密度测定 双能 X 线骨密度测量仪测定实验动物左股骨骨密度。处死大鼠后,迅速取出左侧股骨、剥离肌肉、生理盐水冲洗,将股骨放在盛有深约 2. 5 cm 的蒸馏水( 用于模拟股骨周围的软组织) 的容器中,用小动物软件进行扫描。
1. 2. 5 LRP5 及 β-catenin mRNA 的 RT-PCR 检测 参照 Trizol说明书,提取大鼠右股骨中骨髓的总 RNA,参照试剂盒说明书进行 RT-PCR,采用 β-actin 作为内参。LRP5 引物上游: 5'-GA-CATTTACTGGCCCAATGG-3',引物下游 5'-CTGCCCTCCACCAC-CTTCT-3',引物间片段长 131 bp; β-catenin: 引 物 上 游: 5'-GGAAAGCAAGCTCATCATTCT-3', 引 物 下 游 5'-AGTGCCTGCATCCCACCA-3',引物间片段长 171 bp; β-actin: 引物上游 5'-GCCAACACAGTGCTGTCT-3',引 物 下 游 5'-AGGAGCAAT-GATCTTGATCTT-3',引物间片段长 114 bp。PCR 反应条件: ①94℃ 2 min ②94℃ 20 s,55℃ 30 s,60℃ 40s,共 45 个循环。根据动力学曲线确定每个样品管中荧光强度增加到某一特定阈值时的扩增循环数( Ct 值) ,将原始数据( Ct 值) 换算为基因的相对表达量( 2-ΔΔCt) 用于统计分析。
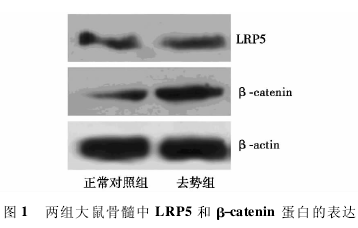
1. 2. 6 Western 印迹检测 取大鼠右股骨中骨髓 100 mg 提取蛋白,SDS-聚丙烯酰胺凝胶电泳,并将蛋白转至硝酸纤维素膜上; 分别加入 LRP5 及 β-catenin 单克隆抗体,4℃孵育过夜; 二抗常温下孵育 2 g 行 DAB 显色和定量分析,利用图像分析软件测定电泳条带的光密度值,目的蛋白相对定量值=目的蛋白条带光密度值/β-actin 蛋白条带光密度值。
1. 3 统计学方法 采用 SPSS13. 0 软件行组 t 检验。
2 结 果
2. 1 血清 E2、BALP 和 TRACP5b 水平 手术后12 w 去势组血清 E2水平为( 23. 94 ±6. 69) pg/ml,比正常对照组 ( 42. 70 ±12. 48) pg / ml 显着降低( P<0. 01) ; 去势组的血清 BALP 水平为( 108. 50±7. 23) U/L,比正常对照组( 91. 30±7. 31) U/L 显着增加( P<0. 01) ; 去势组的血清 TRACP5b 水平为( 12. 92 ±2. 94) U/L,比正常对照组( 8. 54±2. 33) U/L 显着增加( P<0. 01) 。
2. 2 骨密度检测 手术后 12 w 去势 组 的 左 股 骨 密 度( 0. 242±0. 020) g/cm2,比正常对照组( 0. 281 ±0. 021) g/cm2下降 13. 9%( P<0. 01) 。
2. 3 RT-PCR 检测 去势组 β-catenin mRNA 表达 ( 2. 49 ±0. 84) 比正常对照组( 1. 14 ±0. 65) 显着增高( P<0. 05) ,尽管去势组 LRP5 mRNA 表达( 1. 62 ±0. 94) 比正常对照组( 1. 05 ±0. 33) 高,但两组差异没有统计学意义( P>0. 05) 。
2. 4 Western 印迹检测 去势组 β-catenin 蛋白表达( 0. 31 ±0. 13) 比正常对照组( 0. 21 ±0. 05) 显着增高( P<0. 05) ,尽管去势组 LRP5 蛋白表达( 0. 31±0. 13) 比正常对照组( 0. 20±0. 03)高,但两组差异没有统计学意义( P>0. 05) 。见图 1。
3 讨 论
Wnt / β-catenin 信号通路是一种进化非常保守的信号通路,从低等生物到高等哺乳动物都广泛存在,在生物发育、细胞转运及细胞凋亡等生命过程中发挥重要作用并且与肿瘤的发生密切相关,Wnt/β-catenin 信号通路还可以通过干细胞更新、促进成骨细胞始祖细胞增殖和分化、诱导成骨细胞发生、抑制成骨细胞和骨细胞凋亡等机制,促进新骨形成,增加骨密度。
经典 Wnts 信号通路的细胞分子包括 Wnts、LRP5、β-catenin 和 T细胞因子/淋巴增强子结合因子( TCF/LEF) 等。LRP5 是成骨细胞膜上 Wnts 的辅助受体; 能诱导细胞内一系列的信号传递,在骨骼系统发育和维持骨量的过程中起到重要作用。在人类功能缺失的 LRP5 基因突变导致以骨密度降低为特点的骨质疏松症-假神经胶质瘤综合征的发生,而功能获得性 LRP5 基因突变引起骨密度增加。
β-catenin 是一种钙黏蛋白,它直接与钙黏素和肌动蛋白细胞支架连接,对细胞黏附和迁移很重要,调节细胞增殖和生存,是 Wnt/β-catenin 信号通路的重要组成部分,是经典 Wnts 信号通路激活的必要条件,在有 Wnts 信号存在时,Wnts 信号通过蛋白 Disheveled、轴蛋白( Axin) 和 Frat-1 传递至抑制 β-catenin 的蛋白质复合物 ( APC) ,Axin 和糖原合成酶激酶 3( GSK3) 并抑制 GSK3 的活性,释放 β-catenin,从而 β-catenin 在胞质内聚集并进行核转位,在核内,它与 TCF/LEF 转录因子相互作用,介导 Wnts 对基因转录的多种效应。本研究结果提示去势大鼠 Wnt/β-catenin 信号通路被激活,基于 β-catenin在骨形成的重要作用,推断去卵巢促进了大鼠新骨的形成,这从去势大鼠的血清 BALP 显着增高得到证实,因为 BALP 反映成骨细胞活性,可以作为骨形成的生化指标。但是去势大鼠的骨密度总趋势是下降的,这是因为去势后,雌激素降低导致骨吸收增加,在本研究结果说明大鼠去势后骨吸收增加,骨吸收大于骨形成最终导致骨密度下降。本研究结果说明去卵巢 12 w 后大鼠 Wnt /β-catenin 信号通路被激活,在去势大鼠骨组织代谢和骨重建过程中起到重要作用。然而一项研究发现大鼠去卵巢 4 w 和 8 w 后 Wnt /β-catenin 信号通路被抑制。究其原因,Wnt/β-catenin 信号通路在去势大鼠中的功能状态可能与去卵巢的时间有关。
本研究提示 β-catenin 介导的经典 Wnts 信号通路被激活。Wnt / β-catenin 信号通路作为促进骨形成机制的核心,该通路所涉及的靶位或因子有望成为开发新的抗骨质疏松药物的潜在作用位点。研究发现〔12〕电针足三里、三阴交能促进去势大鼠 LRP5、β-catenin 的表达,激活 Wnt /β-catenin 信号通路,从而增加骨密度。然而,由于该信号通路参与了很多基本的生命过程,如胚胎的发生、组织器官的生成等,而且此通路的激活与肿瘤的发生密切相关,因而通过激活 Wnt/β-catenin信号通路的机制来治疗骨质疏松的靶向药物及各种治疗方法的安全性和副作用,需深入研究和全面评估。
4 参考文献
1 Bodine PV,Komm BS. Wnt signaling and osteoblastogenesis〔J〕. Rev En-docr Metab Disord,2006; 7( 1) : 33-9.
2 Hartmann C. A Wnt canon orchestrating osteoblastogenesis〔J〕. TrendsCell Biol,2006; 16( 3) : 151-8.
3 Boyden LM,Mao J,Belsky J,et al. High bone density due to a mutation inLDL-receptor-related protein 5〔J 〕. N Engl J Med,2002; 346 ( 20 ) :1513-21.
4 Monroe DG,McGee-Lawrence ME,Oursler MJ,et al. Update on Wnt sig-naling in bone cell biology and bone disease〔J〕. Gene,2012; 492( 10) :1-18.
5 Gregory LS,Kelly WL,Reid RC,et al. Inhibitors of cyclo-oxygenase-2and secretory phospholipase A2 preserve bone architecture following ovar-iectomy in adult rats〔J〕. Bone,2006; 39( 1) : 134-42.
6 Peifer M,Polakis P. Wnt signaling in oncogenesis and embryogenesis-alook outside the nucleus〔J〕. Science,2000; 287( 5458) : 1606-9.
7 Westendorf JJ,Kahler RA,Schroeder TM. Wnt signaling in osteoblastsand bone diseases〔J〕. Gene,2004; 341( 27) : 19-39.
8 Kikuchi A. Regulation of beta-catenin signaling in the Wnt pathway〔J〕.Biochem Biophys Res Commun,2000; 268( 2) : 243-8.
9 Baron R,Rawadi G,Roman-Roman S. Wnt signaling: a key regulator ofbone mass〔J〕. Curr Top Dev Biol,2006; 76( 3) : 103-27.
10 Han X,Xu Y,Wang J,et al. Effects of cod bone gelatin on bone metabo-lism and bone microarchitecture in ovariectomized rats〔J〕. Bone,2009;44( 5) : 942-7.
11 王 燕,刘 岩,马剑侠,等 . Wnt /LRP5 /β-catenin 信号通路在绝经后骨质疏松发病中的作用〔J〕. 中华妇产科杂志,2011; 46( 10) :769-72.
12 Zhou J,Chen S,Guo H,et al. Electroacupuncture prevents ovariectomy-induced osteoporosis in rats: a randomised controlled tria〔lJ〕. AcupunctMed,2012; 30( 1) : 37-43.
13 Tanaka SS,Kojima Y,Yamaguchi YL,et al. Impact of WNT signaling ontissue lineage differentiation in the early mouse embryo〔J〕. Dev GrowthDiffer,2011; 53( 7) : 843-56.
14 Sokol SY. Maintaining embryonic stem cell pluripotency with Wnt signa-ling〔J〕. Development,2011; 138( 20) : 4341-50.
15 Wend P,Holland JD,Ziebold U,et al. Wnt signaling in stem and cancerstem cells〔J〕. Semin Cell Dev Biol,2010; 21( 8) : 855-63.
16 Burgess AW,Faux MC,Layton MJ,et al. Wnt signaling and colon tumor-igenesis-a view from the periphery〔J〕. Exp Cell Res,2011; 317 ( 19) :2748-58.