
沉默信息调节因子 2(silent information regulator2,sir2) 是一种烟酰胺腺嘌呤二核苷酸(nicotinamideadenine dinucleotide,NAD+) 依赖的去乙酰化酶,能够延长酵母和果蝇的寿命; 人类中与 Sir2 同源的蛋白有七个: SIRT1-SIRT7。基于分子系统发育分析,可将其分为四类。SIRT1、SIRT2 和 SIRT3 属于第一类,具有强大的 NAD+依赖去乙酰化酶活性; 属于第二类的 SIRT4 则具有 ADP-核糖转移酶活性; 属于第三类的 SIRT5 除了具有微弱的去乙酰化酶活性外,还拥有 NAD+依赖的去丙二酰化酶和去丁二酰化酶活性; 最后发现的 SIRT6 和 SIRT7 则属于第四类,其中 SIRT6 同时具有去乙酰化酶和 ADP-核糖转移酶活性,SIRT7 具有去乙酰化酶活性。七个 sirtuin 蛋白具有不同的细胞定位,主要定位在细胞核的有SIRT1、SIRT6 和 SIRT7,其中 SIRT7 主要定位在核仁; SIRT3、SIRT4 和 SIRT5 主要定位在线粒体;SIRT2 则主要定位在细胞质中。Sirtuins 能够通过调控能量代谢、基因组稳定性等参与调控包括衰老在内的众多生命过程。本文则主要对其中之一的SIRT6 的功能与疾病的关系作一介绍。
一、SIRT6 结构特点
人 SIRT6 基因定位在染色体 19p13. 3。全长含8 个外显子,其中 4 号外显子最短,含 40 个碱基,8号外显子最长,含 838 个碱基。蛋白质分子全长355 个氨基酸,分子量约 39. 1kD,等电点 9. 12(Gertler 等. 2013) 。SIRT6 与其已知靶分子都主要定位在细胞核。其在人和小鼠多种组织中都有表达,在人的大脑、肾和心中表达较高(Michishita 等.2005) 。
SIRT6 由 N 端、C 端和保守的中心结构域组成(图 1) ,C 端和核定位有关,与酶活性无关; N 端与染色体结合及催化活性有关; 中心结构域至关重要,只要突变一个组氨酸就能使它催化活性消失,失去与染色体结合能力。研究还发现,SIRT6 与其它 sir-tuin 蛋白不同,在结构上有展开的锌结合结构域,无螺旋束; 有稳定的单螺旋,无保守的高度灵活的NAD+结合环。

与其它大部分 sirtuin 蛋白不同,起初未发现SIRT6 具有 NAD+依赖的去乙酰化酶活性,仅发现其 NAD+依赖的核糖基转移酶活性。直到 2008 年,才由 Michishita 等发现 SIRT6 的第一个特异的去乙酰化底物 H3K9,随后很快又发现另一同类底物H3K56(Michishita 等. 2009) 。随着研究不断深入,已知 SIRT6 的去乙酰化底物也包括非组蛋白 C 末端结合蛋白相关蛋白(C-terminal binding protein in-teracting protein,CtIP) 、乙酰化酶通用控制非抑制蛋白 5(general control nonrepressed protein 5,GCN5)等。然而令人惊讶的是 SIRT6 在体外的去乙酰化活性竟非常弱,与其去乙酰化的重要功能不匹配,但随后的研究在一定程度解释了这个问题。Gil 等发现 SIRT6 的去乙酰化活性是核小体依赖的,只有H3 和 H4 以核小体的形式存在时,才被 SIRT6 去乙酰化。Jiang等则发现SIRT6晶体结构中一个大的疏水性口袋结构(hydrophobic pocket) 使它能在体内体外高效的从赖氨酸残基上去除长链脂肪酰基基团。这种对长链脂肪酰基的亲和性使 SIRT6 能去除肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) 的第 19 位和 20 位的赖氨酸上的脂肪酰基,进而促其分泌(Jiang 等. 2013) 。基于此,Feldman 等随后发现某些游离长链脂肪酸可提升其去乙酰化活性(Feldman 等. 2013) 。这说明 SIRT6 的去乙酰化酶活性需在特定条件下才起作用,另一方面还说明SIRT6 的活性不仅局限在去乙酰化。
二、SIRT6 的功能
SIRT6 有缺陷的小鼠细胞与正常相比对 DNA损伤刺激更敏感,基因组不稳定性加剧; SIRT6 敲除小鼠不仅瘦小且在出生 2 ~ 3 周时出现淋巴细胞减少、皮下脂肪缺失、脊椎弯曲、结肠炎、骨量减少和严重代谢缺陷等衰老相关退行性变化,在出生约四周时死亡。这足以说明 SIRT6 的重要性,而随后系列研究更说明 SIRT6 在 DNA 损伤修复、基因组稳定性、代谢、炎症、癌症和众多疾病调控过程中的重要性。
(一) SIRT6 和基因组稳定性 SIRT6 缺陷小鼠细胞常表现出碱基切除修复缺陷和基因组不稳定性等相关症状,可见 SIRT6 或有可能通过提高碱基切除修复能力,由此对抗 DNA 损伤,抑制基因组不稳定性。而 Michishita 等研究发现,这种早衰症状和基因组不稳定性的出现,主要是因为细胞中端粒功能的紊乱,而非碱基切除修复能力的缺陷。
WRN 能够与端粒特异结合蛋白 TRF1、TRF2 及POT1 等相互作用,激活其自身的核酸外切酶及解旋酶活性,促进端粒的复制和 DNA 损伤修复,避免因端粒复制异常而造成的端粒缺失和失调,而 WRN的缺失则会引起早老症状(沃纳综合征) 的出现。
敲低 SIRT6 后的症状同沃纳综合征症状类似,SIRT6能在 S 期与端粒结合,催化端粒上 H3K9 的去乙酰化,提高 WRN 在端粒上的稳定性 ,以免端粒异常。
另外 SIRT6 能多途径提高DNA双链损伤(double-strand break,DSB) 修复能力。它可与 DNA双链损伤修复因子 DNA 依赖的蛋白激酶(DNA-de-pendent protein kinase,DNA-PK) 形成大分子复合物,促进 DNA-PK 催化亚基(DNA-PK catalytic sub-unit,DNA-PKcs) 与 DNA 损伤位点结合,进而促进非同源末端接合 (nonhomologous end-joining,NHEJ) ,修复双链损伤。氧化应激条件下,SIRT6 能催化多聚腺苷酸二磷酸核糖聚合酶 1(poly[adeno-sine diphosphate (ADP ) - ribose] polymerase 1,PARP1) 521 位赖氨酸单 ADP 核糖基化,激活其多ADP 核糖基化活性,进而提高非同源末端接合和同源重组(homologous recombination,HR) 以促进 DNA双链损伤修复。此外,SIRT6 能够通过去乙酰化DNA 双链损伤切除蛋白 C 末端结合蛋白相关蛋白(CtIP) 而促进基于同源重组的 DNA 双链损伤修复。
SIRT6 还能够招募染色体重组因子 SNF2H 到 DNA双链损伤位点,将组蛋白 H3K56 去乙酰化,促进染色体重塑,进而促进 DNA 损伤修复。
靠近端粒位置附近的基因往往处于沉默状态,这种现象被称为端粒位置效应(telomere positioneffect,TPE) ,在酵母中被首次发现。这种沉默效应与端粒的长度呈正相关,并随着细胞的衰老而逐渐变弱。而 SIRT6 在人类细胞中对端粒位置效应的维持起重要作用,它对于端粒附近基因的沉默以及端粒位置效应相关的异染色体标志物的维持都属必需(Tennen 等. 2011) 。
总之,SIRT6 可通过其去乙酰化酶活性和核糖基转移酶活性参与多种 DNA 损伤修复及端粒稳定等调控,进而维持基因组稳定性。
(二) SIRT6 与衰老 SIRT6 蛋白水平随人包皮成纤维细胞(HCA2) 复制性衰老而降低(Mao 等.2012) 。在另外一种人胚肺二倍体成纤维细胞 WI-38 中敲低 SIRT6 可使其复制代龄缩短 10 代,衰老相关的 β-半乳糖苷酶(SA-β-Gal) 活性上升,敲低人脐带血管内皮和大动脉内皮细胞的 SIRT6 能促细胞衰老(Cardus 等. 2013) 。这些说明 SIRT6 在细胞复制性衰老过程的重要性。
核因子 kB(nuclear factor kB,NF-kB) 信号通路在细胞凋亡、细胞衰老、炎症和免疫等过程发挥至关重要的作用,而 SIRT6 则可通过 NF-kB 及其下游基因来调控细胞衰老。Kawahara 等发现 SIRT6 可被NF-kB 的亚基网状内皮增生病毒癌基因同源物 A(reticuloendotheliosis viral oncogene homolog A,RE-LA) 招募到 NF-kB 下游基因的启动子,降低启动子乙酰化水平,抑制与凋亡和细胞衰老相关下游基因的表达。另外,SIRT6 还可在人皮肤成纤维细胞中抑制 NF-kB 信号通路调控胶原的合成和降解,在皮肤抗衰老过程中发挥作用(Baohua 等. 2012) 。
SIRT6 对多种因素诱导的衰老有重要作用。在猪胚成纤维细胞中过表达 SIRT6 能抑制 D-半乳糖等诱发的早衰(Xie 等. 2012) 。在人支气管上皮细胞中,转化生长因子 β(transforming growth factor-β,TGF-β) 能在转录水平促进 p21 表达而促进细胞衰老,而 SIRT6 则可促进 p21 的蛋白酶体降解而抑制TGF-β 诱发的衰老(Minagawa 等. 2011) 。香烟产生的烟雾可诱发细胞衰老,引起慢性阻塞性肺病,SIRT6 则可通过抑制 IGF-Akt 信号通路促进自噬,最终抑制烟雾的促细胞衰老作用 (Takasaka 等.2014) 。
SIRT6 对整体动物寿命的影响也很显著。在雄性小鼠中过表达 SIRT6 能显著延长寿命,但雌性小鼠变化不明显。实验发现,过表达 SIRT6 时,雄性小鼠血清中胰岛素样生长因子 1(insulin-like growthfactor 1,IGF1) 水平降低,胰岛素样生长因子结合蛋白 1 升高,IGF1 信号通路主要组分磷酸化水平改变,而雌性小鼠中这些信号通路却没有明显变化,这可能就是雄性小鼠的寿命延长而雌性小鼠无变化的原因。
热量限制能降低衰老速率、延迟多种衰老相关紊乱出现,延长线虫、果蝇、酵母以及啮齿类动物的寿命。哺乳动物中除 SIRT1 外,SIRT6 也在热量限制延长寿命过程中起着重要作用。小鼠饥饿会提高SIRT6 蛋白稳定性,提升其蛋白水平,进而促进代谢稳态和基因组稳定性,延长小鼠寿命(Kanfi 等.2008) 。
总之,SIRT6 在衰老相关基因调控过程中发挥重要作用,参与复制性衰老及多种衰老过程,对小鼠寿命有显著影响。
(三) SIRT6 与炎症 肿瘤坏死因子 α 能促进SIRT6 和 RELA 结合,进而促进 SIRT6 调控 NF-kB下游基因。反过来 SIRT6 也可在转录后水平调控肿瘤坏死因子,进而影响炎症反应(Van Cool 等.2009) 。在脐带血管内皮细胞中,脂多糖能降低SIRT6 表达,敲低 SIRT6 能促进炎症细胞因子 IL-6、IL8、IL-1β 以及 NF-kB 表达,使 SIRT6 或可作为治疗炎症相关疾病的药靶(Lappas 等. 2012) 。Xiao 等在 SIRT6 突变的小鼠中也发现同样现象,SIRT6 能通过抑制 c-JUN 依赖的促炎症基因如 IL-6、TNFα 的表达而抑制肝炎(Xiao 等. 2012) 。此外,过表达SIRT6 可抑制胶原诱导的关节炎 (Lee 等. 2013 ) 。
然而 Bauer 等发现,SIRT6 在胰腺癌细胞中加强Ca2 +反应,促进炎症细胞因子 IL-8 和 TNF 的表达以及细胞的迁移(Bauer 等. 2012) 。因此 SIRT6 与炎症的关系有待进一步探索。
(四) SIRT6 和代谢 缺失 SIRT6,小鼠出现血糖过低症。多方研究发现,SIRT6 既可调控组蛋白H3K9 乙酰化调控糖分解相关基因,又可抑制缺氧诱导因子 1α(hypoxia inducible factor 1,alpha sub-unit,Hif1α) 而降低葡萄糖吸收、糖酵解以及线粒体呼吸以维持血糖稳态。糖异生关键基因过氧化物酶体增殖物激活受体 γ 辅激活子 1α(peroxisomeproliferator-activated receptor- γ coactivator 1-α,PGC-1α) 的活性受乙酰化调控,GCN5 是其乙酰化酶,去乙酰化酶是 SIRT1。然而,过表达去乙酰化酶 SIRT6反而促进 PGC-1α 乙酰化。进一步试验发现,SIRT6能通过去乙酰化 GCN5 而激活 GCN5,间接促进PGC-1α 乙酰化,调控糖异生和肝脏葡萄糖产生,参与血糖调控(Dominy 等. 2012) 。
特异敲除肝 SIRT6 的小鼠能引起脂肪肝。人脂肪肝中 SIRT6 含量低于正常。实验表明,SIRT6 通过去乙酰化作用于糖酵解、甘油三酯合成和脂肪代谢相关基因启动子,抑制表达,调控脂代谢。在饮食引起的肥胖小鼠中,过表达 SIRT6 可降低脂肪储存相关基因活性,减少内脏脂肪、甘油三酯聚积,提高葡萄糖耐量(Kanfi 等. 2010) 。过氧化物酶体增殖物激活受体 γ (peroxisome proliferator-activatedreceptor- γ,PPAR-γ) 的激活剂罗格列酮能提高大鼠肝 SIRT6 表达而缓解大鼠脂肪肝 (Yang 等.2011) 。此外,SIRT6 可被叉头框蛋白 O3 (forkheadbox O 3,FoxO3 ) 招募到固醇调控元件结合蛋白-2(sterol regulatory element-binding protein 2,Srebp2)和前蛋白转化酶枯草溶菌素 9(proprotein convertasesubtilisin / kexin type 9,Pcsk9 ) 的启动子区,降低H3K9 和 H3K56 的乙酰化水平,抑制 Srebp2 转录,调控胆固醇代谢(Tao 等. 2013) 。
(五) SIRT6 与疾病 和邻近正常组织相比,肝癌、胰腺癌等肿瘤中 SIRT6 的表达量都明显下降。在肝癌细胞系 HepG2 中 SIRT6 的表达量下降可促其生长,过表达 SIRT6 则抑制其生长(Zhang 等.2014) ,小鼠中 SIRT6 的缺陷可使肿瘤数量增多、瘤体增大、侵袭能力提高(Sebastian 等. 2012) 。在肿瘤形成过程中 SIRT6 表达下降的机制可能是: 作为肿瘤抑制因子的泛素特异肽酶 10(ubiquitin-specificpeptidase 10,USP10) 能和 SIRT6 相互作用,并能抑制 SIRT6 泛素化降解,而肿瘤中 USP10 的水平下降,促进了 SIRT6 的降解。
SIRT6 可从细胞凋亡、代谢等多方面起抑制肿瘤的作用。过表达 SIRT6 能诱导 HepG2 细胞凋亡,降低细胞内活性氧簇(reactive oxygen species,ROS)和超氧阴离子(superoxide anion) 水平。此外,过表达 SIRT6 还能够抑制细胞外调节蛋白激酶(extracel-lular regulated protein kinases,ERK) 1 /2 的磷酸化水平,而特异抑制剂 U0126 阻断 ERK1/2 信号通路后,SIRT6 对肿瘤的抑制作用就减弱了。 综上所述,SIRT6 可通过抑制 ERK 1 /2 信号通路而抑制肝癌细胞的增长。同样 Meter 等也发现,与正常的未转化细胞如成纤维细胞不同,在肿瘤细胞中过表达SIRT6 可诱导肿瘤细胞凋亡,该过程依赖于 SIRT6对 p53 和 p73 凋亡信号通路的激活及其单 ADP 核糖基转移酶活性。由于该过程只在肿瘤细胞中发生,使 SIRT6 有望成为治疗肿瘤的良好靶标(Vanmeter 等. 2011 ) 。此外,Min 等发现 SIRT6 能抑制H3K9 的乙酰化,激活 NF-κB 而抑制生存素,进而抑制肝癌发生(Min 等. 2012) 。SIRT6 还可调控癌细胞的需氧糖酵解以及抑制 MYC 转录活性,进而抑制肿瘤(Sebastian 等. 2012) 。
例外的是: 前列腺癌细胞中,SIRT6 水平反而升高; 敲低 SIRT6 能促进细胞周期 G1 期阻滞、促其凋亡及 DNA 损伤水平升高; SIRT6 的缺陷还能提高前列腺癌对化疗的敏感性(Liu 等. 2013) 。可见 SIRT6在不同肿瘤中的表现不完全相同,这可能是由SIRT6 的组织特异性所决定,不过它对于肿瘤的调控作用都至关重要。
除肿瘤外,SIRT6 还参与其他疾病的调控。
SIRT6 缺陷小鼠常表现心肌肥大和心力衰竭症状,已知 IGF-Akt 信号的异常激活与多种疾病包括心力衰竭的发生发展有关。Cunningham 等发现,SIRT6通过与 c-Jun 相互作用,可与 IGF 相关基因的启动子结合,促进 H3K9 去乙酰化,抑制 IGF 信号通路相关基因的表达,最终抑制心肌肥大。在新生的大鼠心肌细胞中过表达烟酰胺单核苷酸腺苷转移酶 2(nicotinamide mononucleotide adenylyltransferase 2,Nmnat2) ,能通过维持细胞内 NAD 的水平而激活SIRT6(Cai 等. 2012) ,SIRT6 或可通过抑制 NF-kB,进而抑制血管紧张素 II (angiotensin II ,Ang II) 诱发的心肌肥大 (Yu 等. 2013) 。此外,SIRT6 还可通过调控糖代谢及脂肪代谢而抑制脂肪肝,敲除神经系统的 SIRT6 则能够引起小鼠过度肥胖(Schwer等. 2010) 。
三、结语与展望
综上所述,我们可以看到,SIRT6 通过其去酰化酶活性和核糖基转移酶活性参与多条信号通路的调控,进而抑制细胞衰老、肿瘤形成以及脂肪肝等代谢疾病,在一定程度上有可能起着延长健康寿命的作用(图 2) 。
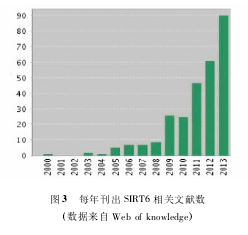
随着研究不断深入,SIRT6 的重要性越来越显现,逐渐成为 sirtuin 家族中除 SIRT1 以外又一研究热点(图 3) 。
关于 SIRT6,有许多问题待解决。首先,SIRT6虽然参与细胞众多生命过程调控,并与多种疾病有关,但具体机制不清; 其次,基于其功能的重要性,SIRT6 本身的调控尤显重要。目前关于它本身的调控研究很少,将是未来研究的一大重点; 最后,SIRT6作为药物靶点,用于治疗相关疾病。目前已有实验室着手相关研究,如 Moaddel 实验室已发现槲皮黄酮和牡荆硷都可作为 SIRT6 的抑制剂,并找到了槲皮黄酮在 SIRT6 上结合位点的药效团模型,不过这些只是开始,后续研究尚待进行。
本文阐述了糖萼的结构、生理功能、影响因素及保护方面的相关研究进展。...
自上世纪60年代发现铁氧化还原蛋白(ferredoxin)以来,人类已发现了超过120种含铁硫簇的蛋白质和酶,即铁硫蛋白(iron-sulfurprotein)[1].铁硫簇(iron-sulfurcluster,ISC)是生物体内最古老的无机辅助因子之一,它作为蛋白质的活性基团,参与...
随着IL-34在常见疾病研究中不断展开,使得IL-34日益成为人们研究的热点,因此更加深入的探究IL-34在疾病中的功能和作用机制,将为多种疾病尤其是炎性疾病的治疗提供扎实的理论基础和新的靶点。...
血清HBsAg阳性是HBV现症感染的重要依据,HBsAg转阴及抗-HBs的出现一直被认为是HBV被清除和疾病临床痊愈的标志,但随着分子生物学技术的发展以及在HBV感染检测中的应用,发现部分HBV感染者血清HBsAg阴性,但血清和/或肝组织HBVDNA仍持续存...
外泌体(exosomes)是活细胞吞噬异源物质后以出芽方式向内凹陷形成含有多个小泡的多泡体(multivesicular body,MVB),再由多泡体与细胞膜融合而释放的小囊泡。...