摘 要: 植物表皮毛是植物表皮细胞形成的一种特殊毛状体,对植物自身起到保护与调节作用。目前植物表皮毛已在拟南芥(Arabidopsis thaliana)、番茄(Lycopersicon esculentum)、水稻(Oryza sativa)、烟草(Nicotiana tabacum)及青蒿(Artemisia carvifolia)等多种经济作物与药用植物中展开研究。拟南芥表皮毛细胞结构简单,目前对其研究最为深入和全面,为后续其它植物的研究提供了指导。自然界中,表皮毛是植物内部与外部环境间的一道天然屏障,主要通过物理防御和分泌化学物质提高植物对不良环境的抗性。当前对于表皮毛研究已从细胞层面发展到分子机制层面。该研究就植物表皮毛的类型、功能、生理生化特点、分子调控研究4个方面进行总结,为今后植物表皮毛的研究提供理论基础,同时为植物改良及育种提供指导。
关键词: 植物; 表皮毛; 发育机制; 分子调控;
Abstract: Plant trichome is a special trichomes form by plant epidermal cells.It protected and regulated plants themselves.At present,the research on the trichomes of plants was widely distributed in various economic crops and medicinal plants such as Arabidopsis thaliana,Lycopersicon esculentum,Oryza sativa,Nicotiana tabacum,and Artemisia carvifolia etc.Trichomes of Arabidopsis had a simple structure.Therefore,its research was the most in-depth and comprehensive,and it also provided guidance for the subsequent research of other plants.In nature,trichome was a natural barrier between the interior of the plant and the external environment,which enhanced plant resistance to adverse environments mainly through physical defense and secretion of chemicals.The current research on trichome had evolved from the cellular level to the molecular mechanism.This review summarized the four aspects of the type,function,physiological and biochemical characteristics and molecular regulation of plant trichomes,and provided a theoretical basis for the study of plant trichomes in the future,and provided guidance for plant improvement and breeding.
Keyword: plant; trichomes; develpment mechanism; molecular regulation;
植物表皮毛(trichome)是由植物表皮细胞发育形成的一种具有特殊结构的毛状附属物[1]。不同类型的表皮毛在植物生长过程中所发挥的作用不尽相同,对植物鉴定和分类有参考价值[2]。表皮毛提高了植物对不良环境、生物侵害和机械损伤的抗性。如表皮毛可自动调节植物体内水分和热量的散发与储存,应对温度骤变,阻挡紫外辐射,减少植物的被搜索率及昆虫在植物体上产卵与停留时间,同时在一定程度上增强了植物受损后的恢复能力等。另外,分泌型表皮毛可分泌出一些化学物质如酚类、萜类等,来抵挡生物及非生物胁迫,同时这些分泌物还可用于制药与工业原料,具有一定的经济价值[3,4]。植物表皮毛发育分子水平的研究,不仅有利于建立细胞分化的理论基础,而且对农业生产具有一定的指导意义[5]。当前对模式植物拟南芥表皮毛的起始、伸长、分支等过程的分子机理以及植物激素与不同基因协同调控表皮毛的发育方式与生长进程进行了深入研究[6],但非模式植物尤其是单子叶植物表皮毛发育过程的分子机理仍不明确。该文对植物表皮毛的类型、功能、生理生化特点进行了总结,就模式植物拟南芥表皮毛发育分子调控机理及非模式植物表皮毛发育研究动态进行阐述讨论,为今后植物表皮毛的研究提供理论基础。

1 、表皮毛的类型
植物表皮毛类型丰富,在不同环境,不同植物体上发挥着不同的作用。表皮毛通常可分为有腺毛状体和无腺毛状体[7]。一般由头细胞、柄细胞和基细胞组成,腺毛头细胞和柄细胞间细胞个数与排列方式不同,常见的有棒状、盾状、鳞片状、钩状、分枝和不分枝等,有腺毛状体大部分具有分泌功能,无腺毛状体的头细胞不具有分泌功能[8]。植物表皮毛大部分为多细胞毛状体,模式植物拟南芥表皮毛是最早开始研究的单细胞分支毛状体,同时多数植物集多种形状于一体。水稻存在长毛、微毛、腺毛3种表皮毛,长毛分布于维管束的硅质细胞上,微毛和腺毛则多分布在气孔与运动细胞上[9]。黄瓜(Cucumis sativus)包含6种非腺毛,其中4种以尖的顶端结束,另外2种存在于突变体中,没有尖的顶端,且其中一种有分支[10]。茄属(Solanum)植物腺毛的头细胞具有4个典型特征,第一种具有1~2个头细胞,第二种具有多个头细胞,第三种具有短小的茎及四角细胞的头细胞,最后一种具有极小的多细胞腺头位于一个短小的单细胞茎上[11]。自然界中,大约90%有毛植物毛状体具有一到多个细胞,剩余10%的物种具有多个分支的毛状体[12]。不同植物自身表皮毛的类型多种多样,在植物生长发育过程中发挥的功能也不尽相同,究其原因,这与植物在自然界长期的生活环境及生长方式密切相关。
2、 表皮毛的功能
表皮毛一定程度上增加了植物表皮的厚度,以此来抵挡外界生物与非生物的侵害[13]。腺毛的主要功能是产生与有害生物或传粉媒介相互作用的相关物质如挥发性油、树脂、萜类及酚类等化合物,导致它们因干燥、饥饿或中毒而死亡;另一方面,腺毛的次级代谢产物也具有一定的工业与药用价值并且还可以调节植物生长发育信号分子[14]。非腺毛虽没有分泌代谢功能,但它在抵抗极端环境、诱导传粉、防止紫外辐射、抵抗干旱、适应高盐、吸收重金属以及预防生物侵害和机械损伤等方面发挥着同等重要的作用。除此之外,植物表皮毛的密度、形状、生长环境因素及理化因素的不同,导致植物抗性的强弱不同[15]。烟草的腺毛可以排出烟草本身所含有的部分镉,减少对人体的伤害,同时这些代谢产物可以制作杀虫剂、精油、食品添加剂等[16]。张晋龙等[17]研究发现,绿叶多茸毛棉花纤维种皮的单宁含量明显高于绿叶少茸毛棉花纤维种皮上的含量,提高了植物对农业害虫及病毒的抗性。将三角瓢虫(Coelophora inaequalis)放在具有高密度表皮毛的番茄上,其繁殖能力及运动能力远远低于其在低密度表皮毛的番茄上[18]。拟南芥的表皮毛细胞壁从上到下逐渐变薄,当受到外界生物及非生物侵害时,基部较强的敏感性可迅速做出防御[19]。随着盐胁迫加重,荆芥(Nepeta cataria)表皮毛的干物质量和叶片两侧腺毛的总密度增加,来缓解盐胁迫的影响[20]。对非洲紫罗兰(Saintpaulia ionantha)进行低温胁迫,同等条件下无表皮毛的植物组织所含钙离子浓度高于有表皮毛的植物组织[21]。
3 、表皮毛的生理生化特点
当植物受到外界生物与非生物的胁迫时,通过改变叶绿素、还原性糖、矿质离子等的含量以及调整酶的活性,如超氧化物酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等来维持正常的生理运转[22]。表皮毛有无一定程度上影响上述各物质的含量与活性。柳蕾等[23]在水稻研究中表明有毛水稻的光合作用、呼吸作用、蒸腾速率及产量优于光水稻。刘鹏飞等[16]对2种表皮毛类型烟草进行等量的镉胁迫时,分泌型烟草叶表面的镉含量明显多于非分泌型烟草,且2种烟草在镉胁迫下腺毛密度均有增加。对拟南芥进行力学碰触,其细胞内钙离子浓度发生变化,pH、花青素及过氧化氢含量增加[24]。宋海慧[25]对4种品种的番茄同时进行干旱胁迫,番茄多毛品种的相对含水量和叶绿素含量均高于普通品种,叶绿体的超微结构损失程度低于普通品种;在抗病性测试中,其酶活性最终趋于稳定时,多毛番茄POD、SOD活性高于普通番茄。植物表皮毛的分泌过程与其细胞内各细胞器的生理活动及相互作用密不可分[26]。具有强代谢活性的表皮毛细胞中存在着多种细胞器,既保证了植物能量供给,又增强了对机械损伤和不良环境的抗性[27]。发育完全的烟草短腺毛具有大量线粒体,大细胞核,薄细胞壁,各种形状的质体和内质网,这些均是细胞具有强代谢活性的典型特征[28]。同时,这种特征也出现在向日葵(Helianthus annuus)、益母草(Leonurus artemisia)、薄荷(Mentha haplocalyx)等植物分泌期的腺毛细胞中[29,30]。在烟草、番茄分泌期腺毛的细胞质和液泡中存在大量的嗜锇颗粒及不规则物质,最终这些分泌物质均以胞吐的形式排出体外[25,31]。通过C14同位素追踪法在烟草长柄腺毛中发现叶绿体参与了分泌物的合成,但短柄腺毛中没有叶绿体,其分泌物的合成场所尚不明确[32]。睡茄(Withania kansuensis)的毛状体细胞中的质体参与了生物碱和酚类化合物的合成、积累和分泌过程[33]。唇形科(Labiatae)植物分泌后期,细胞核形状发生改变,并与内质网发生粘连,说明细胞核可能也参与了分泌物的合成[34]。腺毛是植物次级代谢产物生物合成和排泄的特定场所,但在表皮毛整个生命活动期间,各细胞器的功能和是否参与分泌物的合成与释放等方面还不清楚。
4、 表皮毛的分子调控研究
表皮毛的起始发育、生长阶段,发生位置及形态特点可作为研究细胞分化、命运决定和形态发生机制的模式材料。在植物器官发生时,表皮毛已经开始发育,其整个生长过程与植物体分化能力、激素水平和大量基因协同调控密切相关[6]。
4.1、 拟南芥表皮毛起始发育的分子调控机制
表皮毛的发生位置,大小和形状等特征受一系列基因调控,通常相邻的表皮细胞不会同时发育成毛状体。这是因为开始每个细胞均具有表皮毛促进因子和抑制因子,促进因子被激活同时相邻细胞表皮毛抑制因子也被激活,促进因子多的细胞最终形成表皮毛,同时传送抑制因子去相邻细胞,抑制其向表皮毛分化[35]。目前对拟南芥表皮毛发育的分子调控机制提出2种模型,第一种为激活抑制模型:表皮毛正向调控蛋白复合体MYB-BHLH-WD40激活R2R3MYB型负调控因子TRY(TRIPTYCHON)和CPC(CAPRICE)促使其向相邻细胞移动,代替MYB型正调控转录因子如GL1(GLABRA 1)/MYB23-GL3(GLA-BRA 3),最终形成无活性的复合体TRY/CPC-GL3/EGL3(ENHANCER OF GLABRA 3)-TTG1(TRANSPARENT TESTA GLABRA 1),并负向调控表皮毛的形成[36]。第二种为激活消耗模型:对表皮毛发育具有双重作用的WD40家族蛋白TTG1在细胞间自由移动,和BHLH型蛋白GL3/EGL3、MYB型蛋白GL1/MYB23结合形成GL1/MYB23-GL3/EGL3-TTG1复合体后对表皮毛起正向调控作用,而缺失的WD40型蛋白TTG1则发育成非表皮毛细胞[37](图1)。
图1 拟南芥表皮毛分子调控机制模型
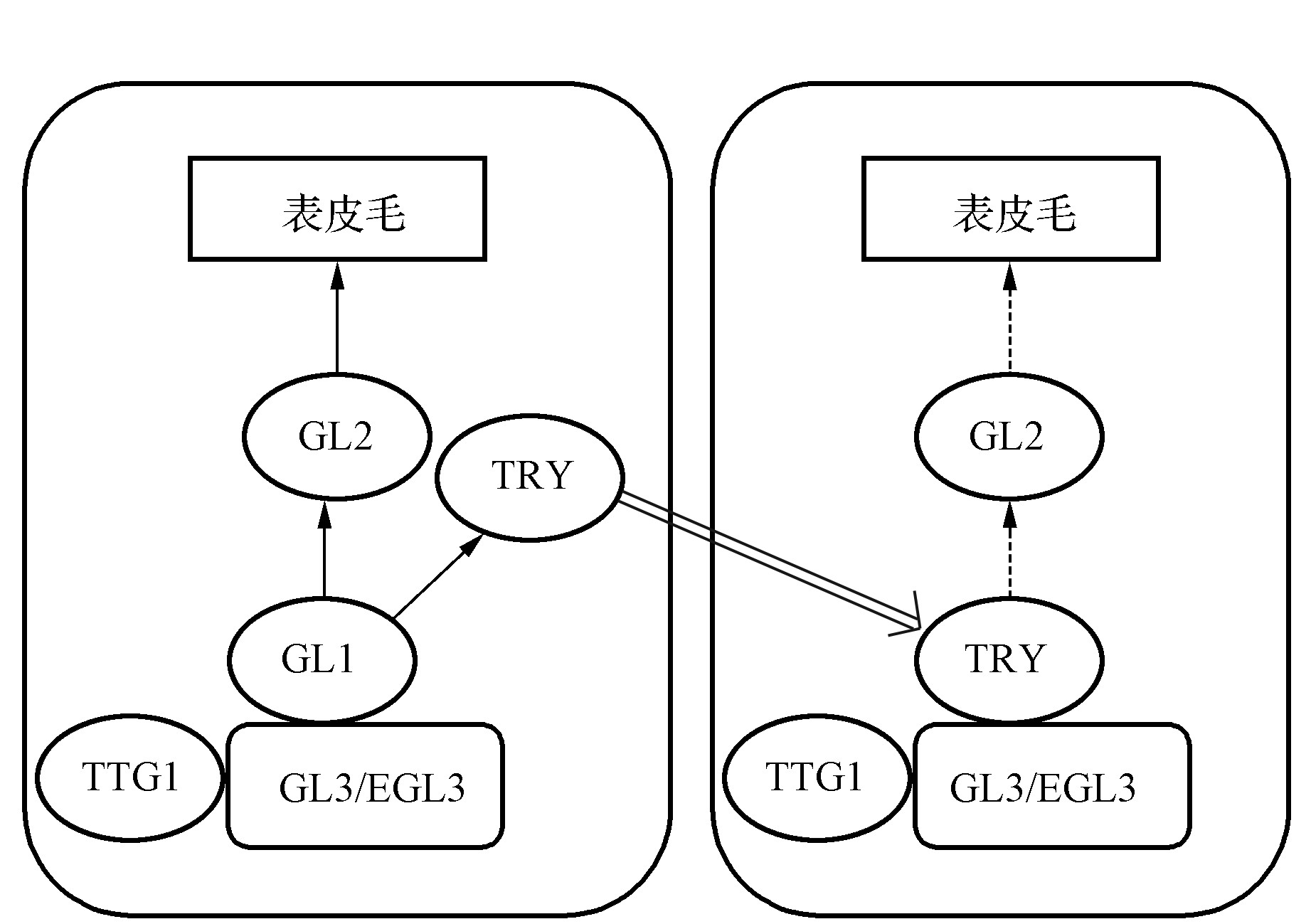
Fig.1 Model of molecular regulation of trichomes in Arabidops
注::正向调控;:蛋白质在细胞间的运动;:负向调控。
Note::Positive regulation;:Intercellular movement of protein;:Negative regulation.
4.2 、拟南芥表皮毛生长过程的分子调控
模式植物拟南芥表皮毛的整个发育过程主要包含3个时期:1)表皮毛初始发育,需上述正负调控因子共同作用来调控发生。其中单一GL3基因突变,拟南芥毛状体数量略有减少,当其与自身高度同源基因EGL3同时作用发生双突变时,出现功能冗余,产生完全无毛植株。野生型拟南芥GL2,CPC-TRY双突变体共同作用的植株中,表皮毛呈规则间隔分布,而CPC-TPY的双突变体植株中,表皮毛数量增多且呈簇状生长[38]。2)表皮毛核内DNA复制及分支调控,DNA含量越高,毛状体越大,分支数量越多,表皮毛的分支受微管的调控,微管的排列方向控制着表皮毛的生长方向与分支能力[5]。表皮毛核内DNA要经过4次复制才能形成分支结构,在此过程中,GL3和TRY分别是控制核内DNA复制的正负调控因子[39],SIM基因抑制表皮毛细胞从有丝分裂转向核内复制,进而抑制表皮毛分支的形成,拟南芥SIM突变体具有较少的分支毛状体[40]。此外,赤霉素(GA)的负调控因子SPY(SPINDLY)对表皮毛细胞核内DNA的复制也起到一定的抑制作用[41]。3)表皮毛的伸长调控,微丝是细胞伸长的基础,细胞发育早期微丝分散,成束状,后期逐渐聚集在一起,并沿细胞轴线伸长生长,直至细胞成熟[42]。
4.3 、植物激素对表皮毛发育的影响
表皮毛发育在植物器官发生时就已经开始,植物激素的生物合成途径和信号传导途径参与了表皮毛发育的各个阶段[43]。对黄瓜同时使用细胞分裂素(CK)和赤霉素(GA),发现腺毛的大小无变化,随着激素浓度增加,表皮毛数量增多[11]。不同浓度的茉莉酸甲酯(MeJA)、GA和生长素(IAA)处理番茄后,其内源相同激素含量发生变化,其中2种腺毛密度大幅增加[44]。夏小丛[45]对棉花胚珠进行不同激素处理,发现JA和GA3均能促进纤维细胞起始分化,并且二者具有协同促进作用。将0.1 mmol·L-1和1.0 mmol·L-1的水杨酸(SA)分别应用于拟南芥的2个野生型株系,表皮毛密度均减少,证明SA对表皮毛的发育具有抑制作用[46]。分子层面上,对拟南芥叶肉细胞研究发现,TEM(TEMPRANILLO)转录因子减少细胞中GA的积累和转运蛋白的表达。在TEM的调控下,叶肉细胞选择性的向周边细胞传送GA,进而影响表皮细胞的发育模式[37]。JA可调节棉纤维的发生与伸长,GhJAZ2蛋白能与GhMYB25-like和GhMYC2等转录因子相互作用并抑制其活性,导致棉花种子中纤维减少[47]。将色氨酸单加氧酶基因(IAAM)与拟南芥表皮毛特异表达GL2基因启动子重组后转至拟南芥及烟草中,拟南芥与烟草的表皮毛密度均显着增长,证明了GL2表达水平受IAA的影响[48]。以上研究说明,表皮毛的发育方式与生长进程受植物激素与不同基因以及不同激素间的协同调控,其中大部分促进植物生长类激素的外源加入在一定浓度范围内增加了表皮毛的密度及长度(图2)。
图2 植物激素对表皮毛形成的分子调控模式
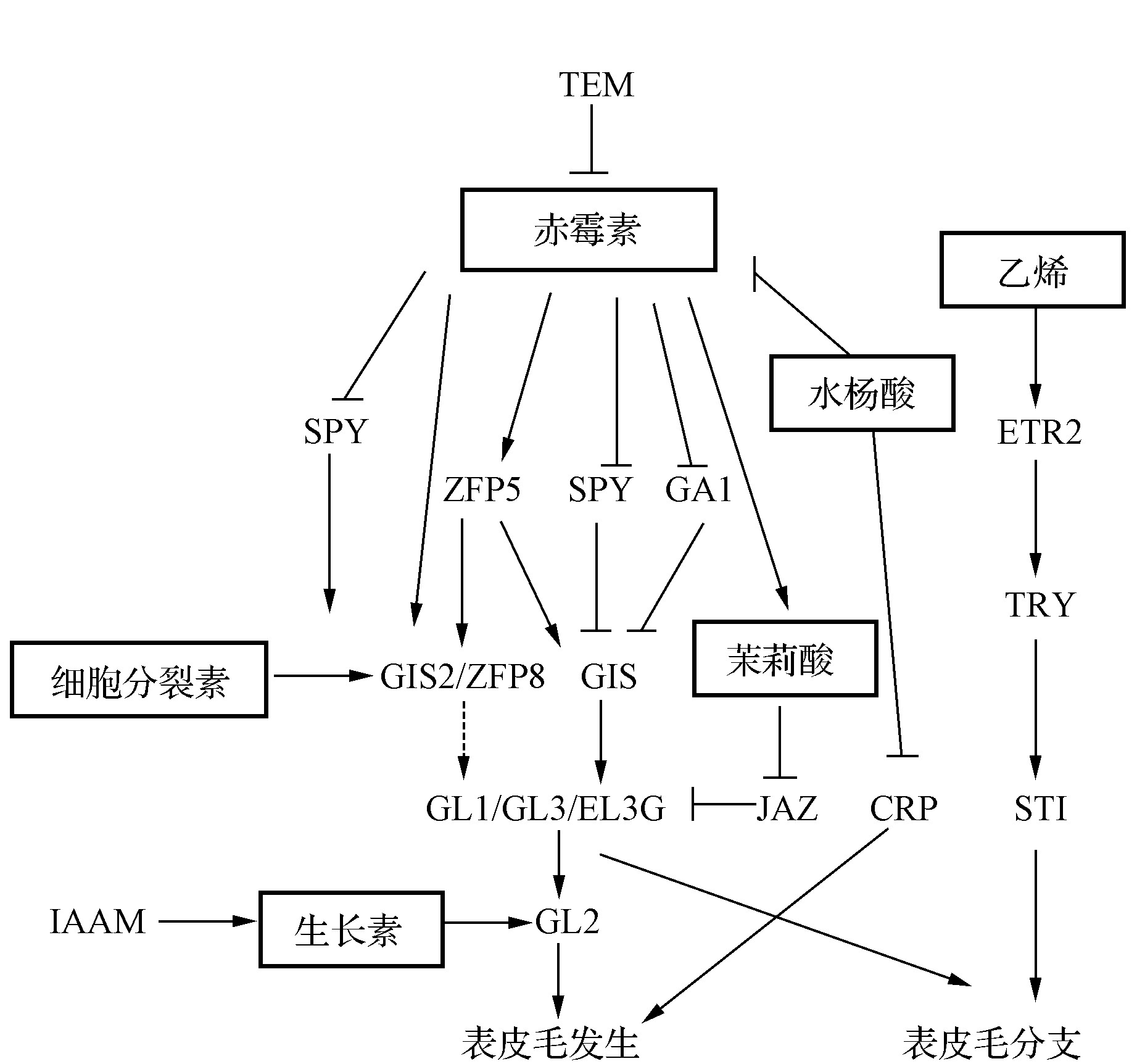
Fig.2 Molecular regulation patterns of plant hormones on trichome formation
注::上调或促进;:下调或抑制;:抑制发生。
Note::Up or promote;:Down or inhibit;:Inhibition occurs.
4.4 、非模式植物表皮毛分子研究进展
当前对表皮毛的分化过程及分子调控机制研究多建立在拟南芥单细胞表皮毛研究基础上,而其与由多细胞构成的植物表皮毛二者的形成机制虽有相同之处,但后者更为复杂。调控不同类型表皮毛发育的关键基因不同,同一基因在不同植物表皮毛发育过程中的作用也存在差异[49]。研究表明,将金鱼草(Antirrhinum majus)的R2R3类型转录因子的调控基因MIXTA和MIXTA LIKE1转入烟草中,烟草叶片和茎上的表皮毛数量大幅增加,而其在拟南芥突变体中过表达并没有引起类似变化[50]。棉花胚珠基因CotMYB和MIXTA具有一定同源性,其在拟南芥中过表达不改变拟南芥的表型,但增加烟草表皮毛数量,而棉花TRY抑制烟草叶片表皮毛的发育但对拟南芥无影响[51]。拟南芥表皮毛抑制因子CPC对番茄表皮毛性状无影响,而番茄TRY的同源基因SLTRY,促进番茄的地上表皮毛发育,转入拟南芥后,却抑制拟南芥地上表皮毛的分化,促进地下根毛生长[52]。
目前,对非模式植物表皮毛发育的分子机制的研究仍相对落后,但对水稻(Oryza sativa)、黄瓜(Cucumis sativus)、番茄(Lycopersicon esculentum)、棉花(Gossypium hirsutum)、黄花蒿(Artemisia annua)等经济作物和药用植物已开展相关分子机制研究。如WO(WOLLY)基因影响番茄表皮毛的发育,SIMYC1和SIEOT1基因控制番茄表皮毛萜类物质的合成[53]。黄瓜中的CSGL1基因抑制叶片、花、果实上毛状体的形成,但对根毛的形成无明显影响[54]。Mhl1基因使玉米表皮形成巨毛,当其发生突变会直接导致玉米中巨毛的形成[55]。HL6与OsWOX3B基因协同调控水稻表皮毛的形成与伸长,HL1(HAIRY LEAF-1)和HL2(HAIRY LEAF-2)基因影响其花絮分支的表皮毛长度,HG(HAIRY GLUME)基因影响叶片边缘小穗枝的表皮毛长度[51]。黄花蒿腺毛分泌物合成受到ADH2基因编码的一种醇脱氢酶调控,影响单萜酮的生物合成[55]。但当前对这些基因的分子机理仍了解甚少。
5、 结论与展望
植物表皮毛作为植物与外界接触的第一层屏障,形状各异,且具有多种功能,对植物的正常生长与生理活动起着重要的调节作用,表皮毛提高了植物自身的抗性,使其在对抗干旱、冷害、虫害及病害等方面优于其它无表皮毛的植物,一定程度上减轻了农药使用对环境造成的污染,节约了水资源。同时表皮毛对紫外辐射,重金属盐,机械损伤等有强适应力与吸收力,为土壤改良,沙地绿化提供了备选植物。具有分泌功能的腺毛分泌物除自身防护功能外,代谢产物也可作为优良的化学材料和药用材料。分子层面上,虽有证据表明双子叶植物具有相似的控制表皮毛形成机制,但单细胞与多细胞植物表皮毛发育机制存在差异,尤其在单子叶植物中,表皮毛的分子作用机制仍不是很清楚。对多种植物的表皮毛研究也表明,同一个基因在不同种植物中的表达方式各不相同,植物最终的表型也不尽相同。当前对植物表皮毛的分子调控研究多集中在模式植物拟南芥上,非模式植物的表皮毛调控方式还不清楚。该文对植物表皮毛的类型、功能、生理生化特点及分子调控机制进行了总结归纳,以期为今后植物表皮毛方面的研究及育种工作提供参考依据。
参考文献
[1]BALKUNDE R,PESCH M,HLSKAMP M.Trichome patterning in Arabidopsis thaliana from genetic to molecular models[J].Current Topics in Developmental Biology,2010,91(91):299-321.
[2]ATTALA Z,CELEP F,BARA F,et al.Systematic significance of anatomy and trichome morphology in Lamium (Lamioideae;Lamiaceae)[J].Flora,2016,225:60-75.
[3]YAN A,PAN J B,AN L Z,et al.The responses of trichome mutants to enhanced ultraviolet-B radiation in Arabidopsis thaliana[J].Journal of Photochemistry and Photobiology B:Biology,2012,113(1):29-35.
[4]ANDRADE M C,SILVA A A D,NEIVA I P,et al.Inheritance of type IV glandular trichome density and its association with whitefly resistance from Solanum galapagense accession LA1401[J].Euphytica,2017,213(2):52.
[5]SCHULMAN S,HLSKAMP M.Epidermal differentiation:Trichomes in Arabidopsis as a model system[J].International Journal of Developmental Biology,2005,49(5-6):579-584.
[6]KHOSLA A,PAPER J M,BOEHLER A P,et al.HD-Zip proteins GL2 and HDG11 have redundant functions in Arabidopsis trichomes,and GL2 activates a positive feedback loop via MYB23[J].Plant Cell,2014,26(5):2184-2200.
[7]陈文婷,李慧灵,肖强,等.木芙蓉不同时期花的结构变化研究[J].北方园艺,2016(7):50-54.
[8]王国平,周东洁,牛永志,等.不同烟草种质腺毛密度鉴定分析[J].中国烟草科学,2018,39(4):7-17.
[9]WANG Y P,CHEN W L,QIN P,et al.Characterization and fine mapping of GLABROUS RICE 2in rice[J].Journal of Genetics&Genomics,2013,40(11):579-582.
[10]XUE S D,DONG M M,LIU X W,et al.Classification of fruit trichomes in cucumber and effects of plant hormones on type II fruit trichome development[J].Planta,2019,249(2),407-416.
[11]KANG J H,FENG S,JONES A D,et al.Distortion of trichome morphology by the hairless mutation of tomato affects leaf surface chemistry[J].Journal of Experimental Botany,2010,61(4):1053-1064.
[12]NOGUEIRA A,OTTRA J H,GUIMARAES E,et al.Trichome structure and evolution in Neotropical lianas[J].Annals of Botany,2013,112:1331-1350.
[13]拓广辉,唐楠,唐道城.青海东南部主要绿绒蒿资源分布区的土壤及伴生植物[J].青海大学学报,2017,35(4):50-55.
[14]RIDDICK E W,SIMMONS A M.Do plant trichomes cause more harm than good to predatory insects[J].Pest Management Science,2015,70(11):1655-1665.
[15]RIDDICK E W,SIMMONS A M.Plant trichomes have mixed impacts on predatory insects[J].Pest Management Sciene,2015,70(11):1668.
[16]刘朋飞,闫筱筱,杨欣玲,等.分泌型和非分泌型烟草叶面腺毛对镉胁迫的应答反应研究[J].中国农业科技导报,2019,21(6):55-60.
[17]张晋龙,刘义,渠云芳,等.棉花不同茸毛性状近等基因系的选育与生理生化特性研究[J].华北农学报,2017,32(3):137-142.
[18]HEINZ K M,ZALOM F G.Performance of the predator Delphastus pusillus on Bemisiaresistant and susceptible tomato lines[J].Entomologia Experimentalis Et Applicata,2012,81(3):345-352.
[19]LIU H,ZHOU L H,JIAO J,et al.Gradient mechanical properties facilitate Arabidopsis trichome as mechanosensor[J].Acs Applied Materials&Interfaces,2016,8(15):9755-9761.
[20]ZHOU Y,TANG N Y,HUANG L J,et al.Effects of salt stress on plant growth,antioxidant capacity,glandular trichome density,and volatile exudates of Schizonepeta tenuifolia briq[J].International Journal of Molecular Sciences,2019,19(1):252.
[21]SALTVEIT M.E,HEPLER P K.Effect of heat shock on the chilling sensitivity of trichomes and petioles of African violet(Saintpaulia ionantha)[J].Physiologia Plantarum,2010,121(1):35-43.
[22]陈明辉,陈世平,张志录,等.不同品种果蔗幼苗对低温的生理响应及耐寒性评价[J].华南农业大学学报,2018,39(2):40-46.
[23]柳蕾,孙健,吴殿星,等.水稻光叶性状及表皮毛发育研究进展[J].核农学报,2015,29(11):2110-2116.
[24]高文强,曹志艳,董金皋,等.植物的力敏感探测器表皮毛:力学刺激表皮毛诱发的防御反应[C].南京:中国植物病理学会2016年学术年会,2016.
[25]宋海慧.番茄表皮毛特征及其在抗胁迫中的功能研究[D].哈尔滨:东北农业大学,2017.
[26]STRATMANN J W,BEQUETTE C J.Hairless but no longer clueless:Understanding glandular trichome development[J].Journal of Experimental Botany,2016,67(18):5285-5287.
[27]董阳阳.氟处理对茶树叶片光合系统、活性氧代谢及超微结构的影响[D].合肥:安徽农业大学,2015.
[28]UZELAC B,JANOEVIC'D,STOJICIC'D,et al.Morphogenesis and developmental ultrastructure of Nicotiana tabacum short glandular trichomes[J].Microscopy Research&Technique,2017,80(7):779-786.
[29]TURNER G W,GERSHENZON J,CROTEAU R B.Development of peltate glandular trichomes of peppermint[J].Plant Physiology,2000,124(2):665-679.
[30]AMEREN E,HELLER A,SPRING O.Capitate glandular trichomes of Helianthus annuus(Asteraceae):Ultrastructure and cytological development[J].Protoplasma,2014,251(1):161-167.
[31]张华.烟草腺毛形态、结构及基因表达谱研究[D].郑州:河南农业大学,2008.
[32]KEENE C K,WAGNER G J.Direct demonstration of duvatrienediol biosynthesis in glandular heads of tobacco trichomes[J].Plant Physiology,1985,79(4):1026-1032.
[33]MUNIEN P,NAIDOO Y,NAIDOO G,et al.Micromorphology,histochemistry and ultrastructure of the foliar trichomes of Withania somnifera (L.)Dunal(Solanaceae)[J].Planta,2015,242(5):1107-1122.
[34]于丽杰,艾燕.唇形科植物腺毛发育及腺毛分泌功能的研究进展[J].北方园艺,2012(10):194-196.
[35]MOOSE S P,NICK L,CARLSON S R.The maize macrohairless1locus specifically promotes leaf blade macrohair initiation and responds to factors regulating leaf identity[J].Genetics,2004,166(3):1451.
[36]YANG C X,YE Z B.Trichomes as models for studying plant cell differentiation[J].Cellular&Molecular Life Sciences,2012,70(11):1937-1948.
[37]REINHARDT H,GIERER A.Applications of a theory of biological pattern formation based on lateral inhibition[J].Journal of Cell Science,1974,15(2):321-346.
[38]ZHANG F,GONZALEZ A M,PAYNE C T,et al.A network of redundant bHLH proteins functions in all TTG1-dependent pathways of Arabidopsis[J].Development,2003,130:4859-4869.
[39]王红霞,丁谦,李景娟,等.植物表皮毛发育分子调控研究进展[J].植物生理学报,2019(6):711-717.
[40]GREBE M.The patterning of epidermal hairs in Arabidopsis--updated[J].Current Opinion in Plant Biology,2012,15(1):31-37.
[41]LI J A,ZHONG J Z,SHA S,et al.GLABROUS INFLO-RESCENCE STEMS (GIS)is required for trichome branching through gibberellic acid signaling in Arabidopsis[J].Plant&Cell Physiology,2012,53(2):457-469.
[42]SUO B X,SEIFERT S,KIRIK V.Arabidopsis GLASSYHAIR genes promote trichome development[J].Journal of Experimental Botany,2013,64(16):4981-4991.
[43]PATTANAIK S,PATRA B,SINGH S K,et al.An overview of the gene regulatory network controlling trichome development in the model plant,Arabidopsis[J].Frontiers in Plant Science,2014,5(5):259.
[44]刘金秋,陈凯,张珍珠,等.外施GA、Me、JA、IAA、SA和KT对番茄表皮毛发生的作用[J].园艺学报,2016,43(11):2151-2160.
[45] 夏小丛.棉花(Gossypium hirsutum)GhJAZ3和GhGAI1在JA和GA介导的转基因拟南芥表皮毛分化和伸长中的功能研究[D].武汉:华中师范大学,2016.
[46]TRAN M B,BERGELSON N.Interactive effects of jasmonic acid,salicylic acid,and gibberellin on induction of in Arabidopsis[J].Plant Physiology,2003,133(3):1367-1375.
[47]HU H Y,HE X,TU L L,et al.GhJAZ2 negatively regulates cotton fiber initiation by interacting with the R2R3-MYBtranscription factor GhMYB25-like[J].Plant Journal,2016,88(6):921-935.
[48]谢德雄,潘嘉立,赵燕,等.烟草和拟南芥表皮毛中特异表达iaaM后的遗传效应[J].湖南农业大学学报,2018,246(3):59-64.
[49]ZHANG X L,YAN F,TANG Y W,et al.Auxin response gene SlARF3 plays multiple roles in tomato development and is involved in the formation of epidermal cells and trichomes[J].Plant&Cell Physiology,2015,56(11):2110.
[50]MARIA P R,JAFFE F W,EUGENIO B,et al.Development of three different cell types is associated with the activity of a specific MYB transcription factor in the ventral petal of Antirrhinum majus flowers[J].Development,2005,132(2):359-370.
[51]WU X,LI Y E,SHANGGUAN X X.Progress in studies on transcription factors related to cotton fiber development[J].Cotton Science,2013,25(3):269-277.
[52]RUMI T W,YUKA N,SHUSEI S,et al.Control of plant trichome and root-hair development by a tomato(Solanum lycopersicum)R3 MYB transcription factor[J].PloS One,2013,8(1):e54019.
[53]SPYROPOULOU E A,HARING M A,SCHUURINK RC.RNA sequencing on Solanum lycopersicumtrichomes identifies transcription factors that activate terpene synthase promoters[J].BMC Genomics,2014,15(1):402.
[54]LI Q,CAO C J,ZHANG C J,et al.The identification of Cucumis sativus Glabrous 1 (CsGL1)required for the formation of trichomes uncovers a novel function for the homeodomain-leucine zipper 1gene[J].Journal of Experimental Botany,2015,66(9):2515-2526.
[55]POLICHUK D R,ZHANG Y,REED D W,et al.A glandular trichome-specific monoterpene alcohol dehydrogenase from Artemisia annua[J].Phytochemistry,2010,71(11-12):1264-1269.
花是植物最重要的经济器官,花期、花型及花序的分枝等重要性状都是花发育的外在表现.花发育的研究也是分子生物学和发育生物学研究中最活跃的领域。植物生理学的研究表明,成年植物经过一定的营养生长阶段,便由营养型分生组织进入感受态.此时如遇适宜的外界...
太阳光中波长为100~400 nm的电磁辐射称为紫外线(UV)。根据纳米波长可以将其分为三类:长波紫外线(UV-A),波长范围400~320 nm;中波紫外线(UV-B),波长范围320~280 nm;短波紫外线(UV-C),波长范围280~180 nm。...
茉莉素这一类植物激素主要包括茉莉酸、茉莉酸甲酯、茉莉酸异亮氨酸、12-氧-植物二烯酸等环戊酮的衍生物。早在1962年,茉莉酸甲酯作为一种香料从素馨花中分离出来。至今,经过70多年的研究,人们逐渐认识了茉莉素的生物学功能、合成途径及其信号传导途径。...
花是植物形态结构中最复杂的器官之一,也使得被子植物或开花植物具有与其他陆生植物明显不同的特征(Alvarez-Buylla等2010);水稻等农作物花器官的发育还为人类提供了主要的粮食来源,1种学的热点研究领域之一。水稻花原基由小穗分生组织发育而来,小穗...
目前,基于大量的研究发现,导致花粉败育主要与线粒体的呼吸作用异常、膜脂过氧化、物质代谢紊乱和小RNA功能异常等有着密切的关联。...
褪黑素在植物体中具有多重生理功能,主要通过对植物抗氧化酶活性的升高,降低活性氧和过氧化物含量,清除活性氧自由基等来减轻氧化损伤,提高植物的抗逆性。...
气孔发育是一个用于研究激素调控机理的良好平台,气孔发育的基本过程源于原表皮特定细胞选择进入气孔发育途径成为拟分生组织母细胞(mothercellofmeristemoid,MCM),这类细胞经过不等分裂,产生小的拟分生组织细胞(meristemoidcell,M...
蹄盖蕨科(Athyriaceae)为中小型、少数为大型土生蕨类植物,约有20属500种,广布全世界热带至寒温带各地,尤以热带与亚热带山地为多。我国各属均产,约400种。蕨类植物孢子萌发和配子体发育的特性可以为分类学和种的研究提供有效的依据。近年来,对蹄...
花是被子植物特有的在繁殖过程中产生的生殖器官,是植物组织中最为复杂的结构,也是被子植物区别于其他陆生植物的重要特征。开花是高等植物个体发育的中心环节,也是植物从营养生长转向生殖生长,繁衍后代的关键步骤。以双子叶植物拟南芥为例,在营养生长时...
引言根系是植物长期适应陆地条件而形成的重要器官,在植物生长发育过程中发挥着固定植株、吸收水肥、合成运输有机无机物质等众多功能[1-4],间接地调控着地上部诸多重要器官如茎、叶、花、果实等生长发育进程[5-6].因此,研究植物根系生长发育的调控机理对于...