早在上世纪 60、70 年代,人们从野豌豆族的植物中发现并分离出了一系列含有杂环的非蛋白游离氨基酸。这类氨基酸大多为丙氨酸 β 位杂环取代的衍生物,不少可以通过根分泌进入根际土壤,影响根际微生物。后来在西瓜、葱等植物中也发现了不少类似的氨基酸衍生物。对这类氨基酸的全面研究不但可以深入了解植物氮代谢的调节,而且有助于人们更全面的掌握植物次生代谢与环境的关系,为进一步利用这类次生代谢物奠定基础。下面对含羞草氨酸、使君子氨酸、黧豆素、西瓜子氨酸等9 种丙氨酸衍生的非蛋白氨基酸的种属分布、生物合成及生理活性研究作综述,并对进一步研究作简单讨论。
1 种类及分布
在植物中,除了组成蛋白质的 20 种常见氨基酸( 常称为蛋白氨基酸,protein amino acids) 外,还存在大量的、游离的非蛋白氨基酸( non-protein aminoacids,NPAAs) 。NPAAs 没有相应的三联体密码子和转运 tRNA,一般不会参与蛋白质合成。至今发现自然界存在的 NPAAs 不下 900 种,其中大部分分布在植物中,豆类植物中尤其丰富。在这些游离氨基酸中,有一部分是由丙氨酸 β 位碳的氢被其它基团取代形成的衍生物,如植物中广泛分布的β-腈基丙氨酸是细胞在解除氰( HCN) 毒后形成的产物。丙氨酸 β 位由含氮杂环取代的衍生物( 表 1)主要分布在豆科野豌豆族植物中。
1. 1 β-( 异恶唑-5-酮-2-基) -丙氨酸
β-( 异恶唑-5-酮-2-基) -丙氨酸 ( β-( isoxazoline-5-on-2-yl) -L-alanine,BIA) 是一种由异恶唑-5-酮环取代丙氨酸 β 位的 H 原子而形成的一种游离氨基酸( 表 1) 。至今发现的天然恶唑环类仅存于野豌豆族植物中。在该族的豌豆幼苗中,人们发现近十种异恶唑类氨基酸衍生物,其中 BIA 的含量最高。后来在该族山黧豆属的许多种类中也检测到 BIA的存在,并与山黧豆毒素的合成有关。BIA 在这些豆类萌发的幼苗中逐渐积累,3 ~ 10 d 幼苗地上部分的含量最高。幼苗的根,甚至老根也可合成并向根际分泌 BIA。但所有这些豆类的成熟种子和叶子中至今未检测到 BIA 的存在。
1. 2 黧豆素
黧豆素( lathyrine) ,即 β-( 2-氨基嘧啶-4-基) -丙氨酸[β-( 2-aminopyrimidin-4-yl) -L-alanine],也称香豌豆碱或旦尼尔山黧豆素( tingitanine) ,是山黧豆属12 种植物种子和兵豆属至少 3 个种种子的主要游离氨基酸,其中在旦尼尔山黧豆中含量最高。与 BIA 不同,黧豆素几乎存在于这些豆类的所有器官中,如茎、叶、果荚及未成熟的种子等。该氨基酸由氨基嘧啶环取代丙氨酸 β 位的 H 原子而形成( 表 1) 。
1. 3 含羞草氨酸
含羞草氨酸( L-minosine) 为 β-[N-( 3-羟-4-吡啶酮) ]-L-丙氨酸{ β-[N-( 3-hydroxy-4-pyridone) ]- L-alanine} ,是 NPAAs 中研究比较多的一种氨基酸( 表1) 。早在 1897 年,由于动物食用银合欢( Leucaenaglauca) 的种子和叶子引起脱毛而发现。它主要存在于含羞草属和银合欢属一些种类的种子中。在银合欢( Leucaena leucocephala) 的干种子中,该氨基酸可达 12. 5%,幼叶中的含量( 5. 1%) 一般是成熟叶中的( 2. 57%) 2 倍。在萌发的幼苗中,地上部分的芽中含量最高,合成积累受光损伤等的诱导。
1. 4 使君子氨酸
使君子氨酸 β-( 3,5-dioxo-2,4-oxadiazolin-2-yl或 L-quisqualic acid,QA) 是恶二唑类丙氨酸衍生物( 表 1) ,存在于使君子( Quisqualis indica L. ) 种子中。最近发现 QA 还存在于一些天竺葵植物( 如马蹄纹天竺葵) 的种子、叶、根及花梗组织中。
1. 5 西瓜子氨酸
人们在许多葫芦科植物种子中分离出一种吡唑类的丙氨酸衍生物———β-( 吡唑-1-基) -丙氨酸( β-( pyrazol-1-yl) -L-alanine,BPA,又称西瓜子氨酸)( 表 1) 。BPA 其实是组氨酸的同分异构体,在西瓜种子中含量比较高,可占到干种子的 0. 1%。它既可游离存在,也可以多种衍生物的形式存在。
1. 6 尿嘧啶丙氨酸和异尿嘧啶丙氨酸
尿嘧啶丙氨酸,即 β-( 尿嘧啶-1-基) -丙氨酸[β-( uracil-1-yl) -L-alanine 或 L-willardiine],首先从一种金合欢( Acacia willardiine) 种子中分离得到,并以这种金合欢的种名作为该特殊氨基酸的名称。后来在金合欢属的其它种类、含羞草属的一些种类和豌豆幼苗中也发现这种尿嘧啶丙氨酸衍生物( 表 1) 。异尿嘧啶丙氨酸,即 β-( 尿嘧啶-3-基) -丙氨酸[β-( uracil-3-yl) -L-alanine 或 L-isowillardiine],是后来从豌豆幼苗中分离到的。异尿嘧啶丙氨酸的分布似乎仅限于豌豆幼苗中。
1. 7 β-( 1,2,4-三唑-1-基) -丙氨酸和β-( 3-氨基-1,2,4-三唑-1-基) -丙氨酸
β-( 1,2,4-三唑-1-基) -丙氨酸[β-( 1,2,4-triazol-1-yl) -L-alanine,BTA]和 β-( 3-氨基-1,2,4-三唑-1-基) -丙氨酸[β-( 3-amino-1,2,4-triazol-1-yl) -L-ala-nine,BATA]分别是土壤中施用的抗真菌剂 1,2,4-三唑( 三唑) 类和 3-氨基-1,2,4-三唑( 氨基三唑) 类在植物体内的代谢产物( 表 1) 。
2 生物合成及相关代谢
植物次生代谢产物一般由初级代谢的中间物转变而来。通过喂饲同位素标记的可能前体物及相关的酶学研究,发现上述几种丙氨酸杂环取代衍生物的生物合成大多与植物半胱氨酸合成酶的催化有关,其中丙氨酸残基要么来源于丝氨酸,要么来源于 O-乙酰丝氨酸,但杂环来源多样。
2. 1 BIA 的生物合成及相关代谢
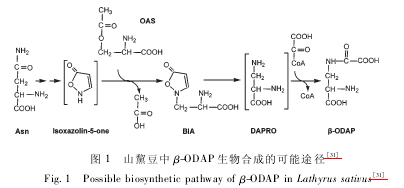
由于 BIA 被证明是山黧豆毒素 β-ODAP 的生物合成前体。所以对于它的合成人们进行了较为详细的研究。体外实验表明,BIA 由异恶唑-5-酮和O-乙酰丝氨酸在半胱氨酸合成酶催化下合成。异恶唑-5-酮推测来源于天冬酰胺。植物半胱氨酸合成酶( cys synthase,CSase) 是由多个同工酶组成的小家族,与 β-腈基丙氨酸合成酶( β-cyanoala-nine synthase,CAS ) 一并属于依赖于磷酸吡哆醛( pyridoxal-5'-phosphate,PLP) 的 β 位取代丙氨酸合成酶 ( β-substituted alanine synthase,Bsas) 超 家族。Ikegami 等从山黧豆中分离出的两种CSase 同工酶 A 和 B 均可合成 BIA,A 酶定位于线粒体,而 B 定位于叶绿体。两酶合成 BIA 的效率非常低,分别是半胱氨酸合成效率的 0. 07% 和 0.08% 。最近的证据表明 BIA 可能由同一家族的 CAS来催化合成。BIA 在其开环酶的作用下可形成α,β-二氨基丙酸 ( α,β-diaminopropionic acid,DA-PRO),后者经草酰-CoA 草酰化后形成山黧豆毒素 ( β-N-oxalyl-L-α,β-diaminopropionic acid,β-ODAP)( 图 1) 。
在山黧豆中,BIA 可进一步代谢为 β-ODAP,但在豌豆等植物中 BIA 并不进一步转化,在幼苗中可积累到比较高的浓度,并可以从根部分泌到根际。
2. 2 黧豆素的生物合成
同位素标记及体外酶学实验表明,黧豆素由丝氨酸与2-氨基-4-羧基嘧啶( 2-amino-4-carboxypyrimi-dine) 直接合成。与其它杂环取代丙氨酸合成不同,黧豆素的丙氨酸部分直接来自丝氨酸而非 O-乙酰丝氨酸。合成酶虽不是半胱氨酸合成酶,但也需要磷酸吡哆醛作为辅基,生物素的存在也能加强催化效率。该合成酶表现为罕见的双最佳 pH 值( 4. 5 和 7. 2) 的催化特征。2-氨基-4-羧基嘧啶由尿嘧啶先羧化再氨基化形成,合成时该嘧啶环 4 位的脱羧和丙氨酸化同时进行。人们对黧豆素的进一步代谢或分解还知之甚少。
2. 3 含羞草氨酸等的生物合成及分解
含羞草氨酸、使君子氨酸、西瓜子氨酸、BTA 以及 BATA 均由半胱氨酸合成酶催化合成。与合成半胱氨酸相同,这几种氨基酸的丙氨酸部分也均来自 O-乙酰丝氨酸。含羞草氨酸的杂环部分来源于 3,4-二羟吡啶( 3,4-dihydroxypyridine) ,而后者由赖氨酸环化产生。含羞草氨酸在植物体内分解 产 生 3-羟-4-吡 啶 酮 ( 3-hydroxy-4-( 1H ) -pyri-done) 、丙酮酸和氨( 图 2) 。
使君子幼苗的酶粗提液以 3,5-二氧-2,4-恶二唑( 3,5-dioxo-2,4-oxadiazolin) 和 O-乙酰丝氨酸为底物时可形成使君子氨酸( QA) 。酶粗提液纯化后得两个分子量均为 58KD 同工酶 A 和 B,进一步研究表明它们是半胱氨酸合成酶同工酶。两酶均由分子量相同的双亚基构成。但同工酶 A 不能合成 QA,只有同工 B 才能合成 QA。豌豆幼苗的酶抽提液也能催化合成 QA。这说明同一植物中半胱氨酸合成酶不同形式的同工酶功能不同,然而不同植物中的不同同工酶却有相同的催化功能。
许多葫芦科植物中的西瓜子氨酸合成由亚精胺开始。亚精胺( Spermidine) 形成 1,3-二氨基丙酸( 1,3-diminopropane) ,经过一系列步骤,环化形成吡唑( pyrazole) 。吡唑在半胱氨酸合成酶的催化下,接受 O-乙酰丝氨酸的丙氨酸部分产生西瓜子氨酸。在西瓜的幼苗中,也分离出了两个分子量( 58KD) 相同的半胱氨酸合成酶同工酶。催化的最佳 pH 值均为 8. 0。在体外,这两个同工酶能合成西瓜子氨酸及半胱氨酸,但不能合成含羞草氨酸、使君子氨酸、尿嘧啶氨酸及异尿嘧啶氨酸。BTA 和 BATA 是施于土壤中的三唑类真菌杀毒剂( 如腈菌唑———myclobutanil) 降解的产物 1,2,4-三唑( 1,2,4-triazol-1) 和 3-氨基-1,2,4-三唑( 3-ami-no-1,2,4-triazol) 分别被植物吸收后代谢转化而来。可以认为是植物解除唑类毒性的一种有效方式。从许多植物中分离纯化的半胱氨酸合成酶可催化形成BTA 和 BATA。
2. 4 尿嘧啶丙氨酸和异尿嘧啶丙氨酸的生物合成
尿嘧啶丙氨酸和异尿嘧啶丙氨酸的合成均以尿嘧啶环和 OAS 为底物,而且两者的合成酶有许多相似性,如最适 pH 值相近,维生素 PLP 可促进两者的酶活性等,但研究表明它们是两种不同性质的酶。虽然两种酶的性质与半胱氨酸合成酶的很相近,却不是半胱氨酸合成酶家族的成员,其它植物的粗酶抽提液不能催化形成这两种氨基酸,也就是说,只有产生这两种氨基酸的植物如金合欢、豌豆等来源的酶抽提物才有体外合成这两种氨基酸的催化功能。
3 生理活性
植物非蛋白游离氨基酸代谢方面的一个显着特点是在特定时期、特定器官中暂时积累。因而一方面在代谢尤其是氮代谢中有独特的作用,另一方面由于对外界生物特定组织、细胞等有显着生理效应,从而显示出对植物生存有利的进化优势。以上讨论的这组杂环取代氨基酸大多数对动物有神经毒或对植物及微生物的生长有抑制作用。由此普遍认为它们在防御或营养竞争等方面具有重要的生态学意义。
3. 1 BIA
在山黧豆中,BIA 可进一步转化为 β-ODAP。后者已证明对哺乳类动物有神经毒作用,是山黧豆中毒的主要因素之一。但 BIA 并没有神经毒活性。然而进一步的实验表明,BIA 对许多植物的生长有抑制作用,尤其显着抑制许多植物幼苗主根的伸长。莴苣( Lactuca sativa) 是用来检验植物根分泌物是否有化感作用( Allelopathy) 的常用植物,在0. 145 ~ 2. 5mM 的 BIA 存在下,莴苣幼苗胚根长是对照的 34% ~ 64%,即伸长严重受抑制。在 1. 45mM 的 BIA 环境中,水稻、高粱等幼根的生长也均受到明显的抑制,严重时受试植物的幼根根尖变黑甚至坏死。
Schenk 等的实验表明,BIA 还能明显抑制一些病原真菌如灰霉菌( Botrytis cinerea) 、纹枯病菌( Rhizoctonia solani) 以及引起根腐病的终极腐霉( Pythium ultimum) 的生长。BIA 对酿酒酵母( Sac-charomyces cerevisiae) 的抑制作用甚至可以作为标准用来检验野豌豆植物根分泌物中是否存在 BIA。但BIA 对细菌没有明显抑制作用,而对根瘤菌却有明显的趋化作用。由于 BIA 的这些生理效应,Schenk和 Werner 认为 BIA 是一种有效的化感物质( Allelo-chemicals) ,它经根分泌进入土壤抑制其它植物和病原真菌的生长,同时促进根瘤菌向根表面的富集,从而有利于这些豆类植物的生长及尽快结瘤。
虽然在根中 BIA 的含量没有芽中的高,但根可大量向根际分泌 BIA,尤其是豌豆等植物。香豌豆即使在开花后进入衰老阶段,其它组织中已检测不到 BIA 的存在,但根中仍有 BIA 的合成。这些事实说明 BIA 可能在这些植物的根际环境中起重要作用。
3. 2 黧豆素
在野豌豆植物中,属间甚至种间的杂交极其困难,其原因至今仍不甚明了。早在 1967 年,Simola推测存在于野豌豆中的一些非蛋白游离氨基酸是否会影响花粉萌发及花粉管生长从而阻止种间杂交。
用黧豆素所做的实验表明,黧豆素对野豌豆不同种类花粉的萌发生长效应不同,其中对能产生黧豆素的豆类如坦尼尔山黧豆等的花粉萌发生长有显着的促进作用,而对那些不能合成黧豆素的种类花粉生长明显抑制。由此,Simola 认为黧豆素的存在至少是兵豆属许多种类间杂交不亲合的因素之一。另外,黧豆素还能促进根瘤菌及大豆愈伤组织的生长,但相关机理人们仍不得而知。
3. 3 含羞草氨酸
很早人们就发现家畜或人食用金合欢的的种子或叶子后会引起脱毛。由于含羞草氨酸是酪氨酸的类似物质,从小鼠的研究结果人们推测它可能抑制酪氨酸脱羧酶和酪氨酸酶从而抑制毛发的发生。进一步研究表明,含羞草氨酸能抑制细胞分裂,并使分裂中的细胞停留在分裂周期的 G1 期。这种抑制作用与含羞草氨酸可逆抑制 DNA 的合成有关。因为它能抑制 DNA 复制叉的形成从而阻止 DNA的复制,使细胞难以越过 G1 期进行正常的分裂周期循环。
由于含羞草氨酸能作为底物类似物与酪氨酸酶缓慢结合而竞争性抑制酶的活性,它已作为酪氨酸酶的标准抑制剂在该酶的研究广泛使用; 含羞草氨酸明显的细胞分裂抑制效应也被人们用来作为细胞分裂同步化的试剂,同时也促使人们用它进行抑癌的疗效尝试。近年发现含羞草氨酸能间接抑制哺乳动物细胞的丝氨酸羟甲基转移酶( Serine Hydroxymethyltransferase),从而影响胸腺嘧啶核苷合成和真核细胞翻译启始因子 5A 的合成,最终影响细胞分裂。含羞草氨酸还能诱导炎症反应和细胞凋亡。可以看出,含羞草氨酸对动物细胞的影响涉及多个方面。
含羞草氨酸除了对哺乳类动物细胞有多方面的生理活性外,对许多病原微生物、昆虫及植物的生长也会产生复杂的抑制效应。一些常见的植物病原菌如菜豆炭疽病菌( Colletotrichum lindemuthianum) 、褐斑病菌( Cercospora canescens) 、痂囊腔菌属( Elsinoesp. ) 的许多种和齐整小核菌( sclerotium rolfsii) 等,含羞草氨酸均有明显的生长抑制作用。2. 5 mM 的含羞草氨酸能使齐整小核菌 40% ~ 60% 的菌丝生长抑制,也能抑制其菌核的萌发。它能非竞争性抑制天冬氨酸氨基转移酶 ( aspartate aminotrans-ferase) 活性( 下降约 37% ) ( KI= 0. 056 mM) ; 能竞争性抑制多酚氧化酶( polyphenol oxidase) 活性( 下降约 87%) ( KI= 0. 089 mM) ,对 α-淀粉酶( α-amyl-ase) 也有抑制作用( 活性下降约 20% ) 。在相同浓度下,真菌细胞中 ATP 的产生量下降约 70%。对DNA 复制的抑制作用主要表现在抑制胸腺嘧啶脱氧核苷( thymidine) 的渗入。但是对 RNA 的合成几乎无影响。
产生含羞草氨酸的豆类植物由于能结瘤固氮,因此人们自然想知道这类氨基酸对固氮菌是否有影响,因为在这些豆类的根及根瘤中均含有含羞草氨酸。实验结果表明,从银合欢属植物的根瘤中分离到的根瘤菌只有 40% 可以分解含羞草氨酸,但不能分解含羞草氨酸的菌株也能使这些植物成功结瘤并固氮。然而在含羞草氨酸存在的情况下,后一类菌株受到的生长抑制明显比前一类菌株强。进一步实验表明,能分解含羞草氨酸的菌株产生的相关分解酶均能被含羞草氨酸诱导。由此可以认为,虽然菌体能利用含羞草氨酸并不是这类根瘤菌结瘤所必须,但显然为这些菌株提供了一种竞争优势,尤其在氮源和碳源匮乏的环境条件下。
0. 1% ~ 0. 3% 的含羞草氨酸溶液能使许多蚜虫致死。0. 06%的溶液使70%的赤拟谷盗( Triboli-um castaneum) 一龄幼虫生长和发育受到抑制,而浓度为 0. 08%时,使所有的试验幼虫生长抑制。进一步分析表明,幼虫的海藻糖酶( trehalase) 、蔗糖转化酶( invertase) 和淀粉酶( amylase) 的活性随含羞草氨酸的浓度升高而下降。由此推测含羞草氨酸可能通过影响这些有关能量代谢的酶而导致幼虫 ATP 供应不足使幼体生长受到抑制。
Smith 和 Fowden 最早注意到含羞草氨酸对植物的生长有抑制作用。他们发现这种氨基酸能抑制绿豆幼苗的生长。后来人们注意到银合欢树下很少有杂草生长。直接用含羞草氨酸溶液接触植物的种子或幼苗,发现敏感植物莴苣种子萌发受到抑制,对水稻萌发及幼苗生长的抑制作用也很明显,同时其硝酸还原酶( nitrate reductase) 、过氧化物酶( peroxidase) 、过氧化氢酶( catalase) 及生长素 IAA氧化酶( IAA oxidas) 的活性均受到不同程度的抑制。用 大 果 田 菁 ( Sesbania exaltata) 、决 明 子( Senna obtusifulia) 、小麦( Triticum aestivum)及模式植物拟南芥所做的实验表明,含羞草氨酸对这些植物的种子萌发、幼苗生长甚至叶绿体的发育均有严重的抑制作用。
3. 4 使君子氨酸
使君子的果实是我国着名的驱虫特效药,不但对人体内的蛔虫有显着的抑制作用,对蚯蚓、水蛭、猪蛔等均有较强的抑制效果。使君子的这种功效后来被证明与其含有的一种兴奋性神经介质———使君子氨酸( QA) 有关。QA 是谷氨酸的结构类似物,而谷氨酸是昆虫神经肌肉接点和哺乳动物中枢神经系统重要的兴奋性神经递质,它的受体分为三个亚型,其中之一就是 QA 激活亚型,该亚型现在常被称为 AMPA( 即 α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,α-氨基-3-羟基-5-甲基-4-异恶唑丙酸) 亚型。在许多谷氨酸类似物中,QA 是作用最强的兴奋性氨基酸受体的激活剂。QA 能使蛔虫麻醉从而赋予使君子的驱虫药效。上世纪80 年代以来,人们对 QA 的作用机理进行了深入的研究,并视 QA 为典型的兴奋性神经激活剂。
使君子氨酸对昆虫也有显着的毒性。早在1920 年,人们发现咬食天竺葵后会使甲虫麻醉,但一直不知其机理,直到最近人们才发现这一现象也是由于使君子氨酸而导致的,并第一次发现天竺葵属中的许多植物也含有使君子氨酸。使君子氨酸对日本甲虫的麻醉效果与尼古丁的相似,1 到 2支花梗中的含量足以使日本甲虫失去运动能力。使君子氨酸对细菌、真菌类病原微生物的生物学效应却未见报导。
3. 5 尿嘧啶丙氨酸和异尿嘧啶丙氨酸
在有些植物如野豌豆族中,游离的尿嘧啶环衍生物极为丰富,它们的生理活性多与动物中枢神经系统有关。大量研究表明,尿嘧啶丙氨酸的作用机理与使君子氨酸对中枢神经系统的作用机理很相似,也是典型的 AMPA 型受体激活剂,而嘧啶环 5 位的氢被不同卤素取代产生的许多类似物甚至比尿嘧啶丙氨酸本身有更强的激活效应。但是尿嘧啶丙氨酸的同分异构体———异尿嘧啶丙氨酸却没有相关活性,或活性很低。种子萌发试验表明,游离的尿嘧啶环严重抑制绿豆和大豆的萌发和幼苗的生长,而对豌豆和旦尼尔山黧豆的萌发和生长几乎无影响。由于绿豆和大豆等幼苗中人们没有检测到游离存在的尿嘧啶,因而人们推测豌豆等植物幼苗大量积累尿嘧啶衍生物可能是它们自身解除尿嘧啶毒性的产物。然而这些尿嘧啶衍生物对其它生物的效应却鲜有报导。
3. 6 西瓜子氨酸
虽然人们很早就从西瓜子中分离和鉴定出了西瓜子氨酸,但该氨基酸是否有特殊的生理活性,至今未见报导。然而,人们对与西瓜子氨酸结构类似的南瓜子氨酸———3-氨基吡咯烷-3-羧酸( 3-Amino-pyr-rolidine-3-carboxylic acid,cucurbitin) ( 图 3 ) 却进行了不少的药理性研究,并发现南瓜子氨酸能有效的治疗绦虫病、血吸虫病及一些过敏症。
4 结语
虽然使君子氨酸等的研究和利用较早,但这类氨基酸的大多数人们至今仍不十分了解。
4. 1 分类、进化及代谢理论研究
由于非蛋白氨基酸的分布有种属特异性,所以很早人们将这类次生代谢产物作为植物化学分类的依据。通过对次生代谢产物研究不但有助于理清相关植物种类之间的亲缘关系,而且可以弥补进化研究中环境和形态以及基因方面证据不足和局限性; 由于大多数这类氨基酸有化感作用,对这些化感性质的研究可进一步说明不同植物在进化过程中的生化适应规律。通过对 α 丙氨酸 β 位杂环取代氨基酸合成及降解机制的研究可进一步阐明氮、硫等主要代谢的调控以及与其它代谢之间的联系。
4. 2 药物开发
使君子氨酸作为特效药物在我国由来已久,含羞草氨酸、尿嘧啶丙氨酸等虽具有多种生理功能,其作用机理目前仍不明确; 西瓜子氨酸等对人及家禽有何生理功效,至今未见报导。丙氨酸 β 位杂环取代氨基酸特殊的生理活性理应得到进一步的研究与开发。
4. 3 绿色杀虫剂开发
研究鉴定具有化感作用的天然产物作为绿色杀虫剂的候选分子已得到人们的普遍重视,β 位杂环取代的丙氨酸类次生代谢物具有明显的化感作用,不少学者已注意到了它们作为绿色杀虫剂的应用价值,并开始用化学或模拟酶促反应的方法进行大量合成,但应用研究进展缓慢。
虽然植物次生非蛋白氨基酸种类繁多,但已经认识并加以利用的为数极少。丙氨酸 β 位杂环取代氨基酸是非蛋白氨基酸中的一大类,其分布、合成及生理作用甚为特殊,对这类氨基酸的深入研究有助于理解植物氨基酸及相关代谢的机理。随着研究的深入,这类氨基酸的数量还会增加,对它们的综合利用也会随之展开。
参考文献
1 Lambein F,et al. Isoxazolin-5-ones chemistry and biology ofa new class of plant products. Heterocycles,1976,4: 567-593.
2 Kuo YH,et al. Isoxazolin-5-ones and amino acids in root ex-udates of pea and sweet pea seedlings. Plant Physiol,1982,70: 1283-1289.
3 Ikegami F,et al. Biosynthesis of neuroactive amino acids bycysteine synthase in Lathyrus latifolius. Phytochemistry,1992,31: 1991-1996.
4 Wink M. Special nitrogen metabolism. ‖ PM Dey,JB Har-bourne,eds,Plant Biochemistry. San Diego: Academic Press,1997. 439-486.
5 Barrett GC. Chemistry and Biochemistry of the Amino Acids.London: Chapman and Hall,1985.
6 Selmar D. Biosynthesis of Cyanogenic Glycosides,Glucosino-lates and Non-protein Amino Acids. ‖M. Wink,eds,AnnualPlant Reviews,vol 40. Biochemistry of Plant Secondary Me-tabolism ( edn 2 ) ,New York: Wiley-Blackwell,2010. 92-181.
7 Yamane H,et al. Chemical Defence and Toxins of Plants. ‖Mander L,Lui H-W,eds,Comprehensive Natural ProductsII: Chemistry and Biology. Oxford: Elsevier,2010. 339-385.
8 Piotrowski M,Volmer JJ. Cyanide metabolism in higherplants: cyanoalanine hydratase is a NIT4 homolog. Plant Mo-lecular Biology,2006,61: 111-122.
9 Kuo YH,et al. Metabolic routes of beta-( isoxazolin-5-on-2-yl) -L-alanine ( BIA) ,the precursor of the neurotoxin ODAP( beta-N-oxalyl-L-alpha,beta-diaminopropionic acid) ,in dif-ferent legume seedlings. Phytochemistry,1998,49: 43-48.
10 Ikegami F,et al. Isoxazolin-5-one derivatives in Lathyrus odo-ratus during development and growth. Phytochemistry,1984,23: 1567-1569.
11 Bell AE. Associations of Ninhydrin-Reacting Compounds inthe Seeds of 49 Species of Lathyrus. Biochem J,1962,83:225-229.
13 Brown EG,Al-Baldawi NF. Biosynthesis of the PyrimidinylAmino Acid Lathyrine by Lathyrius tingitanus L. . BiochemJ,1977,164: 589-594.
14 Crounse RG,et al. Inhibition of growth of hair by mimosine.Nature,1962,194: 694-695.