摘 要: 通过对几种分子标记技术的介绍,总结了分子标记技术在黄鳝(Monopterus albus)的遗传多样性分析、亲缘关系研究、性别鉴定等方面的研究应用成果。
关键词 : 分子标记;黄鳝(Monopterus albus); 遗传多样性;育种;
Abstract: Through the introduction of several molecular marker technologies, the research and application results of molecular marker technology were summarized in genetic diversity analysis, kinship research, sex identification and other aspects of Monopterus albus.
Keyword: molecular marker; Monopterus albus; genetic diversity; breeding;
黄鳝(Monopterus albus)也称鳝鱼,广泛分布于亚洲东部和南部,常年生活在水生植物密集的池塘湖泊或岸边洞穴淤泥中[1]。不同于其他鱼类,黄鳝有独特的性反转现象,即产卵前为雌性而后卵巢退化变成雄性。相对于其他淡水鱼类,如鲤鱼(Cyprinus carpio)[2]、草鱼(Ctenopharyngodon idella)[3]动辄数十万产卵量来说,鳝鱼怀卵量仅有200~800粒,且体表无鳞难以应对恶劣环境,所以种质资源贫乏,由于近年来持续的环境污染和人为的过度捕捞,使得黄鳝资源到了急需保护的地步[4]。所以采取有效措施高效繁育黄鳝苗种与良种选育对黄鳝养殖业的可持续健康发展与种质资源保护具有重要意义。
传统的育种方法难以快速提高育种效率。随着近年来生物技术的不断发展,生物学前沿技术在黄鳝育种工作中得到应用[5],为黄鳝育种产业发展增添了新的动力,其中最值得称道的当属分子标记技术。当前,分子标记已广泛应用于生物的基因定位、物种起源、亲缘关系、遗传育种等方面[6,7,8,9]。本文就分子标记的种类、特点以及在黄鳝育种中的应用作简要的概述,希望能够对相关领域研究起到推动作用。
1 、分子标记和分子标记辅助育种技术
1.1、 分子标记的概念及特点
分子标记的基础是以个体间核苷酸序列的变异作为特定的遗传标记,直观地从DNA水平反映出生物的多样性[10]。与常用的形态标记、生物化学标记、细胞标记相较而言,分子标记具有以下优点[11]:在生物体发育的任何阶段或是采集受试生物任何部位的组织,都可用来标记分析;标记的层次更深刻,反映的是来自DNA的差异;标记类型多为共显性,可以有效地选择出隐性性状;检测手段简单、高效、快速。

1.2 、分子标记的种类
随着分子标记技术的不断完善和发展,如今已被广泛应用的分子标记已有数十种[12],主要可分为:(1)以分子杂交为基础的分子标记,主要有数目可变串联重复序列(Variable Number of Tandem Repeats, VNTR)和限制性内切酶片段长度多态性(Restriction Fragment Length Polymorphism, RFLP)两种;(2)以PCR技术为基础的分子标记,主要包括DNA扩增指纹印迹(DNA Amplification Fingerprinting, DAF)、任意引物PCR(Arbitrarily Primed Polymerase Chain Reaction, AP-PCR)、随机扩增多态性DNA(Random Amplified Polymorphism DNA,RAPD)、简单重复序列(Simple Sequence Repeat, SSR)、单引物扩增反应(Single Primer Amplification Reaction, SPAR)、DNA单链构象多态性(Single Strand Conformation Polymorphism, SSCP)、序列特异性扩增区(Sequence-characterized Amplified Region, SCAR)、双脱氧化指纹法(Dideoxy Fingerprints, ddF)和序列标志位点(Sequence Tagged Sites, STS)技术等;(3)以限制性酶切和PCR技术为基础的分子标记,主要有扩增片段长度多态性(Amplified Fragment Length Polymorphism, AFLP)和酶切扩增多态性序列(Cleaved Amplified Polymorphism Sequences, CAPS);(4)以DNA芯片技术为基础的分子标记,主要是核苷酸多态性(Single Nucleotide Polymorphism, SNP)分子标记;(5)线粒体DNA标记,主要包括D-loop基因、Cyt b基因以及一些其他的线粒体基因标记。表1对上述部分标记方法的操作原理、特性、成本等方面进行了说明。
表1 主要分子标记原理及特点[13]
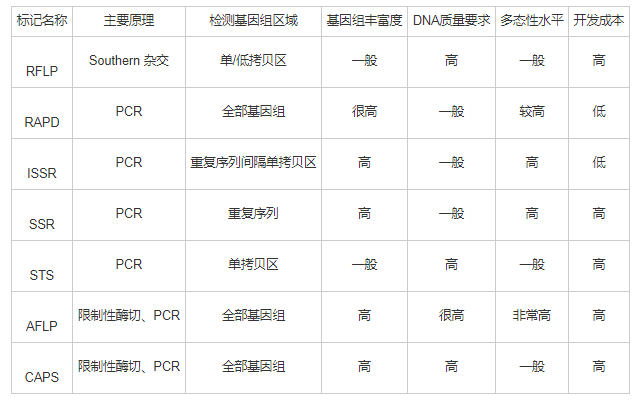
1.3 、分子标记辅助选择技术
分子标记辅助选择(Marker-assisted selection, MAS)是利用与目的基因紧密连锁的分子标记,来辅助选择出具有目标性状的基因,从而获得所需性状个体,以此达到高效选育目的[14]。MAS既可以标记选择目标基因,又可以标记选择目标基因以外的全基因组,它是将分子标记技术用于提高育种效率的一种方式[15]。
1.3.1、 分子标记辅助选择技术在育种领域的优越性
大量理论实践研究表明,相对于传统育种技术而言,MAS有显着优越性,可以在动植物生长发育的任何阶段进行MAS,并且不会因为环境因素不同以及基因是否表达而对结果产生影响;纯合和杂合基因型可以用共显性标记进行区分,所以能在分离世代的早期对纯合基因型进行辅助选择;一些表型难以鉴别的性状(如抗病性、抗寒性等)也可辅助选择;还能够将控制不同性状的优良基因聚合在一起以达到定向选育的目的[16]。
1.3.2 、影响分子标记辅助选择技术的主要因素
MAS虽然能够提高选择效率,但因其研究设计内容广泛,其效率受到很多其他因素的影响,如性状的遗传力、基因与标记间的连锁程度、世代的影响、分子标记的数目和类型、控制性状基因的数目等[13]。
2 、分子标记在黄鳝育种中的应用
2.1、 RAPD标记在黄鳝育种中的应用
RAPD即随机扩增多态性DNA(Random amplified polymorphic DNA,RAPD),RAPD在黄鳝育种中的应用主要表现在其遗传多样性方面。一般来说,遗传多样性越高的物种对环境变化的适应能力通常越强,也更容易扩展其分布范围[17]。黄鳝属无鳞鱼,相较于其他鱼类而言缺少先天的鳞片保护,难以适应剧烈的环境变化,所以研究黄鳝的遗传多样性对其至关重要。其次对遗传多样性的研究还可以用来掌握生物群体的遗传结构,对物种的演变历史及进化趋势进行推测,讨论品种濒危程度,为采取有效措施提供合理化建议[18]。
大量研究显示,在形态特征[19]、蛋白质[1,20]、染色体[21]水平上,黄鳝都具有较高的遗传多样性。刘良国等[22]对洞庭湖区三种体色黄鳝群体进行RAPD分析计算得出,黄鳝群体内和群体间的遗传距离大小在0.038 217至0.134 074间,整体来看并不高,这说明该地区黄鳝遗传多样性较低。导致出现这一结果的原因,一方面是由于洞庭湖区的黄鳝属可能只有唯一的一个种,受到的遗传渐渗较低;另一方面,可能是由于长期的近亲繁殖导致了纯度较高个体的出现,因此需要对该地区黄鳝种质资源进行保护。周先文[23]采用RAPD分子标记对两种不同体色黄鳝群体进行分析,结果显示黄色群体比灰色群体具有更加丰富的遗传多样性,这可能与黄色群体抢食速度和生长速度都大于灰色群体有关,所以能在恶劣环境中更好地存活下来,因此在选育时可以重点对黄色群体进行资源开发。李芝琴等[24]利用RAPD研究表明,在遗传相似度方面,鄱阳湖黄鳝低于湖南黄鳝[25]和广东黄鳝[26],但是与其他大部分鱼类如鲫鱼 (Carassius auratus auratus) [27]、鮈鲫(Gobiocypris rarus)[28]相比这三个地区黄鳝遗传相似度均略低,说明这些区域的黄鳝遗传多样性较为丰富,特别是鄱阳湖黄鳝,具有显着的遗传改良潜力。运用RAPD标记可以从DNA水平对黄鳝个体或群体遗传多样性进行直观的分析,不仅对黄鳝的系统地位与遗传变异的研究具有重要价值,而且可以为黄鳝苗种高效繁育与良种选育提供重要资料。
2.2、 SSR标记在黄鳝育种中的应用
SSR即简单重复序列(Simple Sequence Repeat, SSR),也称微卫星标记(Microsatellite markers) ,有数量丰富、容易检测、重复性好、呈共显性遗传等优点[29]。周宇芳等[30]利用SSR标记对分布于浙江、江苏、安徽、湖北4个地区的黄鳝野生群体进行分析,结果显示种群内等位基因数(A)和有效等位基因数(Ne)在安徽群体中最多(11.00,8.29),浙江群体内最少(7.25,5.55);平均观测杂合度(Ho)湖北群体(0.709)最高,浙江群体最低(0.589);平均期望杂合度(He)安徽群体(0.918)最高,浙江群体最低(0.813);平均多态信息含量(PIC)安徽群体(0.864)最高,浙江群体最低(0.736)。说明安徽群体的遗传多样性最为丰富,湖北群体和江苏群体其次,而浙江群体相对较低。究其原因,是因为浙江黄鳝市场需求量大,人工养鳝规模小,除省外采购外更多依赖于本地野生捕获从而导致资源匮乏,这也是浙江本地野生鳝鱼价格奇高的原因所在,所以应加强浙江野生黄鳝种质资源的合理利用和保护。遗传分化系数(FST)和Nei's遗传距离显示浙江群体和湖北群体间的遗传距离最大,因此可以在生产上用这两地黄鳝群体进行杂交育种以期获得最大的杂种优势。周华兴等[31]利用SSR标记方法对长江沿岸6个地点野生黄鳝(3个干流,3个支流)进行研究,结果表明3个支流样本是中等分化的。这与其线粒体标记得到的高度分化结果不同,这种不一致可能是其独特的性反转造成的。性反转前黄鳝是雌性的,并且为种群遗传库提供线粒体和核DNA,产卵后黄鳝变成雄性,雄性黄鳝体型比雌性更大,更强壮,因此雄性可能迁移更远,存活率更高,这为雄性偏向性传播提供了可能。由于线粒体母系遗传[32],雄性黄鳝只向种群遗传库提供核DNA,因此,雄性偏向性传播可能会导致标记之间种群结构的差异。在黄鳝整个生命历程中,雄性阶段比雌性阶段要长得多,这可能导致线粒体和核数据之间的遗传频率不同,造成了由于标记方法的不同而产生结果的差异。
2.3 、线粒体DNA标记在黄鳝育种中的应用
不同于其他细胞器,线粒体内有自身遗传物质[33],即线粒体DNA(Mitochondrial DNA,mtDNA),相比于核基因,优点在于其自身几乎不发生重组现象,且结构单一,突变率较高,进化速度快[34],所以在分析群体遗传分化、种群进化、亲缘关系中被广泛应用[35]。主要包括D-loop基因、Cyt b基因以及一些其他的线粒体基因标记。凌俊等[36]将三种体色黄鳝用线粒体Cyt b基因标记,结果显示在遗传多样性方面青斑鳝最高(Hd:0.945 7,Pi:0.006 01),深黄斑鳝次之(Hd:0.915 3,Pi:0.004 26),青黄斑鳝最低(Hd:0.751 7,Pi:0.002 11)。三种体色黄鳝的遗传多样性虽有少许差异但均处在较高水平,在资源自我恢复方面显示出了较大潜力,出现的少许差异可能与三种体色黄鳝在自然界中的分布情况有关,青黄斑鳝在野外分布广泛,一地一次采样足够使用,所以容易出现采集到的样品亲缘关系较近;而另外两种在野外相对密度较小,样品通常来自多个地方,因此展现出来的遗传多样性也更为丰富。虽然野生深黄斑鳝分布密度低,但在生长速度[37]、繁殖力[38]方面都有显着优势,深受养殖户和育种工作者的喜爱,为了黄鳝产业的可持续发展要采取有效措施对该品种进行保护并做合理的开发利用。胡玉婷等[39,40]采用线粒体Cyt b标记研究了安徽境内长江流域和淮河流域黄鳝的遗传多样性,结果分别为Hd:0.932,Pi:0.019 04和Pi:0.018 82,Hd:0.787,显示出较高水平的遗传多样性,体现了安徽两大水系野生黄鳝群体有丰富的遗传多样性,对黄鳝种质资源的保护及恢复具有积极意义。蔡欣等[41]通过对四川绵阳地区部分野生黄鳝mtDNA D-loop序列多态性分析得出绵阳野生黄鳝群体内不同个体之间的遗传距离并不高,两两组合之间的平均遗传距离为0.003 3或0.006 6,这可能是由于绵阳地区80%以上为山区或丘陵地带,导致该地区黄鳝与外界基因交流机会少,野生黄鳝类群单一,出现了纯度较高的个体有关。梁宏伟等[42]以mtDNA COI基因序列作为标记,分析了来源于湖北、江西、安徽、湖南、重庆和山东6个地理种群共187条野生黄鳝的遗传多样性,在646 bp片段中出现了61个变异位点,所有个体共有38种单倍型。群体的单倍型多样性为0.886,核苷酸多样性为0.010 94。总体来说这6个群体遗传多样性高,但重庆群体遗传多样性较低,单倍型多样性为0.204,远远低于群体单倍型多样性,核苷酸多样性也和总体不在一个数量级,这可能是重庆市整体位于四川盆地,与外部有天然的地理屏障相隔有关。然而,所有单倍型并没有因地理群体的不同而独立存在,遗传距离也没有与地理距离出现绝对的依存关系。关于不同地理种群黄鳝之间的系统进化关系还有待于进一步研究,增加样本丰富度,再结合江河流域分布、苗种流向、销售流通、人工放流等因素进行综合分析。
2.4 、其他分子标记技术在黄鳝育种中的应用
在黄鳝亲缘关系和种质鉴定方面,郑浩亮[43]利用SNP技术标记分析不同地区黄鳝遗传多样性与亲缘关系,对8个不同地区野生黄鳝进行杂交,得到河南固始和巢湖杂交F1代鳝苗生长速度最快,8周时间由4.23 cm增长到12.66 cm, 体重达到1.978 0 g, 因此可以利用河南固始和安徽巢湖黄鳝杂交后代进行规模化养殖推广。吴秀林[44]运用SRAP标记对3种体色黄鳝进行研究,结果显示深黄大斑鳝(A)、浅黄细斑鳝(B)、青灰鳝(C)三个群体Nei'S基因多样性分别为0.278 1、0.301 1、0.312 6,Shannon'S多样信息指数依次为0.406 5、0.437 3、0.450 5。3个群体间的Nei'S无偏遗传距离为0.041 0~0.088 7,遗传相似度为0.915 1~0.959 8;A与C群体间遗传距离最大(0.088 7),有较远的亲缘关系,与B群体间遗传距离最小(0.041 0),亲缘关系相对较近,与凌俊等[37]研究结果相近。胡彬等[45]利用cDNA-SRAP(相关序列扩增多态性)标记发现黄鳝体外黏液中的雌雄表达差异片段1在不同性别黄鳝体外黏液中都有表达,表达量在雄性中明显高于雌性,这不仅对黄鳝性反转的研究提供了更多方向,也为活体鉴定黄鳝性别增加了准确性,对定向选择繁殖力更高的雌性黄鳝个体有一定的指导意义。杨太有等[46]利用ISSR标记对黄河流域黄鳝亲缘关系进行分析,结果显示河南群体和山东群体亲缘关系最近而且都与陕西群体亲缘关系相近,可共同聚为一大类;内蒙古群体与甘肃群体有较近的亲缘关系可作为另一大类;亲缘关系最远的为内蒙古群体和山东群体。从以上结果可以看出黄河流域黄鳝的亲缘关系与地理距离的远近有一定的依存关系。
3 、展望
近年来DNA分子标记技术在生物遗传育种中得到广泛应用,随着分子生物学的发展,越来越多操作简单、成本低廉、信息量大的标记技术被开发出来。分子标记成为了当今黄鳝育种中必不可少的一部分,在定向培育黄鳝优良品系方面展现出了极大潜力,但还有许多需要完善的地方。首先,现阶段的基因定位工作进度有待提高,可被利用的分子标记基因存在连锁不紧密或尚未被定位的现象;即使在已经精确定位的基因中,能够被随时利用的标记仍不充足,并且不能保证能在群体双亲间表现出多态性。此外,在改良数量性状方面,分子标记的应用并没有像最初想象得那么广泛,主要是因为黄鳝基因发掘的不足,不同方面的遗传信息处于待整合状态。
针对上述存在的问题,在今后的黄鳝育种工作中要尽可能保证既是遗传研究群体,又是育种群体,从而确保基因定位与育种工作的同时开展;积极寻找与目的基因紧密连锁的分子标记;各研究机构组织要构建信息共享网络,将大量处于零散状态的遗传信息整合起来方便育种工作者的研究利用。随着分子生物学新成果和新技术的不断涌现,以及生物信息学、基因组学等研究的进一步发展,分子标记技术将在遗传多样性、亲缘关系、遗传图谱的构建、目的基因的分离与克隆、种质鉴定、疾病防治等方面为黄鳝苗种高效繁育与良种选育开辟了一个新的时代。
参考文献
[1]张繁荣,雷刚几种不同体色黄鳝的酯酶同工酶的分析[J]江汉大学学报, 200.17(6);8-11.
[2]吴再平,程稿,刘丹兴国红鲤鱼在东北地区的繁育试验[J].畜牧兽医科学(电子版),2019,55(19):20-21.
[3]肖伟, 郭磊,张锋,等.宁夏地区草鱼自繁晚苗培育及两年养成技术模式探索[].水产养殖. 2019(8):3-5.
[4]曾尚伟分析黄鳝规模化人工繁殖技术研究与应用推广[J].农业开发与装备,2019(3):219-220.
[5]平黄鳝促性腺激素释放激素的cDNA克隆与序列分析[D]重庆:西南农业大学, 2005.
[6]袁鹰,王程,韩俊,等一个大豆矮秆性状基因的分子标记定位[J.北京农学院学报, 2019,34(3):25-29.
[7] HAMEED U KA,ABDELAZIZ K SHERIF N E .Genetic diversity of grapevine (itis vinifera L.) cultivars in AI-Madinah AI-Munawara based on molecular markers and morphological traits[J] Bangladesh Journal of Plant Taxonomy,2020.27(1):113-127.
[8] BETTINI S,LAZZARI M,FRANCESCHINI V.Molecular markers in the study of non-model vertebrates:Their significant contributions to the current knowledge of tetrapod glial celIs and fish olfactory neurons.[J] Results and problems in cell differentiation,2019(68):355-377.
[9]谢元澄,李欣原,苏胜彦, 等基于黄河鲤新品系IGF2b基因SNPs获取体系的建立及在该品系选育中的应用[J]中国水产科学, 2019,26(4):686-694.
[10]薛红大短四向重组自交系群体株高发育动态播期效应的QTL分析[D]哈尔滨:东北农业大学, 2018.
[11]刘洋分子标记技术浅谈[J]科技信息, 2009(14):82-82.
[12]郝炯,渠云芳.DNA分子标记在作物育种中的应用[J]西农业科学, 2009,37(3):81-85.
[13]昊,陈涛,姚姝,等分子标记辅助选择技术及其在水稻定向改良上的应用研究进展[J]江苏农业科学, 2014.42(2):22-27.
[14]程思源分子标记辅助构建小叶基因在黄瓜不同遗传背景下的近等因系D]郑州:河南农业大学, 2018.
[15] DUDLEY J W.Molecular markers in plant improvement manipulation of genes afecting quantitative traits[J] Crop Science, 1994,34(1):322-322.
[16]张文龙,陈志伟,杨文鹏 ,等分子标记辅助选择技术及其在作物育种上的应用研究[J].种子, 2008,27(4):39-43.
[17]徐爱遐芥菜型油菜(Brassica juncea)遗传多样性及其黄籽与芥酸性状的分子标记[D] .咸阳:西北农林科技大学, 2008.
[18]李智军三个马品种的STR群体遗传分析[D]乌鲁木济:新疆农业大学, 2013.
[19]王彦不同体色黄鳝子代体色变化及某些生物学特性的初步研究[D].武汉:华中农业大学, 2008.
[20]杨发群,周秋白, 张燕萍,等鄱阳湖地区3种体色黄鳝酯酶同工酶的遗传差异分析[J]经济动物学报, 200(2);110-113.
[21]刘良国,席在星,郑荷,等两种不同体色黄鳝的染色体组型[J.水产科学, 2006,25(6):287-290.
[2]刘良国,文彬,曾伯平,等.三种体色黄鳝的RAPD分析[J.水产科学, 2005,24(1);22-25.
[23]周先文.两种体色黄鳝群体的生长差异及RAPD分析[D].长沙: 湖南农业大学, 2009.
[24]芝琴,赵大显,欧阳珊,等5种不同体色黄鳝RAPD的初步分析[J].南昌大学学报(理科版),2011,35(1):90-94.
[25]尹绍武,李建中,周工健,等黄鳝野生群体和养殖群体遗传结构的RAPD分析[J]应用与环境生物学报, 2005.11(3):328-332.
[26]鲁双庆黄鳝DNA多态性分析及Cu2+、AE对黄鳝生理生化的影响[D]广州:中山大学, 2002.
[27]宋平,周伟,潘云峰,等.普通鲫鱼的RAPD标记及其遗传多样性[J].武汉大学学报(自然科学版).000.46(6):721-725.
[28]王剑伟,王伟,崔迎松野生和近交稀有够鲫的遗传多样性(J]生物多样性, 2000,8(3).241-247.
[29]杨梦婷,黄洲,干建平,等SSR分子标记的研究进展[J]杭州师范大学学报(自然科学版),.2019,18(4):429-436.
[30]周宇芳,胡杭娇, 张龙韬,等长江中下游黄鳝遗传多样性的微卫星分析[J]生物技术通报,2011(11):187-192.
[31] ZHOU HX ,HU Y T,JIANG H,et al.Population genetics of swamp eel in the Yangtze River.comparative analyses between mitochondrial and microsatellite data provide novel insights[J].Peer J,2020(8):e8415.
[32]杨玉慧,李义明分子生态学研究与动物多样性保护[J].生物多样性,2001(3):284-293.
[33]张尊月, 李坪,唐莉,等线粒体和胚胎发育关系的研究进展[J]昆明医科大学学报, 2019,40(1):118-122.
[34] BROWN W M.WILSON G A C Rapid evolution of animal mitochondrial DNA[J]. Evolution,2012,76(4): 1967-1971.
[35]杨子拓,刘丽线粒体分子标记技术在水产养殖行业的应用[]广东农业科学, 2014(22):135-140.
[36]凌俊,江河,胡玉婷,等三种体色黄鳝群体遗传多样性分析[J].水产学杂志, 2016,29(4):6-10.
[37]陈芳,杨代勤,苏应兵3种不同体色黄鳝生长速度的比较[J].长江大学学报:自然科学版, 2009,6(3):1673-1409.
[38]杨代勤,陈芳,阮国良, 等3个品系黄鳝的繁殖力比较研究[J].水生态学杂志, 2009,2(4):133-135.
[39]胡玉婷,江河,胡王,等安徽长江流域黄鳝六个地理种群的遗传变异研究[J]四川动物, 2015,34(1):21-28.
[40]胡玉婷,江河,潘庭双,等安徽准河水系黄鳝群体遗传多样性及其遗传结构[J].安徽农业大学学报, 2016,43(4):529-535.
[41]蔡欣,张海容绵阳地区部分野生黄鳝mtDNA D-oop多态性分析[J]中国农学通报, 2011,27(1):424-427.
[42]梁宏伟,彦,罗相忠,等基于线粒体C0I基因的6个黄鳝群体遗传多样性[J]中国水产科学, 2018(4):837-846.
[43]郑浩亮黄鳝不同地理群体的分子遗传差异及杂交F 1代生长性能的比较研究[D].荆州:长江大学, 2019.
[44]吴秀林不同体色黄鳝生长性能、营养价值评价及遗传多样性研究[D]南京:南京农业大学, 2016.
第二章褐鳟日本品系和亚东鲑遗传多样性分析及起源探讨褐鳟是鲑科鱼类中重要的商业鱼类之一,国内仅在西藏亚东地区有分布,称为亚东鲑(与褐鳟属同物异名),因该鱼体色鲜艳美丽,故当地称之为花点鱼,肉质鲜美,无肌间刺,深受当地群众喜爱,是西藏重要的经...
黄鳍金枪鱼(Thunnusalbacares)广泛分布于太平洋、印度洋和大西洋,是一种高度洄游的商业性大洋鱼类。黄鳍金枪鱼肉质鲜美,营养价值较高,已成为当前世界海洋渔业重要对象之一。随着捕捞技术的提高及捕捞强度的加大,黄鳍金枪鱼的资源量已经处于过度捕捞的状态...
细鳞鲑(Brachymystaxlenok)隶属于鲑形目鲑科鲑亚科。在我国主要分布在东北地区黑龙江流域、绥芬河、图们江、鸭绿江,新疆的额尔齐斯河,河北省北部白河及滦河上游以及秦岭北麓渭河流域。李思忠根据幽门盲囊、侧线鳞和最小性成熟年龄等形态学和生理学特征,...
厚颌鲂(Megalobramapellegrini)俗称乌鳊,隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲌亚科(Cultrinae)、鲂属(Megalobrama)[1],是长江上游特有的经济鱼类之一.厚颌鲂曾被认为是三角鲂(M.terminali)的同种异名,后经罗云林[2]对鲂属物种的性状差异...