1. 2. 5 扫描电镜观察 BMSCs 与微球支架的复合状态 细胞材料复合 1、3、6、9 d 后,每种材料各取 1ml 细胞材料混悬液,PBS 清洗 3 次,2. 5% 戊二醛室温固定 30 min,冷冻干燥后进行扫描电镜观察。
1. 2. 6 细胞骨架染色及共聚焦扫描式显微镜观察细胞材料复合后 6 d,取 1 ml 细胞材料混悬液,PBS 轻缓清洗 3 次,4% 多聚甲醛室温固定 20 min,PBS 清洗 ( 5 min × 3) .FITC-Phalloidin ( 5 μg / ml)避光染色 40 min.PBS 清洗 10 min,清洗 3 次。DAPI ( 1 μg / ml) 避光染 5 min.PBS 洗 3 次。共聚焦扫描式显微镜观察。
1. 2. 7 体外模具实验 6 cm 培养皿中加入 5 ml 高温高压灭菌的 2%琼脂糖后,其厚度为 2 mm.待其凝固后,使用直径为 5 mm 的打孔器,琼脂糖上便形成直径为 5 mm、厚度为 2 mm 的圆形缺损,与标准骨缺损尺寸吻合。将细胞和微球共培养 1 d 后填充至上述模具中,表面盖筛网,加入 5 ml 培养液,每 2~ 3 d 换一次液,培养 14 ~ 21 d,观察组织块形成情况。
2 结果
2. 1 显微镜下微球形态观察 将所制备的 HAp-CS复合微球分散在水中,显微镜下可见其表面光滑,粒径均匀,大小为 300 μm 左右,见图 1.
2. 2 BMSCs 黏附率和增殖率 BMSCs 与细胞复合前 6 h 的黏附率一直处于上升趋势,2 h 时已高达70% 以上,6 h 时,黏附率超过 90% ,说明 HAp-CS 微球具有良好的促细胞黏附作用,见图 2A.细胞与微球复合前3 d,增殖幅度较平缓,6 d时,达增殖高峰,与初始细胞微球复合之比 ( 50 ∶ 1) 相比,增长了 10 倍,第 9 天时,细胞处于凋亡期,见图 2B.
2. 3 BMSCs 与细胞复合后扫描电子显微镜观察细胞材料复合 1 d 后,少量 BMSCs 定植于微球表面,细胞紧密黏附于球体表面,长梭形似成纤维细胞,形态舒展,细胞之间有相互接触融合的趋势,见图 4A.细胞材料复合 6 d 后,大量细胞分布于微球上,微球间胞外基质相互交织呈拉丝状,并将微球缠绕包裹成一个团块。微球借细胞及胞外基质凝聚成3D 块状结构,见图 3B.
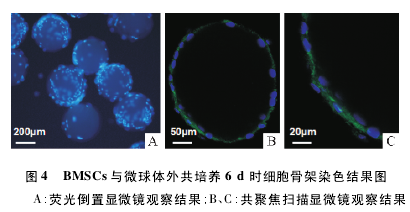
2. 4 BMSCs 骨架染色后荧光倒置显微镜及共聚焦扫描式显微镜观察 FTTC 荧光素标记的鬼笔环肽与微丝结合后被荧光激发呈绿色,DAPI 复染可将细胞核染成蓝色,见图 4.荧光倒置显微镜下,BMSCs的胞核染成蓝色,大量细胞黏附定植于微球表面。部分微球之间有大量细胞聚集,并借细胞连接在一起,见图 4A.共聚焦扫描显微镜下,微丝骨架呈绿色,细胞核呈蓝色,大量 BMSCs 定植并沿微球表面分布,骨架结构和细胞核清晰可见,见图 4B.放大可见微丝呈长梭形放射状包绕在胞核周围,见 4C.HAp-CS 支架维持了细胞的特征性骨架结构,细胞的生长状态良好。
2. 5 体外模具实验 BMSCs 和微球支架体外培养18 d,形成了复合组织块。该块状结构形态较规则完整,直径约为 5 mm,厚度约为 2 mm,见图 5A.用镊子夹起后,并无明显挤压变形或破裂,组织块有一定凝聚力和抗重力作用,见图 5B.
3 讨论
3. 1 微球制备工艺 传统块状陶瓷支架存在的最大问题是内部细胞的营养供应不足以及代谢废物不能有效排出,严重影响骨修复的效果[4 -5].为此,研究者设计了一种新的思路,即利用微球支架作为靶细胞的黏附载体,直接复合细胞填补到组织缺损区或与靶细胞体外共培养成组织块后移植于缺损区用于体内修复[6].微球材料的传统制备方法主要有 4种: 乳化交联法、沉淀凝聚法、溶剂蒸发法、喷雾干燥法[7 -10].但这类微球并不适于组织修复: 乳化交联法制备的微球粒径不均匀,其所用化学交联剂还具有一定生物毒性; 喷雾干燥法所得微球粒径较小且结构过于致密,不适于细胞的黏附生长。本研究中采用的微流控制备技术,凭借其高通量、低消耗、精确的粒径及结构可控性等技术优势,在生命科学领域显示出了巨大的应用价值[11 -12].
3. 2 支架对细胞的生物学作用 一个理想的骨组织工程支架,必定能与细胞产生充分的生物学作用。支架材料已经从简单的机械支持成为能够为诱导细胞分化、调控细胞生长增殖的生物学界面[1].在仿生支架中引入纳米级元素,可对成骨细胞和 BMSCs产生多层次的调控,如黏附、存活、增殖以及信号基因的表达[2,13].而本研究中 HAp-CS 支架的主要原料之一便是纳米级 HAp,黏附增殖实验结果证实,其在 BMSCs 的初期定植和增殖生长方面具有明显的优势。
微球支架与种子细胞间的相互作用在体外长期培养过程中得到了充分体现。一方面,HAp-CS 球体间无额外作用力,无法自动凝聚成块状结构,故球体间的连接需依靠 BMSCs 分泌的大量胞外基质,这种天然“粘接剂”加强了细胞与微球间以及微球自身间的紧密联系,并形成能抵御一定外力的工程化组织块。另一方面,BMSCs 的生理活动如长期存活和分泌胞外基质等,又有赖于微球提供的结构和生理支持。在体外长期培养的过程中,HAp-CS 微球和 BMSCs 成为了相互作用的整体,这种 3D 块状结构有望用于体内骨再生的实验研究。
参考文献
[1] Fernandez-Yague M A,Abbah S A,McNamara L,et al. Biomimet-ic approaches in bone tissue engineering: Integrating biological andphysicomechanical strategies [J]. Adv Drug Deliv Rev,2015,84: 1 - 29.
[2] Hu J,Zhou Y,Huang L,et al. Effect of nano-hydroxyapatitecoating on the osteoind-uctivity of porous biphasic calcium phos-phate ceramics [J]. BMC Musculoskelet Disord,2014,15: 114.
[3] Kim I Y,Seo S J,Moon H S,et al. Chitosan and its derivativesfor tissue engineering application[J]. Biotechnol Adv,2008,26( 1) : 1 -21.
0引言Introduction因外伤、感染、肿瘤、年龄和激素水平等病理或生理性原因造成的牙槽骨吸收、缺损在临床中很常见,如何重建缺损牙槽骨以便于后续口腔治疗的顺利进行成为临床医生热切关注的问题。目前临床常用的修复方法包括:骨移植、上颌窦提升术、引导...