
乙型肝炎是由乙型肝炎病毒( HBV) 感染引起的以肝脏为主要损害器官的传染病。全球每年约有 450万人感染 HBV,约有 100 万人死于 HBV 感染所致的肝衰竭、肝硬化和原发性肝细胞癌。对于乙型肝炎的传播流行,目前尚无特效的治疗药物,普遍接种疫苗是控制乙型肝炎发生的有效方法。由于全球感染 HBV 的人数众多,感染人群的分布多集中于不发达和贫穷国家,如何使乙肝疫苗更加经济、安全、和易于推广是重要的研究方向。转 HBsAg 基因可食用疫苗苜蓿就是在该领域中的一项有益的探索。苜蓿是一种蛋白质含量高且品质稳定,被认为是“最有可能生产重组蛋白质的植物体系”。苜蓿在抗病、抗虫、固氮、品质改良等方面获得了广泛的应用,而利用苜蓿作为植物表达载体开发疫苗的研究也日益受到关注。EVATHG 是通过克隆乙型肝炎病毒的外膜小蛋白( S) 及中蛋白( S2&S) 抗原基因,并通过基因修饰后,构建的分别含有这两种外源基因的高效植物表达载体,是一种可食用的植物疫苗。苜蓿表达的抗原已被证实能延缓和防止某些疾病的发生。但是,转基因植物作为生物新材料,其对健康的影响一直倍受关注。1998 年,苏格兰科学家实验证明,幼鼠在食用转基因土豆后,器官生长异常,体重和器官重量减轻且免疫系统遭受破坏。2008 年,意大利科学家研究证明 MON810 转基因玉米可引起断奶幼鼠免疫系统异常。转基因苜蓿作为一种新型的植物基因重组食用植物疫苗,对于动物或人类均没有接触史,也没有相关的流行病学资料,其对健康的影响在很多方面具有未知性,尤其是在对免疫系统功能的影响方面。
本实验以小鼠为受试生物,通过测定小鼠的体液免疫、细胞免疫、非特异性免疫以及免疫器官的病理组织学等相关指标的变化,初步研究 EVATHG 对机体免疫机能的影响,从而为其研发应用提供实验数据。
1 材料与方法
1. 1 试验材料
1. 1. 1 受试物及处理 EVATHG 为绿色粉末,由中国农业科学院生物技术研究所提供。为新鲜的转基因苜蓿草晒干后磨粉,过 200 目筛后制成。实验以蒸馏水为溶媒配制成不同浓度的混悬液供试。
1. 1. 2 实验动物和环境条件 实验用 ICR 小鼠由上海西普尔 - 必凯实验动物有限公司提供,实验动物生产许可证号分别为 SCXK( 沪) 2008 -0016,清洁级,雌性,体重20 g ±2 g。实验动物饲料由浙江省实验动物中心提供,执行标准 GB14924 -2001。检测环境条件,实验动物使用许可证号为 SYXK( 浙) 2008 -0106,温度范围20 ℃ ~24 ℃,相对湿度范围 40% ~70%。实验动物试验前在动物房环境中适应3 d。
1. 2 方法
1. 2. 1 实验分组与剂量 实验设 EVATHG 低、中、高剂量组及阴性对照组( 蒸馏水) 和野生型苜蓿组。
按照黄继汉等人介绍的方法算得小鼠的等效剂量大致相当于人推荐剂量的 10 倍,设 1. 0 g/kg 为实验中剂量组,在此剂量的上、下再各设实验低剂量组0. 5 g / kg和实验高剂量组 2. 0 g / kg,分别相当于人推荐剂量的 5 倍和 20 倍。低、中、高三个剂量组分别给EVATHG 0. 5g / kg、1. 0 g / kg、2. 0 g / kg 体重,阴性对照组和野生型苜蓿组则分别给予等体积的蒸馏水和野生型苜蓿( 2. 0 g/kg) 。每项免疫学指标采用清洁级ICR 小鼠 50 只,按体重随机分为 5 组,每组 10 只小鼠。采用灌胃方式给受试物,每天 1 次,灌胃容量按20 ml / kg 体重计,持续 30 d 后进行各项指标测试。
1. 2. 2 指标测定
1. 2. 2. 1 小鼠免疫器官脏体比的测定及病理组织学检查 实验期末处死动物,摘取中枢免疫器官胸腺及周围免疫器官脾脏,分别称重,计算胸腺/体重和脾脏/体重比值,并用福尔马林固定,常规制片,H. E 染色,进行病理组织学检查。
1. 2. 2. 2 ConA 诱导的小鼠脾淋巴细胞转化试验于试验期末,小鼠无菌取脾,置于盛有适量无菌 Hanks液的小平皿中,用镊子轻轻撕碎,制成单细胞悬液,200 目筛网过滤,Hanks 液洗涤 3 次,台盼兰染色计数,最后用 RPMI 1640 完全培养液调整细胞浓度为3 × 106个/ml。将细胞悬液分两孔加入培养板中,每孔 1 ml,一孔加 60 μl ConA 液( 相当于 6 μg/ml) ,另一孔作为对照,置 37 ℃、5% CO2培养箱中培养 72 h。
培养结束前 4 h,每孔轻轻吸去上清液 0. 7 ml,加入0. 7 ml不含小牛血清的 RPMI1640 培养液,同时加入MTT( 5 mg / ml) 50 μl / 孔,继续培养 4 h。培养结束后,每孔加入 1 ml 酸性异丙醇,吹打混匀,使紫色结晶完全溶解。在 570 nm 波长处测定吸光度( A) 值。最后用加 ConA 孔的 A 值减去不加 ConA 孔的光密度值代表淋巴细胞的增殖能力。
1. 2. 2. 3 绵羊红细胞( SRBC) 诱导小鼠迟发型变态反应( DTH) 于试验开始后第 26 d,每只小鼠腹腔注射 0. 2 ml 2%( v/v) 压积绵羊红细胞( SRBC) 悬液,免疫 4 d 后,测量左后足跖部厚度,然后在测量部位皮下注射 20%( v/v) SRBC,每只鼠 20 μl( 约 1 × 108个SRBC) ,注射后 24 h 测量左后足跖部厚度,求得足跖部厚度前后差值。
1. 2. 2. 4 小鼠血清溶血素测定( 血凝法) 每只鼠腹腔注射 0. 2 ml 2% ( v/v) 压积绵羊红细胞( SRBC) 悬液,进行免疫。5 d 后,取血离心,收集血清,用生理盐水将血清倍比稀释,37 ℃ 温箱孵育 3 d,观察抗体凝集反应程度,计算抗体积数。
1. 2. 2. 5 抗体生成细胞测定( Jerne 改良玻片法)于试验开始后第 25 d,每只鼠腹腔注射 0. 2 ml2% ( v / v) 压积绵羊红细胞 ( SRBC) 悬液,进行免疫。
5 d后,每只鼠制备脾细胞悬液,调整细胞浓度为5 × 106个/ml。将表层培养基( 1 g 琼脂糖加双蒸水至100 ml ) 加热溶解后,放 45 ℃ 水浴保温,与等量pH 7. 2 ~ 7. 4。2 倍浓度的 Hank's 液混合,分装小试管,每管 0. 5 ml,再向管内加 50 μl 10% SRBC( v/v,用 SA 液配制) ,20 μl 脾细胞悬液( 5 ×106个/ml) ,迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中温育 1 h ~1. 5 h,然后用 SA 缓冲液稀释的补体( 1: 8) 加入到玻片架凹槽内,继续温育 1 h ~1. 5 h 后,计数溶血空斑数。
1. 2. 2. 6 小鼠腹腔巨噬细胞吞噬鸡红细胞试验 于试验期末,各动物处死前 30 min,每鼠腹腔内注射20% ( V / V) 鸡红细胞悬液 1 ml,处死后再注入 2 ml 生理盐水,取腹腔液滴片,38 ℃温箱孵育 30 min,固定,染色,镜检,计数 100 个巨噬细胞,计算吞噬率及吞噬指数。【1】

1. 2. 2. 7 小鼠碳廓清试验 于实验期末,小鼠尾静脉注入用生理盐水稀释 3 倍 ~ 4 倍的印度墨汁,按每10 g体重 0. 1 ml 计算。注入墨汁后 2 min、10 min 分别从内眦静脉丛取血 20 μl,并将其加到 2 ml 0. 1%Na2CO3溶液中,在 600 nm 波长处测 A 值,以 Na2CO3溶液作空白对照。第 2 次采血结束后,立即处死小鼠,取肝脏和脾脏,用滤纸吸干脏器表面血污,称重。
计算吞噬指数。吞噬指数 a = 体重/( 肝重 + 脾重) ×K1 /3,K = ( 1gA 1 - lg A 2) / ( t2 - t1) ,t2 - t1 代表 2次取血时间之差,lgA 1 - lgA 2 代表 2 次血样测得光密度对数值之差。
1. 2. 2. 8 NK 细胞活性测定 于实验期末,每只鼠制备脾细胞悬液,调整细胞浓度为 2 × 107个/ml。试验前 24 h 将 YAC - 1 细胞( 靶细胞) 传代培养,应用前用 Hanks 液洗 3 次,用 RPMI1640 完全培养液调整细胞浓度为 4 ×105个/ml。取靶细胞和脾细胞悬液( 效应细胞) 各 100 μl( 效靶比 50∶1) ,加入 U 型 96 孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100 μl,靶细胞最大释放孔加靶细胞和 1% NP40 各100 μl; 上述各项均设 3 个复孔,于 37 ℃ 、5% CO2培养箱中培养 4 h,离心,每孔吸取上清 100 μl 置平底96 孔培养板中,同时加入 LDH 基质液 100 μl,反应7 min,每孔加入 1 mol / L 的 HCl 30 μl,在 490 nm 波长处测A 值,计算 NK 细胞活性。【2】

1. 2. 3 数据处理 实验数据用均数 ± 标准差( x珋 ± s)表 示,采 用 SPSS 15. 0 ( Authorization Code: dl1757dc896b06088f1) 进行单因素方差分析,两两比较采用 SNK. q 检验。按单因素方差分析的模型假设先对数据进行方差齐性检验,对方差齐性的数据直接进行分析,对方差不齐的数据进行适当的变量转换,待满足方差齐性要求后,用转换的数据进行分析。检验水准 α =0. 05。
2 实验结果
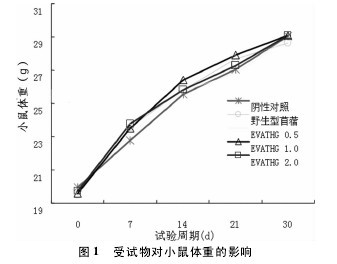
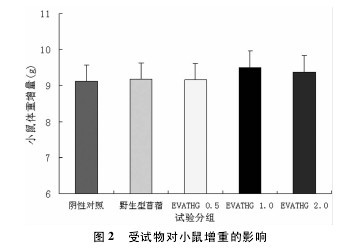
2. 1 受试物对小鼠实验期体重及体重增重的影响实验数据符合方差齐性要求( P > 0. 05) ,EVATHG0. 5 g / kg、1. 0 g / kg、2. 0 g / kg 剂量组小鼠实验期体重及体重增重与阴性对照组和野生型苜蓿组比较,差异均无统计学意义( P > 0. 05) 。表明 EVATHG 对小鼠体重及体重增重无明显影响( 图 1、图 2) 。【图1-2】
2. 2 受试物对小鼠免疫器官脏体比的影响 实验数据符合方差齐性要求( P >0. 05) ,EVATHG 三剂量组小鼠胸腺/体重比值及脾脏/体重比值与阴性对照组和野生型苜蓿组比较,差异均无统计学意义( P >0.05) 。
表明 EVATHG 对小鼠主要免疫器官胸腺和脾脏重量无明显影响( 表1) 。【表1】
2. 3 受试物对小鼠细胞免疫功能的影响 实验数据符合方差齐性要求( P >0. 05) ,与阴性对照组相比,EVATHG 1. 0 g / kg、2. 0 g / kg 剂量组及野生型苜蓿组均能提高 ConA 诱导的小鼠脾淋巴细胞的增殖能力( P <0. 05) 。EVATHG 三剂量组与野生型苜蓿组比较,差异无统计学意义( P >0. 05) 。EVATHG 三剂量组小鼠左后足跖部厚度差 24 h 测量值与阴性对照组和野 生 型 苜 蓿 组 比 较,差 异 均 无 统 计 学 意 义( P >0. 05) ( 表 2) 。提示 EVATHG 能促进 T 淋巴细胞的转化增殖,增强细胞免疫功能,而对小鼠的变态反应强度无明显影响。这与野生型苜蓿组的结果基本一致。【表2】
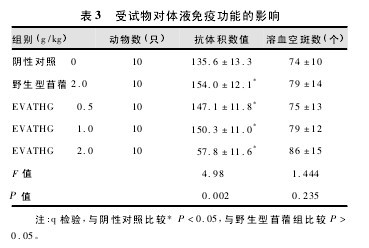
2. 4 受试物对小鼠体液免疫功能的影响 实验数据符合方差齐性要求( P >0. 05) 。与阴性对照组比较,EVATHG 三剂量组及野生型苜蓿组小鼠血清溶血素抗体积数值差异有统计学意义差异( P <0. 05) ,而小鼠溶血空斑数差异均无统计学意义差异( P >0. 05) 。=与野生型苜蓿组比较,EVATHG 三剂量组小鼠血清溶血素抗体积数值与溶血空斑数差异均无统计学意义( P >0. 05) ( 表 3) 。表明 EVATHG 能提高小鼠血清溶血素抗体滴度水平,而对抗体生成细胞数则没有影响。这与野生型苜蓿组的结果一致。【表3】
2. 5 受试物对小鼠非特异性免疫功能的影响 实验数据符合方差齐性要求( P >0. 05) ,其中吞噬率通过X = Sin- 1P1 /2转换后数据符合方差齐性要求( P >0.05) 。
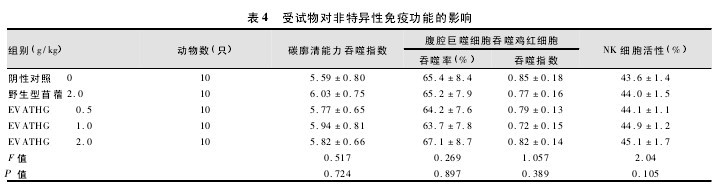
与阴性对照组和野生型苜蓿组比较,EVATHG 三剂量组小鼠碳廓清能力吞噬指数、腹腔巨噬细胞吞噬鸡红细胞的吞噬率和吞噬指数,NK 细胞活性差异均无统计学意义( P >0.05) ( 表4) 。表明 EVATHG 对小鼠碳廓清能力、巨噬细胞吞噬功能及 NK 细胞活性均无影响,试验结果均为阴性。【表4】
2. 6 EVATHG 对小鼠免疫器官病理组织学改变的影响 脾脏: 脾脏被膜完整,组织结构及细胞形态正常,见图 3A。与阴性对照组比较,EVATHG 2. 0 g/kg 组有 2 例小鼠脾中央动脉淋巴鞘增厚,淋巴细胞增生( 图 3B) 。胸腺: 胸腺被膜完整,皮质内胸腺细胞分布正常,淋巴细胞和上皮性网状细胞清晰可见。髓质内可见胸腺小体,未见异常。EVATHG 三剂量组小鼠胸腺组织切片与对照组一致,未见病理改变( 图 3C、图 3D) 。【图3 略】
3 讨 论
免疫系统是机体实现免疫功能的重要系统,由免疫细胞、免疫分子和免疫器官构成,它们协同完成细胞免疫、体液免疫和非特异性免疫功能。当受到抗原刺激后,细胞免疫通过 T 细胞增殖、分化、转化为致敏T 细胞并形成细胞因子来识别和清除异物,发挥免疫保护作用,参与迟发型变态反应。脾淋巴细胞增殖转化功能、迟发性变态反应性是反映细胞免疫功能的基本指标。体液免疫通过产生抗体来对抗抗原物质。一个溶血空斑的形成代表一个抗体生成细胞,溶血素的多少反映抗体的生成量,因此这两个指标能反映机体的体液免疫功能。单核 - 巨噬细胞的吞噬能力的强弱及 NK 细胞活性则代表机体非特异性免疫功能。
兼顾非特异性免疫和特异性免疫,细胞免疫和体液免疫相结合的原则,本次研究采用了反映细胞免疫功能的小鼠脾淋巴细胞转化试验和迟发型变态反应试验,反映体液免疫功能的抗体生成细胞和血清溶血素测定、反应单核 - 巨噬细胞功能的小鼠腹腔巨噬细胞吞噬鸡红细胞试验和小鼠炭廓清实验以及反应自然杀伤细胞活性的 NK 活性测定以及反映免疫器官损伤情况的中枢免疫器官胸腺、周围免疫器官脾脏的病理组织学检查等一组试验,以期从多方面探讨EVATHG 对机体免疫机能的影响,对 EVATHG 的免疫毒性进行初步探索。
本研究表明: 与阴性对照组相比,EVATHG 可明显提高小鼠脾淋巴细胞转化能力、增加小鼠血清溶血素抗体积数值。病理组织学检查未见 EVATHG 对免疫器官脾和胸腺有损伤作用。这与野生型苜蓿组的结果基本一致。但 EVATHG 2. 0 g/kg 组,有少量动物脾中央动脉淋巴鞘增厚,淋巴细胞增生,这可能与EVATHG 的免疫源性有关。
苜蓿中含有皂甙、多糖、异黄酮等多种生物活性物质,这些活性物质会对机体免疫机能产生影响。苜蓿中含有的活性多糖可作为免疫佐剂,有增强免疫功能和抗感染作用,能显着提高 T 淋巴细胞转化率。
刘晴雪等采用体外培养方法,将不同浓度的苜蓿多糖分别加入到用 ConA 刺激的仔鸡外周血、胸腺、脾脏淋巴细胞中,结果表明苜蓿多糖在一定浓度范围内可以促进鸡仔外周血及胸腺和脾脏 T 淋巴细胞的增殖。王丽荣等报道,水溶性苜蓿多糖对艾维茵鸡巨噬细胞吞噬功能影响不显着,但对 T 淋巴细胞转化率有明显的促进作用,对鸡血清中抗体滴度也有增高作用。
苜蓿中含有的异黄酮亦属于植物源免疫调节剂,具有提高机体的免疫力的生物活性作用。韩彦彬等研究发现苜蓿异黄酮能明显刺激小鼠脾淋巴细胞增殖,以及提高小鼠血清溶血素水平。龙锐等也研究了异黄酮对小鼠生长和免疫功能的影响,结果显示苜蓿异黄酮可以显着促进小鼠 T 淋巴细胞的增殖。
上述研究结果说明,EVATHG 的对小鼠体液免疫及细胞免疫存在一定的影响,这种影响与野生型苜蓿对照组的实验结果一致。提示 EVATHG 对小鼠脾淋巴细胞转化能力增强作用及血清溶血素抗体积数值提高作用,很可能与苜蓿本身含有的苜蓿多糖、异黄酮等活性成分有关,而与转入的外膜小蛋白( S) 及中蛋白( S2&S) 抗原基因无关。
综合上述,EVATHG 对小鼠的细胞免疫和体液免疫功能无抑制作用,对单核 - 巨噬细胞功能和 NK 细胞活性也没有影响,但与野生型苜蓿相同对 T 淋巴细胞的增殖、血清溶血素抗体水平有增强和提高作用。在本实验条件下,可初步认为 EVATHG 不会引起免疫系统功能的损害,未见有明显的免疫毒性。
参考文献
[1] Ganem D,Prince AM. Hepatitis B virus infection natural history andclinical consequences[J]. N Engl J Med,2004,350 ( 11 ) : 1118 -1129.
[2] Gomaa AI,Khan SA,Toledano MB,et al. Hepatocellular carcinoma:epidemiology,risk factors and pathogenesis[J]. World J Gastroen-terol,2008,14( 27) : 4300 - 4308.
[3] Kumar GB,Ganapathi TR,Bapat VA,et al. Production of hepatitis Bsurface antigen in recombinant plant systems: an update[J]. Biotech-nol Prog,2007,23( 3) : 532 - 539.
[4] 夏勇,张双凤,于村,等. 转乙肝抗原蛋白基因苜蓿毒理学安全性的研究[J]. 中国现代应用药学,2011,28( 8) : 696 -701.
[5] Zhang H,Huang Q,Su J,et al. Development of Alfalfa( Medicagosativa L. ) Regeneration System and Agrobacterium - Mediated Genet-ic Transformation[J]. Agr Sci China,2010,9( 2) : 170 - 178.
[6] 张金波,祝建波,陈创夫,等. 转基因苜蓿口服疫苗的研究和应用[J]. 生命的化学,2007,27( 4) : 355 -357.
[7] 章学东,金明升,钱定海,等. 转基因苜蓿的常用方法与研究进展[J]. 浙江畜牧兽医,2005,30( 1) : 11 -13.
在全球女性恶性肿瘤中,宫颈癌发病率位居第二位,仅次于乳腺癌;尖锐湿疣是国内排名第三的性传播疾...
CD4是T细胞表面抗原分子,当T细胞被激活时会出现磷酸化和细胞内化作用[1].传统观点认为,通过抗原递呈细胞(antigen-presentingcells,APC)的激活作用,CD4+T细胞主要分化为Th1或Th2细胞,产生不同的细胞因子[2].2006年,Veldhoen等又发现了新...
有研究表明,情感与应答机制通过心理-免疫通路的高度相互依存来实现,而免疫和内分泌系统也受到包括脑在内的中枢神经系统(CNS)的调节。...
创伤后应激障碍(PTSD)是症状及后果严重的应激相关类精神障碍。因时代特点而高伴发、共病多且难治,成为关注的焦点。但其发病机制尚不十分清楚,目前认为,神经内分泌及免疫的改变是其它器官改变的先导和基础,应激状态下上述的变化错综复杂,相互影响作用。目前...
应激是指机体在各种内外环境因素及社会、心理因素刺激时所出现的全身性非特异性适应反应。大量研究表明,产前应激会影响子代的免疫功能,但是具体机制是非常复杂的。人体的免疫细胞包含很多,目前的研究表明,与产前应激有密切关系的主要有T淋巴细胞、B淋...
miRNA是一种长度短的非编码调控单链小分子RNA, 长度一般为21—22个核苷酸, 在生物体内具有较大的调控功能, 很多miRNA对免疫机能有重要的调节作用。...
抗原提呈细胞(antigen presenting cell,APC),通过准确的特异性T淋巴细胞识别,对T淋巴细胞的MHC识别,抗原肽复合物、刺激分子等。...
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)感染引起的以呼吸系统感染为主的慢性感染性疾...
细胞死亡和增殖之间的平衡是生物体生长,发育的重要条件之一,而这种平衡的打破也是很多疾病产生的原因。过度的细胞死亡会导致炎性反应性或退行性疾病的发生。过去传统观念认为,细胞坏死和细胞凋亡是细胞死亡的两种主要方式。但是,随着对细胞死亡机制的不...
人类免疫缺陷病毒(HumanImmunodeficiencyVirus,HIV),它造成人类免疫系统的缺陷.它是一种感染人类免疫系统细胞的慢病毒,属反转录病毒的一种.HIV感染者要经过数年、甚至长达10年或更长的潜伏期后才会发展成艾滋病患者,因机体抵抗力极度下降会出现多种感染,如带...