摘 要: 热力学第二定律也被称为熵增加原理, 是热力学中, 也是物理学中的一个重要的基本规律.基于人教版高中物理中热力学第二定律的内容, 对热力学第二定律的内容和发展建立过程进行探索, 以提供更多的学习材料, 来帮助学生对热力学第二定律有全面的认识, 拓宽学生的视野, 认识物理学规律建立的曲折过程.
关键词: 热力学第二定律; 熵增加原理; 麦克斯韦妖;
基于人教版《高中物理·选修3-3》热力学第二定律的内容, 为了使学生和教师有更多的学习素材, 对热力学第二定律能进一步的认识和学习, 本文对热力学第二定律和熵增加原理的内容和发展建立过程进行探索.
1 热力学第二定律与熵增加原理内容
1.1 热力学第二定律
热力学第二定律是一个比较特殊定律, 它是反映宏观自然过程的方向性的定律, 也是一个少有的以否定句的形式来表述的定律.它具有两种常见的表述形式, 即:克劳修斯表述和开尔文表述.开尔文实际就是威廉·汤姆孙, 他在热力学方面有很深的研究, 本来有可能成为第一个发现热力学第二定律的, 但是由于受到“热质说”的束缚, 没能首先发现.于1850年克劳修斯首先提出:“不能把热从低温物体传给高温物体, 而不引起其他变化.”迟后一年, 于1851年开尔文又提出:“不能从单一热源吸取热量, 使之完全变为有用的功而不引起其他变化”[1].其中克劳修斯表述说明热量从低温物体传给高温物体时, 必然会引起其他的变化, 指明了热量不能自发的从低温物体转移到高温物体.开尔文表述有时候也被称为开尔文-普朗克表述, 表明了机械能与内能之间的转化过程当中的方向性问题, 内能不可能完全转化成为机械能, 因为现实的生活中并不存在效率为100%的热机, 内能在转化为机械能时一定会出现热量的耗散问题, 耗散的能量无法回收, 无法再利用, 所以内能无法完全转化为机械能.虽然如此, 由以上分析可知, 能量并没有消失, 热力学第二定律并不违背能量守恒定律.
1.2 熵增加原理
熵的概念广泛地出现在各个领域当中, 信息领域、生物学领域也有熵的概念, 熵不再是物理学的专属概念.然而熵是克劳修斯于1865年提出的用于描述热力学状态的一个概念, 在人教版高中教科书《物理·选修3-3》中熵的含义可以简单地理解为熵较大的宏观状态无序程度较大, 也就是统计学中出现概率较大的状态, 宏观状态对应着微观状态的数目, 即微观态数.玻尔兹曼给出了熵与微观态数成正比的关系, 即S∝LnW或S=kLnW (其中S是熵, W微观态数, k玻尔兹曼常量) , 此公式也称为熵的玻尔兹曼公式.那么对于自然过程的方向性, 又可以用熵的概念表述成:在任何自然过程中, 一个孤立系统的总熵不会减小.用熵的概念表述热力学第二定律, 熵不会减小, 因此才有一些学者将热力学第二定律又称为熵增加原理.这个原理表明:一个孤立的系统在自发的宏观自然过程中熵是增加的, 但是并不排除在微观个体上出现熵减少的可能.
无论是热力学第二定律的克劳修斯表述, 还是开尔文表述, 以及从熵的概念来描述的热力学第二定律的内容 (熵增加原理) , 它们都是描述了自然过程的方向性和不可逆性的.
1.3 熵增加原理的数学表达
热力学第二定律和熵增加原理都揭示了宏观自然过程的方向性, 但是, 二者也有不同.如果说前者是对热力学系统中宏观过程的转化方向进行了定性的描述, 那么后者则是给出了定量描述.1865年克劳修斯提出了热力学第二定律的另一种表述, 找到了一种数学方法来表示可逆与不可逆循环过程中总熵的变化.将TQ称为热温比, Sa, Sb用来表示初、末状态的熵.

从而引出态函数熵.从初状态a到末状态b的任何可逆过程的热温比之和都等于初、末状态的熵的差值
而可逆的准静态元过程的熵变化为
来看, 其积分的不可逆循环过程曲线中, 一定有部分或全部过程是不可逆的非准静态过程, 我们假定这个不可逆循环过程曲线中aⅠb部分为不可逆过程, 而bⅡa为可逆过程.那么, 克劳修斯不等式可以具体的写成
图1 不可逆循环过程
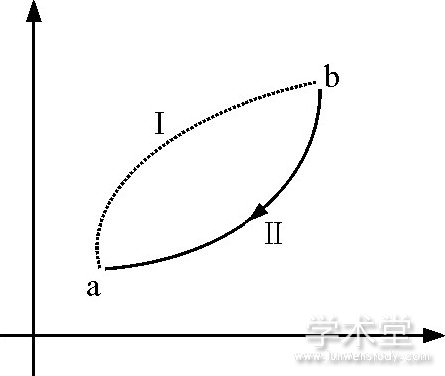
不可逆过程热温比之和遵循这个表达式, 任何不可逆过程的热温比之和都会比初、末状态的熵差小.如果把熵的定义式
与上式综合起来, 则任何一个过程都满足
那么, 可以说是不可逆过程的热温比之和始终比初、末状态熵差小, 可逆过程的热温比之和始终与初、末状态的熵差相等.对于绝热过程 (dQ=0)
表明绝热过程熵是不可能减少.
由此来讲, 对于不能同外界进行物质和能量交换的孤立系统来说, 自然同外界绝热, 所以说孤立系统内发生的一切热过程都不会使系统内的熵减小.或者说孤立系统内的可逆过程不改变系统的熵, 不可逆过程使系统内的熵增加, 然而自然界发生的热过程都是不可逆的, 所以可以得到结论:孤立系统内发生的一切实际热过程都是使系统的熵增加的过程, 即熵增加原理[2].
2 热力学第二定律的质疑
热力学第二定律与热力学第一定律一起组成了热力学的基础, 使热力学建立起了完整的理论体系, 并成为了物理学的重要组成部分.任何一个理论的建立都不是一帆风顺的, 它也经受过很多次的质疑和错误的应用.热力学第二定律可以说是一个描述比较“狡猾”和“小心翼翼”的定律.其中的“其他变化”并没有指明是什么变化, “一个孤立系统”把该定律的使用条件限定在了一个特定的范围之内, 但是, 众多人在对热力学第二定律的研究过程中也提出过质疑, 也给它出了难题.
2.1 麦克斯韦“妖”
麦克斯韦“妖”是一个形象而有趣的小妖怪, 它没有很高的本领, 不是像神话片里那样呼风唤雨、上天入地、法力无边的灵怪, 只是它具有非凡的分辨能力.实际上这是麦克斯韦在研究热力学第二定律的时候进行的理想实验中假想的一个角色, 但是却是一个深入人心的角色.当时在研究热力学第二定律的时候, 麦克斯韦提出了这样一个反例, 用一块隔板把一个装满气体的箱子分成A和B两个部分, 隔板上有一个可开启的小孔, 能够通过分子.麦克斯韦设想了一个可以分辨分子运动的小妖怪, 让它站在小孔旁边操作开关, 当A中有速度快的分子飞来时, 就关闭小孔不让通过, 同时, 对于从B飞来的速度快的分子不让通过, 而慢速的分子飞来时打开小孔让其通过飞往A, 这样A中的分子平均动能减少, B中分子平均动能增加.因为温度是分子平均动能的标志, 这样做的结果使原本等温的A和B两部分逐渐出现温度差, 而且温差会越来越大.于是违背热力学第二定律的事情发生了:内能从低温部分A流向了高温部分B, 而且伴随这一现象并没有做功, 只有这个小妖精指挥的作用.那么这个理想实验是否就真的违背了热力学第二定律呢?
对于这个理想实验的解释最有说服力的应该属于“信息论”的解释.事实, 麦克斯韦妖使内能从低温物体A流向了高温物体B, 这是一个熵减少的过程, 然而麦克斯韦“妖”要做到这个, 他需要辨别分子的速度, 就要用光照射分子, 光反射回眼睛, 在进入大脑进行分析判断, 大脑再指挥手去开关小孔, 这伴随着热产生的做功过程是一个熵增加的不可逆过程, 这两个过程的总效果是一个熵增加的过程, 那么对于这个实验的系统而言这是一个熵增加的过程[3], 也就是说这个小妖精即便真的存在也不违背热力学第二定律.
2.2 热寂说
“热寂说”是克劳修斯在晚年的时候提出的.克劳修斯的熵增加原理是在孤立系统的环境下成立的一个原理, 揭示了自然过程是向着熵增加的方向进行的, 并且是不可逆的.但是, 他却将该原理推广到整个宇宙, 得出了宇宙的“热寂说”.克劳修斯在1865年的演讲中, 把熵增加原理应用到了整个宇宙当中, 得出了“宇宙的熵趋于一个极大值”的结论.接着在1867年的演讲中指出:宇宙的熵越接近其熵的极大值的极限状态, 它继续发生变化的几率就会越少, 若是宇宙完全达到了这样的状态, 它就不会再出现进一步的发展变化, 宇宙便处在一个静止的永恒状态.
热寂说的提出受到了不少科学家的指责和批评, 他们认为地球上通过实验得到的规律推广到无限、开放的宇宙中是不可取的, 犯了形而上学上的错误.后继的科学发展也提供了大量的事实证明宇宙演变的过程并不遵循这一结论[4].“热寂说”研究对象并不符合热力学第二定律的使用条件, 用它得出的这个结论也必然是错误的, 世界是一个开放的系统, 宇宙更是一个无限大的开放系统, 它们是在不断的发展、运动和变化着的.错误的结论自然也不能否定热力学第二定律.
2.3 生物进化
熵增加原理认为一个孤立的系统变化将向着熵增加的方向发展, 也就是事物的发展从有序向着无序的方向发展.但是达尔文的生物进化论却认为地球上的生物物种从少到多, 从简单到复杂, 呈现从无序到有序的进化趋势.熵增加原理与生物进化论都是在实际规律中总结出来的科学规律, 都是可信的, 那么二者是不是相互违背呢?1977年诺贝尔化学奖获得者普里高津提出的耗散结构理论可以给出解释.按照耗散结构理论, 一个系统的熵由两部分组成, 其一是系统自身因不可逆过程引起的熵 (dis) , 永远是正的, 其二是系统与环境交换物质和能量引起的熵 (dcs) , 它可正可负.所以系统熵的变化dS=dis+dcs也就是可正可负的.对于孤立系统而言, 因为没有与外界能量物质的交换, dc=0, 则dS=dis>0, 因而熵总是增加的, 由有序走向无序;而对于开放的生物系统而言, 存在与外界环境的物质与能量的交换, 只要从环境中流入的负熵足以抵消系统自身的熵的增加, 就可以使系统的总熵减少, 从而从无序向着有序发展进化.生物进化与熵增也并不矛盾, 生物是不断成长的, 不断的与周围的环境发生物质和能量的交换, 因此不能对热力学第二定律提出否定[5].
3 结束语
熵增加原理是在科学家们的质疑和论证中建立起来的, 并且也经受住了质疑和考验.理论上, 热力学第二定律和熵增加原理都指明了自然界中宏观的自然现象的变化的方向问题.只是熵增加原理是从微观的角度提出熵的概念来描述热力学第二定律所表现的宏观状态, 并且给出了定量的数学关系.从发展建立的过程来看, 热力学第二定律也同其他理论一样, 在艰难的环境中发展进步, 在质疑和论证中建立和完善.我们的学生也应该像科学家一样, 勇于对一些观点提出质疑, 善于思考, 勤于探索.
参考文献:
[1]王楚, 李椿, 徐安士.热学.北京:北京大学出版社, 2000.132
[2]张玉民.热学.北京:科学出版社, 2006.103~104
[3]仲扣庄.物理学史教程.南京:南京师范大学出版社, 2009.117~118
[4]郭奕玲, 沈慧君.物理学史 (第2版) .北京:清华大学出版社, 2005.65~66
[5]颜振珏.物理学史新编.贵阳:贵州科技出版社, 2002.82
热力学第二定律是人类社会以及自然界中一个普遍适用的规律,主要体现的是不可逆性质,启示我们要尊重自然、顺应自然、不可以违背自然规律。...
我们在高中物理中学习热力学第二定律时, 对其适用范围进行过分析, 通过仔细的辨别, 我们可以发现其适用范围之间存在矛盾之处。于是, 我们可以认为热力学第二定律并不是普遍适用的, 对于这项定律, 我们需要进行再思考。...
本文能够使同学们明确热力学判据的发展过程及其适用的条件, 理解物理化学处理问题的思想, 即从实践上升到理论, 再用理论来指导具体实践, 增强同学们学习物理化学的信心。...
在热力学中, 人们通常是把热力学第二定律发展成特定体系的热力学判据。本文主要回顾总结了热力学第二定律的提出、表述形式、数学表达式及其在具体体系中的应用。...
实际上, 传统的熵增定律是在忽略了万有引力的基础上得到的, 而在天体级别的大范围内, 万有引力起到了非常大的作用, 这时候引力作用将使得热力学第二定律得出的熵增定律不再一定成立。本文将设计一个理想实验证明之。...
熵在热力学于统计物理学中有着举足轻重的地位, 可以用熵描述某一个过程是否可以, 例如对于孤立系统绝热过程, 可逆过程熵不变, 不可逆过程熵增加, 因此我们可以根据熵变大小判断未知的过程是否可逆。...
我们都知道,永动机是不可能制成的,这是因为它违背了能量守恒定律,尽管从古至今有很多科学家都在不断研究新的方法进行理论体系的构建,但是物体始终不可能在不发生任何变化的情况下让热量从提问物体传导到高温物体,也不可能将单一热源在吸收的热量不发生...
化学是高校工科学生必修的一门重要的基础课,是自然科学中的一门重要学科,是研究物质的组成、性质与变化的科学。在化学中所揭示的自然变化的基本规律,是对学生进行课程思政教育的最佳选择。...
基于人教版《高中物理·选修3-3》热力学第二定律的内容, 为了使学生和教师有更多的学习素材, 对热力学第二定律能进一步的认识和学习, 本文对热力学第二定律和熵增加原理的内容和发展建立过程进行探索。...