摘 要: G蛋白偶联受体50(G protein-coupled receptor, GPR50)是属于G蛋白偶联受体(G protein-coupled receptors, GPCRs)超级家族的一类跨膜蛋白,与Mel1c受体同源,介导跨膜转运和信号传递,在神经系统发育、能量代谢调节及糖皮质激素受体信号等多种生理活动中发挥重要作用,同时也是阿尔茨海默病、肝癌等疾病的潜在生物学标志物,阐明GPR50的生理功能有助于为相关疾病治疗的进展、预后和发展提供可能方向.近年来,随着GPR50潜在作用不断被发现,其涉及的生理功能也不断被拓宽.详细介绍了GPR50的分子结构特征,总结了近年来GPR50的生物学功能研究进展,为GPR50的进一步研究提供参考.
关键词 : GPR50;跨膜蛋白;信号传递;生物标志物;
Abstract: G protein-coupled receptor(GPR50), a kind of transmembrane protein, belongs to G-protein coupled receptor(GPCRs) family. It is homologous to the Mel1 c receptor and mediates transmembrane transport and signal transduction. Besides, it plays an important role in the development of nervous system, regulating energy metabolism and glucocorticoid receptor signaling, and is seen as a potential biomarker for diseases such as Alzheimer's disease and liver cancer. Therefore, identifying the physiological function of GPR50 can provide insights for the prognosis and treatment of related diseases. In recent years, with the discovery of potential effects of GPR50, its physiological functions have been broadened.This study sheds light on the molecular structure of the GPR50 and discusses the recent research on its biological function to provide a basis for the research on the GPR50.
Keyword: GPR50; transmembrane protein; signal transmission; biomarker;
G蛋白偶联受体是人类基因组中发现的最大的超家族蛋白之一,具有7个跨膜螺旋,在细胞信号传递中起着关键作用,拥有广泛的生理功能[1,2].GPCRs又称7TM生成蛋白,是细胞表面受体中最丰富的一类,约有800个成员. GPCRs也是主要的药物靶点,占目前上市药物的30%[3].GPCRs有可能与自身(同质异体)或其他受体(异体)相互作用[4],在这些异质复合体中,经常可以观察到一个分子与另一个分子之间的别构调节.大约100个GPCRs仍然是孤蛋白受体,到目前为止还没有发现内源性配体[5,6].
GPR50又名H9,是G蛋白偶联受体家族成员之一,是位于x染色体(Xq28)上的完整膜蛋白编码基因[7],该受体与褪黑色素受体1和2密切相关,与人褪黑素受体MT1和MT2的同源性为45%,与跨膜区相比,同源性提高到55%.可与两种亚型结合形成异二聚体.然而,GPR50不能结合褪黑激素结合,没有已知配体,仍然是孤蛋白受体[8].GPR50在多种物种表达,在大脑内广泛表达,包括垂体、下丘脑和海马[9],以及内侧视前区、外侧隔、下丘脑外侧区、终纹床核、终板血管器和杏仁核等多个区域[10],同时在肝细胞[11]、子痫前期的胎盘内均有表达[12].另外,在本课题组研究中对 GPR50 在牦牛、小鼠及兔的组织的分布做了相应检测,GPR50 除在脑组织具有高表达外,在卵巢及睾丸组织也有较高的转录水平(未发表数据).
近年以来,GPR50的新功能逐渐被发现.本文综述了GPR50的生物学特征、信号转导模式以及生物学功能,包括与褪黑素之间的作用,以及在大脑神经的分布表达和参与影响的各类精神疾病,总结了GPR50在多种生理活动中的作用.
1 、生物学特征
人类GPR50基因定位于Xq28,小鼠GPR50基因位于X染色体的近端部分.这两个物种基因都被发现是X连锁的[13],同时,GPR50具有α-螺旋二级结构和随机线圈无序构象[14],由617个氨基酸组成,含有7TM疏水片段.GPR50的主要特征包括300多个氨基酸组成的长C尾,在氨基端或预测的胞外环中都没有连接糖基化的N端[9],在第2外显子有3个多态性位点[15,16,17] .1:Δ 502–505对应于在502位点插入/缺失Thr-Gly-His(TTGH)4个氨基酸(Δ502-505变异体),2:Thr532Ala对应于Thr(T)替换Ala(A)在532位;3:Val606Ile对应于Val(V)取代Ile(I)的606位.GPR50的C端结构域有两种自然存在的形式,主要不同于存在长度为617和613个氨基酸的4个氨基酸(TTGH,氨基酸残基502-505)分别称为TTGH和DTTGH[18](如图1).GPR50具有一种新的信号转导模式,是依赖于其羧基C末端结构域(C terminal domain, CTD)的核转位.在Phe-408和Ser-409之间跨膜结合的GPR50核心区中,CTD的钙依赖的钙蛋白酶蛋白酶裂解被激活.胞质CTD随后在其‘DPD’基序的辅助下移位到细胞核,进一步与通用转录因子TFII-I相互作用,调节c-fos基因的转录[19].
GPR50基因在主要灵长类谱系中仍然经历了强烈的进化选择,GPR50除CTD区外,在灵长类进化过程中是极其保守的.CTD区域发现了大量的插入或缺失,这意味着该区域可能在灵长类GPR50进化过程中发挥关键作用[20].值得注意的是,关于GPR50在用于产生兔抗体的4个表位中,只有表位3(439KPASVHFKGDSVHF-KGDSVHFK454)和表位4(601VVDVEDDPDEMAV613)产生了特异性识别高亲和力的GPR50的多克隆抗血清.这些抗体允许在免疫印记、免疫荧光和免疫组织化学实验中对人和啮齿动物GPR50进行特异性标记.利用这些抗体,显示了GPR50的膜定位[9].
图1 GPR50 蛋白结构模型图
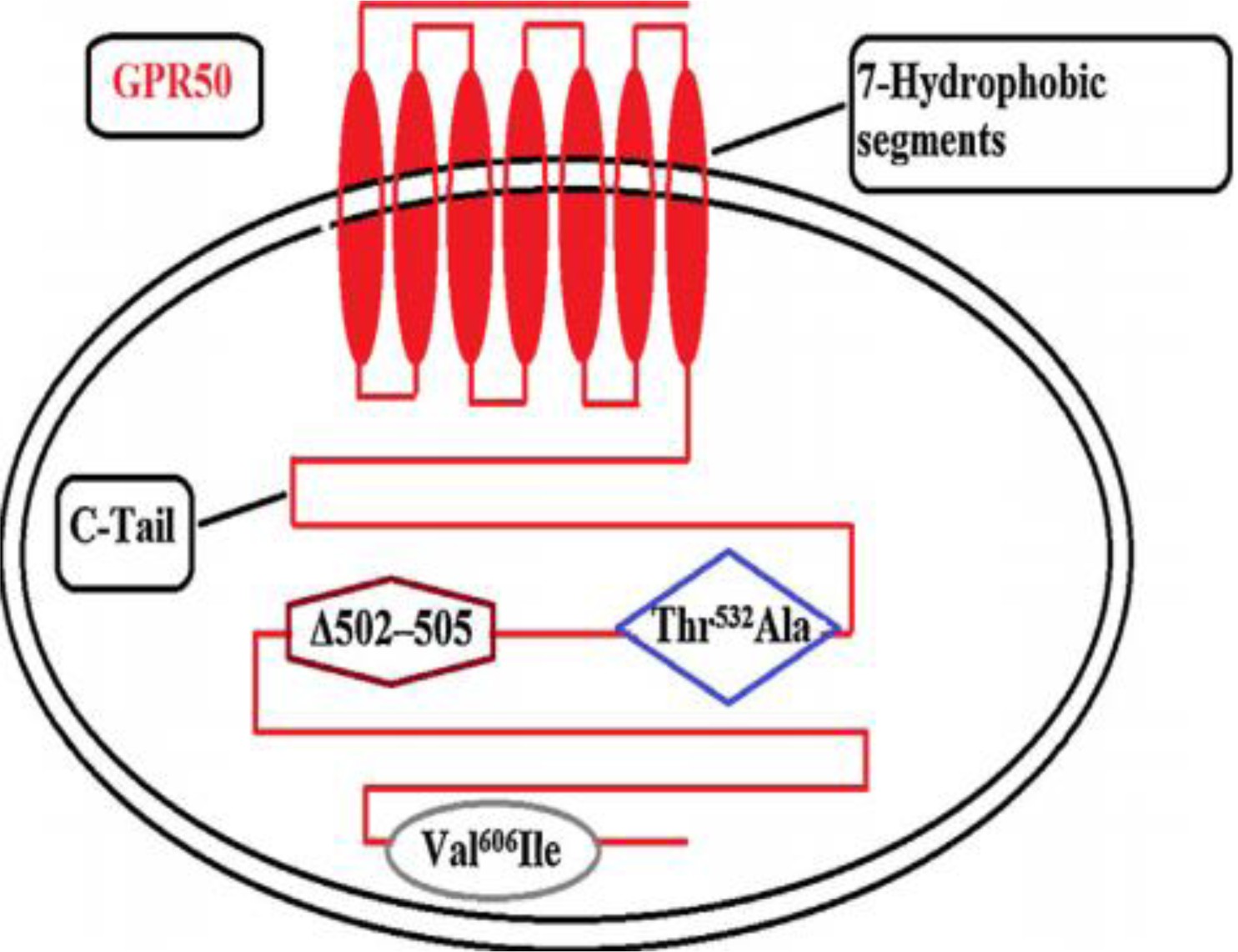
Fig1 Structural model of GPR50 protein
2 、GPR50的生物学功能
2.1 、GPR50与褪黑素受体相互作用
褪黑素受体是G蛋白偶联受体家族的成员,其受体亚科包含三个成员MT1(或Mel1a或MTNR1A)、MT2(或Mel1b或MTNR1B)、Mel1c(或MTNR1).其中Mel1a、Mel1b在所有脊椎动物均有发现.Mel1c只存在于鱼类、非洲爪蟾和鸡,但不存在于哺乳动物.而已经失去结合褪黑激素能力的GPR50,只有哺乳动物有[22,23],被确定为与褪黑激素相关的受体.因为它与褪黑素受体MT1和MT2有45%的同源性[24].
研究证实了GPR50是高亲和力Mel1c受体的同源基因,GPR50基因编码的受体不与褪黑激素结合,但影响该激素与同源的MT1受体二聚后的相互作用[25],其过程GPR50与MT1和MT2结合形成异二聚体,导致对褪黑色素MT1的抑制,而不是MT2[26].在非哺乳动物物种中发现的高亲和力褪黑激素受体Mel1c存在于哺乳动物物种的基因组中,并被命名为GPR50.通过大量关键氨基酸的突变和长c端尾部的添加,这种受体已经被广泛地重塑.这导致了GPR50对褪黑激素的亲和力下降,并可能影响了它与哺乳动物两种功能性褪黑激素受体MT1和MT2的相互作用.需要进一步的研究来确定GPR50的生理作用.而Mel1c迅速进化为GPR50与松果体的生理作用的变化有关[25],但是Mel1c的功能意义及其向GPR50的演变尚不清楚,GPR50的生理调节和功能仍不清楚.
2.2 、GPR50在脑中的表达
GPR50在多种物种的大脑中均有表达,研究表明,GPR50在人脑的不同区域普遍表达,包括垂体、下丘脑和海马的中间部[9].Batailler等人利用特异性GPR50抗体分析了GPR50在绵羊、大鼠和小鼠全脑中的神经解剖学分布.他们观察到GPR50阳性细胞广泛分布在绵羊、大鼠和小鼠全脑的不同区域,包括下丘脑和垂体结节部.在啮齿动物中,免疫组织化学研究揭示了GPR50蛋白更广泛的分布模式.在内侧视前区、外侧隔、下丘脑外侧区、终纹床核、终板血管器和杏仁核多个区域观察到GPR50免疫反应阳性.此外,在大鼠脑内,GPR50蛋白定位于背侧海马CA1锥体细胞层.在小鼠的穹窿下器官中也发现了中到高数量的GPR50阳性细胞[10].Grunewald等人研究了GPR50在小鼠脑内的发育表达,发现GPR50表达于胚胎第13天(E13),高峰在第18天(E18),主要由神经元表达.还发现了GPR50表达的新区域,包括参与神经递质信号传递的脑干核:蓝斑、黑质和中缝核,以及参与代谢稳态的核[27].随后, Li等人检测了GPR50在成年雄性小鼠神经中的分布,GPR50定位于齿状回的CA1-3锥体细胞.GPR50在兴奋性和抑制性神经元中也有表达.由于抑制神经元也有多种类型,GPR50定位于部分中间神经元,与钙结合蛋白,钙网膜蛋白和小清蛋白共表达.另外,在大脑皮层也发现了类似的结果.GPR50在海马和大脑皮层的广泛表达表明,GPR50可能与突触可塑性和认知功能有关[28].
2.3 、GPR50在神经细胞中的作用
GPR50敲除导致小鼠海马区钙网膜蛋白(Calretintin, CR)阳性中间神经元数量明显增多,以及皮层锥体神经元的顶树突方向紊乱[29].而GPR50在神经细胞中的过表达增加了分化的神经筛板-1细胞的轴突长度、丝状和板层脂质样结构[18].提示其GPR50在神经发育中起重要作用.
研究表明,GPR50在胚胎脑心室区的神经祖细胞(Neural progenitor cells, NPCs)表达.用小干扰RNA(SiRNA)敲除GPR50可降低NPC的自我更新和神经元分化,但不降低神经胶质分化.此外,GPR50的全长或GPR50的胞内结构域的过度表达,增加了神经元的分化,该结果表明GPR50以细胞内结构域依赖的方式促进NPC的神经元分化.而GPR50过表达抑制HES1基因上Notch细胞内结构域的转录活性.在GPR50siRNA转染的NPC中,转录因子7样2(TCF7L2)mRNA水平降低,提示GPR50的敲除会损害WNT/b-catenin信号转导.此外,通过敲除GPR50,降低了NPC中神经基因(Ngn)1、Ngn2和cyclinD1(Notch和WNT/b-catenin信号的靶基因)的mRNA水平. 因此,GPR50可能通过调节Notch和WNT/b-catenin信号来促进NPCs的自我更新和神经元分化[30].NPC是在中枢神经系统中产生神经元、星形胶质细胞和少突胶质细胞的自我更新和多能性细胞[31] ,NPC通过增殖,分化,迁移,最终整合进神经网络.任何这些过程中的异常都会导致大脑功能障碍,并导致神经系统疾病[31].这也说明了GPR50与抑郁症、情感性障碍和阿尔茨海默病等精神疾病有关
另外,GPR50 在离体培养的神经前体细胞上也有表达,并能促进神经前体细胞的增殖,分化为深层神经元以及自我更新[33].siRNA干扰GPR50后, 降低了神经前体细胞TCF7L2Ngnl, Ngn2和cyclin D1的表达水平,Hesl水平升高,提示GPR50可能通过调节Notch和WNT/b-catenin信号来促进进神经前体细胞的自我更新和分化增殖,这与在神经祖细胞中的研究一致[34].
2.4、 GPR50与精神疾病
2.4.1、 GPR50与阿尔茨海默病(Alzheimer’S disease, AD)
有研究证明,GPR50是AD的候选基因,GPR50甲基化与阿尔茨海默病有关,通过焦磷酸测序分析AD患者和对照组GPR50启动子甲基化水平,发现男性AD组GPR50型启动子甲基化水平明显低于男性对照组,AD患者组和健康对照组女性GPR50甲基化水平均显着高于男性,GPR50甲基化与女性AD患者血浆胆碱酯酶呈正相关,这一结果提示了血浆胆碱酯酶相关治疗的靶点,表明外周血GPR50启动子低甲基化可能是诊断中国汉族男性阿尔茨海默病的潜在生物标志物[35].
随后,研究证实GPR50参与AD的病理进展,通过抑制MT1信号转导,延缓AD的病理进展[36].在小鼠模型中,脑中GPR50可与三磷酸腺苷结合盒转运蛋白2(ATP-binding cassette transporter 2,ABCA2)结合[27],而ABCA2与早期以及散发型AD密切相关[37].有研究发现抑制或减少β淀粉样蛋白的产生是目前AD治疗的一个重要方向,而GPR50能通过激活 P-CREB 从而激活自噬,进而促进 BACE1 蛋白转运进溶酶体内并加速蛋白降解,抑制 BACE1 酶活性以及蛋白水平,降低β淀粉样蛋白生成,改善β淀粉样蛋白介导的突触可塑性损伤以及神经炎症,这为治疗阿尔茨海默病提供新的治疗靶点[38,39,40].
2.4.2、 GPR50与季节性情感障碍(seasonal emotional disorder, SAD)
GPR50是SAD的一个有潜力的候选基因.患者经历的“非典型”症状SAD(嗜睡,食欲增加,渴求碳水化合物,体重增加)提示代谢紊乱,可能是由 GPR50功能障碍引起的,因为已观察到一些 GPR50变异体引起的代谢紊乱[17,41].这进一步表明GPR50与SAD之间存在潜在的联系.后续对照研究发现了季节性情绪失调和女性中编码 GPR50的基因内含子(rs2072621)之间的联系.这可能代表了性别特有的风险因素和褪黑激素与 SAD 之间的分子联系[42].
2.4.3 、GPR50与抑郁症
相关研究表明,GPR50它可能是情感障碍(抑郁)的候选基因.一项苏格兰病例对照研究报告了GPR50变异体与三种精神疾病(双相情感障碍、主要抑郁障碍、精神分裂症)之间的女性特异性关联[15].Donald等复制了这项研究,证明 GPR50可能在抑郁症中发挥作用,特别是在女性中[41].关于GPR50变异似乎影响循环血脂水平,而脂质代谢异常常见于抑郁症患者[17].另外,研究表明,GPR50变异体参与晚期抑郁症,这似乎是特定于某些亚组的.数据表明,GPR50变异体与晚期抑郁症之间存在弱的女性特异性关联.然而GPR50作为晚期抑郁症的良好候选基因几乎不受支持[43].
2.4.4、 GPR50与自闭症谱系障碍(Autism Spectrum Disorder, ASD)
GPR50与ASD具有基因相关性[44],用GPR50敲除小鼠与其同窝野生型小鼠做行为学相关实验,GPR50敲除小鼠表现出自闭症样行为,并伴有认知障碍,证实GPR50在自闭症中有重要的作用.有研究表明,GPR50 是作为线粒体自噬受体调控线粒体自噬从而参与ASD的,这种作用是依赖于与 LC3 蛋白结合,而GPR50敲除后,线粒体自噬障碍,在细胞内功能异常的线粒体大量堆积,组织内活性氧上升,从而造成自闭症样行为[45,46].
2.5、 GPR50与乳腺癌
在乳腺肿瘤中,GRP50和I型TGFβ 受体(TβRI)之间的异源二聚体的形成激活了TGFβ 受体的抗增殖作用,从而导致肿瘤生长减慢.从机制上讲,GPR50取代TβRII,并以一种结构性的方式激活下游信号.更确切地说,GPR50通过促进TβRI的自磷酸化和阻止负调控因子FKBP12与TβRI的结合来激活TβRI.后者是由于GPR50和FKBP12通过共同的ATxzHP(x=丙氨酸、苏氨酸、丝氨酸;z=甘氨酸、丝氨酸)基序竞争TβRI结合所致.在功能相关性方面,GPR50在异种小鼠模型中表现出与TβRI相似的作用,表现出过表达后的抗增殖作用,并减少了肿瘤的生长.相反,MMTV/Neu自发性乳腺癌中GPR50的靶向缺失增加了肿瘤的生长,降低了动物的生存机会.此外,在乳腺癌妇女中,无论乳腺癌的亚型是什么,GPR50的低表达都与不良的生存预后相关[47].
目前,关于GPR50-TβRI复合物在其他组织和癌症类型中的潜在相关性以及关于GPR50-TβRI复合物在肿瘤发生或转移的后期阶段的存在和功能“行为”尚不清楚[48].关于TGFβ信号在乳腺肿瘤的发生发展中具有双重功能,在肿瘤发生的早期阶段表现为抑制作用,而晚期的肿瘤细胞在TGFβ的作用下可以逃避抗增殖控制,促进肿瘤进展.检查GPR50在乳腺癌的不同阶段是否具有TGFβ的双重性,或者GPR50是否始终保持保护作用,这将是一件有趣的事情[49].
2.6 、GPR50与肝细胞癌(Hepatocellular carcinoma ,HCC)
HCC是全世界癌症相关死亡的主要原因[50],因此,确定肝癌预后的新的分子生物标志物并阐明肝癌进展的分子机制是至关重要的.有研究发现肝癌中的GPR50被过表达,并证实GPR50通过崩解素和金属蛋白酶金属肽酶结构域17(ADAM17),这是一种切割Notch受体的蛋白水解酶,作为配体无关的方式失活Notch信号,从而减少肝癌的进展.此外,GPR50沉默会通过AKT/特异性蛋白-1(SP1)信号轴下调ADAM17的转录和翻译.值得注意的是,GPR50被发现与ADAM17直接相互作用. 总之,这是展示了一种新的GPR50介导ADAM17-Notch信号通路的调控,它可以为基于Notch的HCC治疗策略的进展、预后和发展提供见解[11].
2.7 、GPR50与子痫前期( pre-eclampsia, PE)
虽然GPR50的功能仍然知之甚少,但一些观察与PE的病理有关. 首先,GPR50在模型滋养层细胞系、HT R-8/SVneo细胞和PE胎盘上的存,这在与先前在胎盘中发现的GPR50相一致[12]. 第二,由于PE相关抗体是IgG1亚类,促进补体激活,与GPR50的抗体结合可能有助于PE胎盘中观察到的补体沉积[51,52].通过二聚化,GPR50抑制MT1[26],而褪黑素在胎盘中表现出保护作用[53]并有助于调节血压[54].此外,GPR50突变与甘油三酯水平升高有关[17] ,并且高脂血症常常先于 PE 表现[55].综上所述,这些观察表明EB病毒(Epstein-Barr virus, EBV)诱导的GPR50自身抗体对PE病理具有潜在的影响,并表明未来的研究应该被设计来研究这个问题.
而子痫前期妇女在EB病毒核抗原1(Epstein-Barr Nuclear antigen, EBNA-1)中出现IgG1滴度升高的肽表位KRPSCIGCK. EBNA-1表位抗体与人G蛋白偶联受体GPR50细胞外N末端的类似表位交叉反应,在人胎盘组织和永生化胎盘滋养细胞中表达.EBNA-1肽可有效阻断PE相关抗体与GPR50表位的结合.揭示了EBNA-1和胎盘GPR50之间存在分子模拟,支持IgG1在子痫前胎盘中沉积的机制[56].
2.8、 GPR50与Tip60蛋白相互作用调节糖皮质激素受体信号
Tip60是一种具有组蛋白乙酰转移酶(histone acetyltransferase, HAT)活性的转录共激活因子,参与转录、DNA修复和凋亡的调节[57,58].有研究揭示了GPR50通过与Tip60相互作用在糖皮质激素受体信号传递中的新方式.这种相互作用在酵母双杂交筛选中得到确认,并通过在HEK293细胞中Tip60和GPR50免疫共沉淀和共定位得到了证实.一种有趣的可能性是,GPR50的细胞内尾巴在细胞外(或细胞内)信号的响应下被特异性地切割,释放它与Tip60结合并移位到细胞核[18,59](图2).总之,GPR50通过糖皮质激素受体(Glucocorticoid receptor, GR)信号转导途径调控Tip60的转录活性.并且,GPR50对GR信号的功能影响在基因敲除的垂体细胞中得到支持.
图2 GPR50在GR信号中的作用
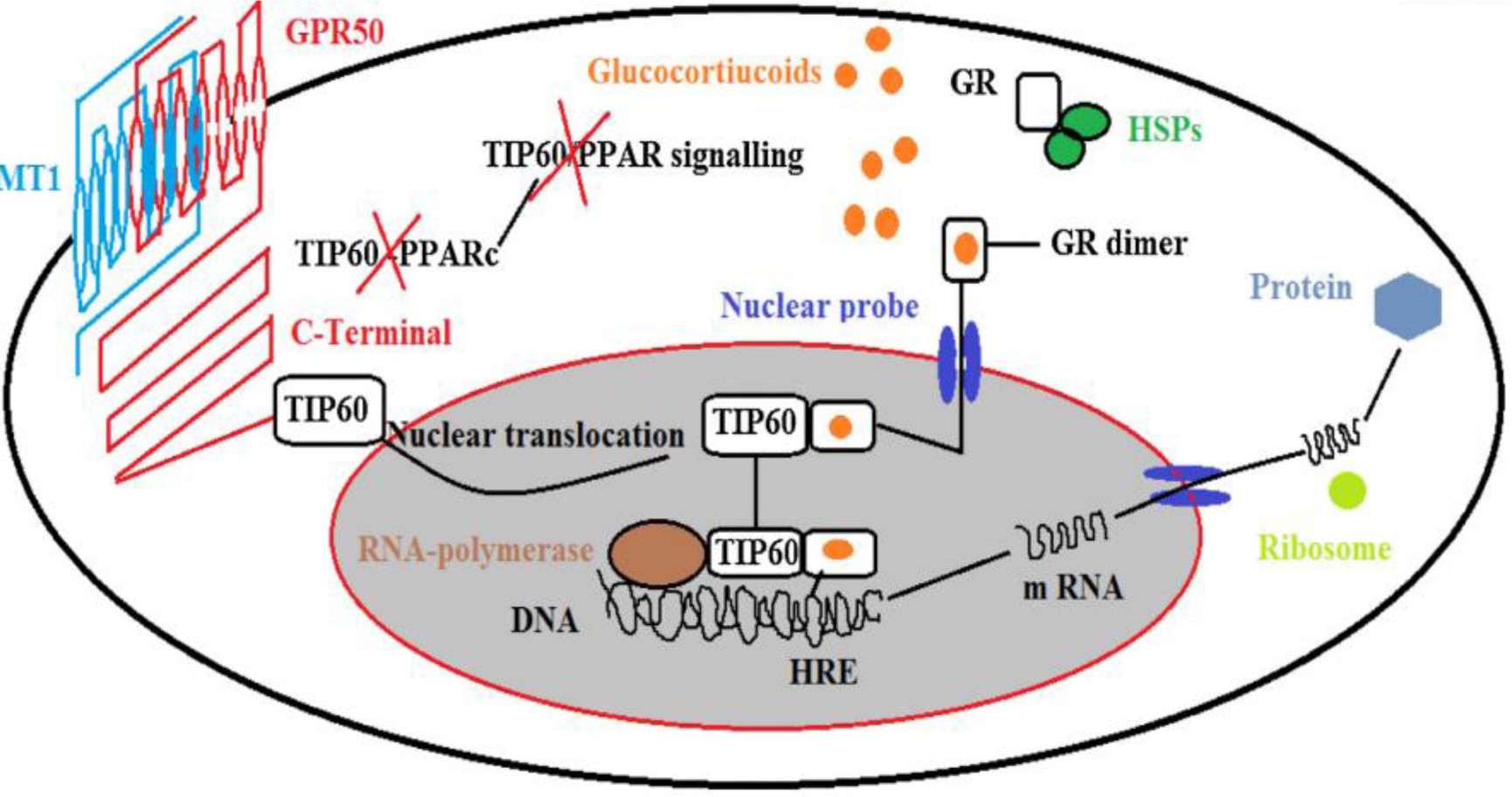
Fig2 The role of GPR50 receptor in GR signaling
2.9、GPR50与能量代谢
GPR50的基因在下丘脑核中高度表达,涉及体重和代谢的控制.对与肥胖有关的褪黑素相关受体包括GPR50进行突变筛选,并鉴定了四种常见的变异.发现这些单核苷酸多态性与空腹甘油三酯水平有惊人的相关性.有研究表明,这种孤儿受体在调节脂质代谢方面发挥了先前意想不到的作用,值得进一步研究.随后,有研究证实了GPR50是能量代谢的重要调节因子[17].研究通过将 lacZ 基因插入到 GPR50编码序列中,缺乏功能性 GPR50的小鼠表现出代谢表型的改变.保持正常食物的 GPR50基因敲除小鼠在10周龄时体重显着低于年龄匹配的野生型同窝小鼠.此外,基因敲除小鼠对饮食诱导的肥胖有部分抵抗力.当给基因敲除小鼠喂食高能量饮食5周时,基因敲除小鼠比野生型小鼠每单位体重消耗的食物明显更多,但体重增加减少,脂肪含量降低.车轮运动记录显示,GPR50基因敲除小鼠虽然没有昼夜节律变化,但在夜间和昼夜节律中,总体活动水平显着高于野生型.与此相一致的是,在基因敲除小鼠中发现基础代谢率(氧气消耗量,二氧化碳产生量和呼吸商)升高.利用原位杂交(野生型小鼠)和β-半乳糖苷酶活性(插入LacZ 的基因敲除小鼠),发现 GPR50在与能量代谢相关的几个领域中表达,即下丘脑第三脑室和背内核室管膜层. 此外,GPR50表达对能量状态有很强的反应,在禁食和高能量饮食5周时后表达明显减少[60].
2.10 、GPR50在瘦素信号、适应性产热和深度低体温中发挥作用
哺乳动物保持恒定体温的能力已被证明是一个深刻的进化优势,有趣的是,一些哺乳动物利用低温来应对食物供应减少和恶劣的气候[61,62].在季节性物种中,有节奏的深度低体温不受食物供应的变化的控制,但需要长期的代谢适应,这伴随着日长(光周期)的季节变化.对光周期的生理反应主要由褪黑素驱动的.近期研究揭示了GPR50,作为鸟类褪黑素Mel1C受体的同源物[25],演变了一个新的作用:作为自适应热发生和低体温的关键调制器.该研究将GPR50的减少表达与三种模型深度低体温反应联系起来,通过对西伯利亚仓鼠,瘦素缺乏(ob/ob)小鼠和GPR50基因敲除小鼠的研究,发现GPR50可通过调节对葡萄糖和瘦素等能量信号的热响应来抑制进入低代谢状态[63].
3 、展望
GPR50是超蛋白GPCRs家族成员之一,并与褪黑素受体Mel1c受体同源,但GPR50向Mel1c的演变尚不清楚.作为跨膜蛋白,GPR50参与调控多种信号通路,包括通过激活 P-CREB 参与AD,为AD提供新的治疗靶点;作为线粒体自噬受体调控线粒体自噬从而参与自闭症;和I型TGFβ 受体(TβRI)形成异源二聚体激活TGFβ 受体的抗增殖作用,抑制乳腺肿瘤的发展;介导ADAM17-Notch信号通路的调控,为基于Notch的肝细胞癌治疗策略的进展、预后和发展提供见解;通过与Tip60相互作用在糖皮质激素受体信号传递.同时,GPR50与季节性情感障碍、抑郁症、子痫前期、深度低体温中也存在联系.另外,本课题组在前期研究工作中证明牦牛卵母细胞中存在GPR50,并发现在牦牛卵母细胞发育成熟过程中GPR50 表达量显着增高[64],同时进一步对GPR50 在牦牛卵母细胞成熟过程中的确切亚细胞定位及对卵母细胞成熟的影响进行了研究,首次证实 GPR50 在繁殖生理中发挥重要作用.如今生物学技术发展迅速,GPR50的更多功能将越来越多的被揭示,但是其分子机制、信号通路还需要进一步研究.GPR50将有望成为各类神经、代谢、肿瘤疾病等临床疾病的重要诊断指标和治疗靶点.
参考文献
[1]VIOLIN J D,CROMBIE A L SOERGEL D G,et al. Biased ligands at G-protein-coupled receptors:promise and progress[J].Trends in Pharmacological Sciences. ,2014,35(7):308-31
[2]王靖,徐芳,杨孔G蛋白偶联受体研究进展[J]西南民族大学自然科学版, 2020 ,46(6):563-570.
[3]RASK A M.ALMeN M s, SCHITHH B. Trends in the exploitation of novel drug targets([J] Nature Reviews Drug Discovery,2011,10(8):579.
[4]MAURICE P,GUILLAUME J L,BENL EULMI CA,et al. GPCR-interacting proteins,major players of GPCR function[J] Advances in Pharmacology,2011,62:349-380.
[5]LEVOYE A,DAM J,AYOUB M A,et al.Do orphan G. protein-coupled receptors have ligand-independent functions?new insights from receptor heterodimers[J] European Molecular
Biology Organization,2006,7:1094-1098.
[6]AHMAD R,WOJCIECH S,JOCKERS R.Hunting for the function of orphan GPCRs - beyond the search for the endogenous ligand[J]. British Journal of Pharmacology,2015,172(1
3)-:3212-3228.
[7]Li D,SMITH D,HARDEL AND R,et al.Melatonin receptor genes in vertebrates[J] International Journal of Molecular Sciences,2013, 14(6): 11208-11223.
[8]REPPERT S M,WEAVER D R ,EBISAWA T,et al. Cloning of a melatonin-related receptor from human pituitry[J].Federation of European Biochemical Societies letters, 1996386
(2-3)-.219-224.
[9]HAMOUDA H O,CHEN P,LEVOYE A,et al.Detection of the human GPR50 orphan seven transmembrane protein by polyclonal antibodies mapping different epitopes[J].Journal 0
f Pineal Research,2007,43:10-15.
[10]BATAILLER M,MULLIER A, SIDIBE A ,et al.Neuroanatomical distribution of the orphan GPR50 receptor in adult sheep and rodent brains[J] Journal of Neuroendocrinology,201
2,24(5):798-808.
[11]SAHA s K,CHOI H Y,YANG G M,et al. GPR50 promotes hepatocellular carcinoma progression via the notch signaling pathway through direct interaction with ADAM17[J].Molec
ular Therapy Oncolytics,20,17-332-349.
[12]COX B,SHARMA P.EVANGELOU A I,et al.Translational analysis of mouse and human placental protein and mRNA reveals distinct molecular pathologies in human preeclamp
sia[J].Molecular and Cellular Proteomics ,2011,10(12):M111.012526.
[13]GUBITZ A K,REPPERT S M.Assignment of the melatonin-related receptor to human chromosome X (GPR50) and mouse chromosome X (Gpr50)[J].Genomic,1999.55(2).248-
[14]SAXENA V K,KUMAR D,NAQVI S M K Molecular characterization of GPR50 gene and study of its comparative genetic variability in sheep breeds adapted to different thermo-
contrasting climatic regimens[J].International Journal of Biometeorology,2017,61(4):701-707.
[15]THOMSON P A,WRAY N R,THOMSON A M,et al Sex- specific association between bipolar affective disorder in women and GPR50 ,an X-linked orphan G protein-coupled rece
ptor[J]. Molecular Psychiatry,2005,10:470-478.
[16]AL AERTS M,VENKEN T,LENAERTS A S,et al.Lack of association of an insertion/deletion polymorphism in the G protein-coupled receptor 50 with bipolar disorder in a norther
n swedish population,psychiatr[J].Psychiatric Genetics 2006, 16:235-236.
[17]BHATTACHARYYA S,LUAN J A.CHALLIS B,J et al.Sequence variants in the melatonin-related receptor gene (GPR50) associate with circulating triglyceride and HDL levels[
J].Journal of Lipid Research,2006 ,47(4):761-766.
[18]KHAN M Z,HE L,ZHUANG X.The emerging role of GPR50 receptor in brain[J] Biomedicine & Pharmacotherapy,2016,78:121-128.
[19]GRUNEWALD E,KINNELL H L,PORTEOUS D J,et al.GPR50 interacts with neuronal NOGO-A and afects neurite outgrowth[J].Molecular & Cellular Neuroscience ,2009,42(4):3
63-371.
[20]ZHANG Y,LI H Q,YAO Y F,et al.Uneven evolutionary rate of the melatonin-related receptor gene (GPR50) in primates[J].Genetics and Molecular Research,2015, 14(1):680-69
[21]AHMAD R,LAHUNA O,SIDIBE A,et al.GPR50-Ctail cleavage and nuclear translocation:a new signal transduction mode for G protein-coupled receptors[J].Cellular and Molecul
ar Life Sciences ,2020,77(24):5189-5205.
[22]REPPERT S M,WEAVER D R,CASSONE V M,et al.Melatonin receptors are for the birds :molecular analysis of two receptor subtypes difrentially expressed in chick brain[J].
Neuron, 1995,15(5):1003-1015.
[23]EBISAWA T,.KARNE S,LERNER M R,et al. Expression cloning of a high-affinity melatonin receptor from Xenopus dermal melanophores[] Proceedings of the National Academ
y of Sciences, 1994,91(13):6133-6137.
[24]REPPERT S M.WEAVER D R,EBISAWAT ,et al.Cloning of a melatonin-related receptor from human pituitary[J].Federation of European Biochemical Societies,1996 ,386(2-3):
219-224.
[25]DUFOURNY L,LEVASSEUR A,MIGAUD M,et al. GPR50 is the mammalian ortholog of Mel1c:evidence of rapid evolution in mammals[J] .BioMed Central Evolutionary Biology,20
08,8:105
[26]LEVOYE A,DAM J .AYOUB MA,et al.The orphan GPR50 receptor specifically inhibits MT1 melatonin receptor function through heterodimerization[J] European Molecular Biolo
gy Organization,2006,25(13)-3012-3023.
[27]GRUNEWALD E,TEW K D,PORTEOUS D J,et al.Developmental expression of orphan G protein-coupled receptor 50 in the mouse brain[J] .American Chemical Society Chemic
al Neuroscience,2012,3(6):459.
[28]LI Q,ZHANG Y,GE B Y,et al.GPR50 distibution in the mouse cortex and hippocampus[J] Neurochemical Research,2020,45(10).2312-2323.
[29]兰丽君,陈继博,吕美红,等GPR50敲除导致小鼠神经元数目和发育异常研究[J]陕西医学杂志, 2018.01(v. 47;No 511):5-9.
自1985年KaryMullis发明PCR技术以来,PCR技术一直是生物医学领域中重要的实验方法。随着分子生物学技术的发展,目前核酸定量的主要方法是实时荧光定量PCR(QuantitativePCR,qPCR)。数字PCR(DigitalPCR,dPCR)是近年来发展起来的新技术,是对传统P...
生物化学是轻工业院校酿酒工程的一门重要的专业基础课,内容多且抽象,各种代谢反应繁杂。生物化学是生物、农业、医学等专业必不可少的基础课程,不同专业的生物化学,其侧重点也有所不同。教师在教学过程中,重视酿酒与生化的联系,突出专业特色,对于增强...
生物化学与分子生物学是一门紧密联系基础医学与临床医学的重要学科。其中实验课不仅是学生加深理解生化基本知识、掌握实验基本技能的手段,也是提高学生分析问题和解决问题,培养创新和综合能力的重要环节。笔者连续参加了几年的实验课教学,有一些体会与同...
检验医学以及生命科学的问世和发展在一定程度上加快了我国临床生物化学检验技术的不断进步,在科研人员以及医务工作者的不断努力之下,临床生物化学已经成为现代医学检验中的成熟、专业性学科,并能够满足现代临床需要,为病情监测、疾病诊断、预后判断、疗...
茶叶生物化学是研究茶树生命化学的科学,在生物化学与分子水平探讨茶树生命的本质,研究茶树特别是茶树新梢中分子的结构与功能、物质代谢与调节,及其在生命活动中的作用;研究茶树新梢的化学分子在加工及贮藏过程中的转化规律以及对茶叶品质及茶叶健康功能...
研究发现,在哺乳动物基因组中,只有不到2%的转录产物具有蛋白编码功能,其余98%均为非编码RNA(noncodingRNA,ncRNA)[1,2].根据核苷酸序列的长度,ncRNA可分为短链ncRNA(short/smallncRNA)和长链LncRNA(longncRNA),二者之间并没有特...
蛋白质组学研究的主要内容包括在蛋白质水平上大规模地分析组织细胞的蛋白质表达水平、翻译后修饰、蛋白质间的相互作用等,从而揭示蛋白质的功能,已在疫苗筛选、指导治疗、临床药物开发及预后判断等领域发挥了重要作用。...
甘油三酯(triglyceride,TG)是人体内含量最多的脂类,是体内能量的主要来源.TG检测是一项重要的临床血脂常规测定指标.血清甘油酯测定方法可分为化学法、酶标板法和色谱法3大类.化学法因操作步骤繁多、技术要求高而不适于常规工作应用.核素稀释/气相色谱...
中性粒细胞在抵抗感染性炎症方面具有重要地位,其中中性粒细胞分泌的丝氨酸蛋白酶(neutrophilserineproteases,NSPs)在清除病原体方面发挥重要作用。蛋白酶3(proteinase3,PR3)是中性粒细胞分泌的主要丝氨酸蛋白酶之一[1],是继人中性...
e DNA技术是通过从各环境介质中提取出特异性的DNA识别片段,使用DNA测序技术分析所提取环境DNA的识别片段情况,定性或者定量地分析生物体在环境介质中的具体分布情况和生态功能特征。...