
产甲烷菌在地球碳循环中扮演着重要角色,是有机物厌氧降解的末端功能类群,能够将有机碳转化为甲烷. 它们广泛分布于地球的无氧环境中,从土壤到湖泊沉积物,从陆地到海洋,从零下的低温环境到100 ℃以上的高温环境,都有产甲烷菌的存在. 进化研究表明产甲烷菌是地球上最为古老的菌群,目前有两个不同的假说均认为产甲烷菌是真核生物的祖先[1-2]. 与细菌和真核生物相比,产甲烷菌以甲烷作为其厌氧呼吸终产物,具有更加独特的生化代谢特性. 另一方面,甲烷作为一种清洁能源,正越来越受到关注[3]. 同时,甲烷的高红外吸收以及对臭氧层的影响使之成为第二大温室效应气体,其产生的温室效应是CO2的20-30倍[4-5]. 目前全球的甲烷排放量约为5×109-6×109kg/年[6],其中大约74%的甲烷排放来自生物产甲烷[7],大气中的甲烷含量正以每年2%的速度递增[8]. 因此研究产甲烷菌的生化代谢途径不仅能够增加我们对古菌特殊代谢途径的了解,而且能够为解决全球能源紧缺以及气候变暖等问题提供理论依据. 产甲烷菌能够利用的底物非常有限,仅能够利用CO2、乙酸和简单甲基化合物这3类物质作为碳源产甲烷. 本文即综述产甲烷菌利用这3类底物产甲烷的具体代谢过程,详细阐述其中涉及到的能量转化过程、电子传递途径以及参与的关键酶和辅酶,介绍最新发现的电子歧化途径,即包含FDA蛋白的复合体介导电子在脱氢酶和氧化还原酶之间转移,从而完成能量储存的过程;同时还对目前通过一些新技术和新方法对产甲烷菌生化代谢过程研究的进展情况予以总结.
1 产甲烷菌的特点
产甲烷菌是严格厌氧的原核生物,是已知的唯一一种能够代谢产甲烷的生物. 系统发育学上属于古菌域广古门菌门(Euryarchaeota)[9]. 已知的产甲烷菌分为7个目:甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷微菌目(Methanomicrobiales)、甲烷 八叠球菌目(Methanosarcinales)、甲烷火球菌目(Methanopyrales)、Methanocellales和Methanoplasmatales(图1). 前5个目中已经分离到很多纯菌种,研究较多[8]. Sakai等于2008年从稻田里分离得到了一种仅利用H2或甲酸还原CO2生长产甲烷的菌株,提出了Methanocellales目[10];Paul等于2012年在白蚁肠道中分离得到的一种与热原体目类似的菌,仅能够利用甲醇作为底物生长产甲烷,于是提出了Methanoplasmatales目[11].
产甲烷菌分布广泛,主要存在于厌氧生态系统中,如:(1)湖泊、沼泽湿地、水稻田、污泥等;(2)生物体内,如反刍动物的瘤胃和人类、昆虫等的肠道内;(3)土壤中的厌氧团粒,如森林中的土壤团粒;(4)人工生物降解设施,如沼气池和生物反应器;(5)一些极端环境,如热泉、含硫热液口、水底的热流等[8, 13-14]. 尽管产甲烷菌在自然界中分布广泛,但其不能利用复杂的有机物作为能量来源,仅能够利用几种简单化合物作为产甲烷的底物,这些物质主要是CO2、乙酸和简单甲基化合物. 根据其利用的底物可以将产甲烷菌分为3类:(1)还原CO2型,主要利用H2、甲酸作为电子供体还原CO2产甲烷,例如Methanobrevibacter[15];(2)甲基营养型,通过H2还原甲基化合物中的甲基产甲烷或通过甲基化合物自身的歧化作用产甲烷,例如Methanococcus[16];(3)乙酸型,通过裂解乙酸,将乙酸的羧基氧化为CO2,甲基还原为甲烷,例如Methanosaeta[17-18]. Methanococcales、Methanobacteriales、Methanomicrobiales和 Methanopyrales目中几乎所有的甲烷菌都利用H2和CO2途径产甲烷,其中很多种也利用甲酸.
Methanosarcinales由甲基营养型甲烷菌构成,利用含甲基的化合物如乙醇、甲胺等,其中Methanosarcina和Methanosaeta属能够利用乙酸,有些种还可以同时利用H2/CO2,是代谢多样性最高的甲烷菌群. 多数甲烷菌是中温菌,但也有些为嗜热菌和耐低温菌.
2 产甲烷菌的生化代谢途径
甲烷菌的产甲烷过程包括一系列步骤,有众多酶参与(图2),最终将CO2或C1化合物中的甲基还原成CH4.
2.1 关键酶
2.1.1 辅 酶 生物产甲烷过程需要多种酶和辅酶共同参与.这些辅酶根据其功能的不同可以分为两类,一类是C1的携带者,主要包括甲烷呋喃(MF)、四氢甲烷蝶呤(H4MPT)、四氢八叠甲烷蝶呤(H4SPT)、辅酶 M(HS-CoM). 另一类是电子载体,主要包括铁氧化还原蛋白(Fd)、辅酶B(HS-CoB)、辅酶 F430、细胞色素、FAD、甲烷吩嗪(MP)、辅酶F420[18-20]. 下面就生物产甲烷过程中的几种特殊辅酶进行简单介绍.
MF包含一个呋喃环和一个氨基基团,其中氨基碳用于结合CO2;H4MPT和H4SPT类似,均为四氢叶酸的衍生物,用于甲酰、甲叉和甲基水平上C1的转移,其转移方式与四氢叶酸类似[21]. HS-CoM是辅酶中分子量最小的一种,化学名称为2-巯基乙磺酸(HS-CH2CH2SO3-)[22],在甲基转移酶的作用下巯基上的氢原子被甲基基团取代,是甲烷形成过程中的末端甲基载体. HS-CoB的化学名称为磷酸-7-巯基庚基苏氨酸(7-mercaptoheptanoylthreonine phosphate),它包含一个巯基和磷酸基团,其中巯基为其活性部位. 辅酶F430是一种位于细胞膜上的含镍的类卟吩(Porphinoid)化合物,其中Ni为其活性中心,它具有3个价态(+1、+2和+3),通过这3个价态的相互转变实现电子的转移[23]. MP是一种仅存在于甲烷八叠球菌目中的一种辅酶,其功能与其它细菌呼吸链中的醌类相似[20, 23]. 辅酶F420是一种去氮黄素衍生物,其在波长为420 nm的紫外光下发出蓝绿色荧光,可以利用这一特点初步鉴定是否存在产甲烷菌细胞[24-25]. 辅酶F420的电势较低,既可作为氢化酶、甲酸脱氢酶和一氧化碳脱氢酶的电子受体,又可作为NADP+还原酶的电子供体[26].
2.1.2 关键酶 图2中反应(12)和反应(13)是生物产甲烷过程中共有的步骤. 其中反应(12)是生物产甲烷过程的最后一步,它是由含镍的甲基辅酶M还原酶(Mcr)催化,以HS-CoB为直接的电子供体还原CH3-S-CoM产生甲烷和CoB-S-S-CoM的过程. 甲基辅酶M还原酶是产甲烷菌所特有的一种酶(除甲烷营养型古菌外)[28]. 因此,编码Mcr其中的一个亚基基因(mcrA)可用于产甲烷菌的分类学研究[29-31]. Mcr由α、β和γ三种不同的亚基组成一个(αβγ)2六聚体结构,同时,每分子Mcr中含有2分子位于酶的活性中心的含镍辅酶F430[32-33]. 目前通过对该酶的晶体结构分析推测该酶的催化过程分为3步,Ni(I)亲核攻击CH3-S-CoM形成中间产物HS-CoM和[F430]Ni(III)-CH3,随后,Ni(III)氧化HS-CoM形成硫自由基(Thiylradical)·S-CoM和[F430]Ni(II)-CH3,最后,HS-CoB作为电子供体还原·S-CoM形成CoB-S-S-CoM并将多余的电子转移给Ni(II)产生Ni(I),H+裂解[F430]Ni(II)-CH3产生甲烷[18, 34]. Mcr具有两种系统发育不同的同工酶,分别为McrI和McrII. Sabine等通过对Methanobacterium thermoautotrophicum的研究发现,该菌中同时具有两种Mcr,在H2浓度高时,该菌以McrII为主,而在氢浓度低时,主要以McrI为主起催化作用[35]. 后期研究表明M. thermoautotrophicum中编码这两种同工酶的操纵子在该菌的生长初期主要编码合成McrII,而在该菌的生长后期则主要编码合成McrI,但对这个过程的具体机制目前还不清楚[36-37].
反应(13)也是所有生物产甲烷所必需的. 其中CoB-S-S-CoM可以被视为产甲烷过程的末端电子受体,它被异质二硫化物还原酶(Hdr)还原,重新释放出HS-CoB和HS-CoM,其反应方程式为CoB-S-S-CoM + 2e-+ 2H+→CoB-SH + CoM-SH[38]. Hdr是一种与膜相结合的蛋白,目前发现有两种类型,一类是从Methanosarcina barkeri中分离得到的HdrED,它由一个细胞色素,两个嵌膜的Hdr亚基组成[39]. HdrED在还原CoB-S-S-CoM时以H2、F420H2或Fdred作为电子供体,通过细胞色素和甲烷吩嗪来传递电子,在这个过程中会消耗细胞质中的质子,产生跨膜质子梯度用于合成ATP. 这种酶对于利用乙酸的产甲烷菌是必须的. 另一类是从Methanothermobacterthermoautotrophicum和 Methanothermobacter marburgensis中分离得到的HdrABC. 含有HdrABC的甲烷菌能够利用CO2+ H2生长,不能合成细胞色素和甲烷吩嗪[40]. Thauer等利用模型推测,在这些没有细胞色素的产甲烷菌中存在由HdrABC中的黄素(Flavin)介导的电子歧化(Bifurcation)过程,认为HdrABC不直接参与能量的储存,而是与产甲烷过程第一步中的铁氧化还原蛋白(Ferredoxin)的还原过程相偶联,产生钠离子梯度,用于ATP的合成[19]. Buckel等对这个过程进行了详细阐述[41],具体过程见图3. Buan等通过对5种Methanosarcinales进行测序发现,这些菌株的基因组中含有hdrED基因,也包含hdrACB基因,但是通过生化方法在Methanosarcinales中还未发现HdrABC;他们推测要么HdrED或HdrABC对细胞的生长条件存在偏好性,要么HdrED或HdrABC具有特殊的生理功能[42].
2.2 生化代谢过程
2.2.1 还原CO2途径 还原CO2途径广泛存在于自然界中,除少数几种产甲烷菌没有还原CO2途径外,绝大多数产甲烷均可以利用该途径产甲烷[19]. 在还原CO2途径中,绝大部分产甲烷菌以H2作为电子供体,在氢酶作用下将电子传递给Fdox还原CO2,因此这些菌又被称作氢营养型产甲烷菌(Hydrogenotrophic methanogen). 大多数产甲烷菌也能够利用甲酸作为电子供体还原CO2,它们通过依赖F420的甲酸脱氢酶和F420还原性氢酶将4分子甲酸转化为4CO2和4H2,再利用H2和CO2产甲烷[43]. 也有少数产甲烷菌利用CO作为电子供体,在这个过程中3CO先被氧化为3CO2产生电子,用于CO2还原产甲烷[44-45]. 下面就氢营养型产甲烷菌的生化过程进行详细介绍.
在图2中,反应(1)至(5)是利用H2还原CO2途径的反应过程. 反应(1)至(4)由位于细胞质中的酶复合体催化;反应(5)是由位于细胞膜上的蛋白复合体催化. 反应(1)由甲酰甲烷呋喃脱氢酶(Fdh)以还原的铁氧化还原蛋白(Fdred)作为电子供体,还原CO2为甲酰基共价连接于甲烷呋喃(MF)的氨基基团形成CHO-MF和氧化的铁氧化还原蛋白(Fdox)[46],Fdox随后利用H2作为电子供体,在能量转化[NiFe]氢酶(Ech)的催化下产生Fdred,这个过程需要消耗能量或需要反向电子流(Reverse electron transfer). 不同产甲烷菌的Fdh的结构具有一定的差异,但是其催化功能基本相似[47]. 接下来四氢甲烷蝶呤甲酰转移酶催化甲酰甲烷呋喃上的甲酰基转移到H4MPT的N5基团上形成CHO-H4MPT [反应(2)]. 随后甲酰四氢甲烷蝶呤环化水解酶和甲酰四氢甲烷蝶呤脱氢酶催化完成反应(3). 其中甲酰四氢甲烷蝶呤脱氢酶(Mtd)根据其利用的电子供体分为两类:一类是辅酶F420依赖型,以辅酶F420H2作为电子供体[48];另一类是H2依赖型,以H2作为电子供体. 随后由甲酰四氢甲烷蝶呤还原酶以辅酶F420H2作为电子供体催化完成反应(4). 研究发现该酶是辅酶F420依赖型酶,由一个亚基组成,没有检测到辅基[49-50]. 最后辅酶M甲基转移酶(Mtr)催化完成反应(5)将甲基基团转移到HS-CoM的硫醇基上形成CH3-S-CoM,伴随着甲基的转移会产生钠离子梯度,用于ATP的合成[51]. Mtr是由mtrECDBAFGH操纵子编码的,由8个亚基组成的嵌膜蛋白复合体[52]. 其中亚基MtrA中含有一个钴胺素(I)辅基,它在催化循环中不断地被甲基化和去甲基化,去甲基化的过程中伴随着钠离子被泵出细胞膜,产生钠离子梯度[53];从Mtr复合体中分离得到的MtrH能够利用CH3-H4MPT催化自由钴胺素(I)辅基转变为甲基化的钴胺素(I)辅基[54];亚基MtrE被认为能够将MtrA中的类咕琳(Corrinoid)辅基上的甲基基团转移到辅酶M的巯基上,该反应是依赖钠离子的反应[55].
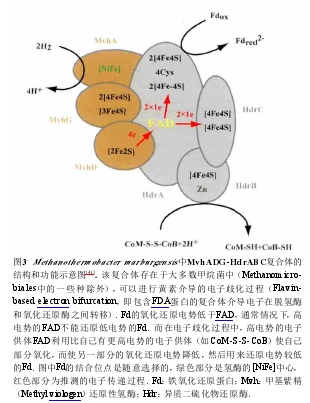
2.2.2 乙酸途径 自然界中约2/3的生物产甲烷来自于乙酸途径,然而仅Methanosarcina和Methanosaeta能够利用乙酸途径产甲烷[27]. 它们通过裂解乙酸,还原甲基碳产CH4,同时氧化其羧基碳产生CO2. 在乙酸转变为乙酰辅酶A的过程中,这两种产甲烷菌具有不同的反应机制. Methanosarcina通过乙酸激酶[催化反应(7)]和磷酸转乙酰酶[催化反应(8)]利用1分子ATP催化乙酸转变为乙酰辅酶A;而Methanosaeta则通过乙酰辅酶A合成酶利用2分子ATP催化乙酸转变为乙酰辅酶A[56] . 乙酰辅酶A再由一氧化碳脱氢酶/乙酰辅酶A合成酶复合体(Codh/Acs)催化以Fdox作为电子受体完成反应(9),产生CO2和CH3-H4SPT. Codh/Acs是解乙酸途径中的关键酶,用于剪切乙酰辅酶A上的C—C和C—S键. 在将甲基基团转移到H4SPT上形成CH3-H4SPT的同时,利用Fdox作为电子受体氧化CO产生CO2和Fdred,并将甲基基团转移到H4SPT上形成CH3-H4SPT. 不同的产甲烷菌所具有的Codh/Acs结构有所差别,Methanosarcina thermophila中该酶由5个亚基(α、β、γ、δ、ε)组成,包含α和ε亚基组成的Ni/Fe-S、γ和δ亚基组成的Co/Fe-S以及β亚基这3个部分[57];M. barkeri中的Codh/Acs与其结构相似[58-59],但它包含一个独特的类咕琳蛋白,推测其功能为接收甲基基团[60];而在Methanothrix soehngenii中仅由一个类似M.thermophila中Ni/Fe-S部分的α2β2组成[61]. 产生的Fdred在Ech的催化下产生H2和Fdox用于后续反应,这个过程伴随着离子梯度的产生. 反应(9)中产生的CO2可以在碳酸酐酶的作用下与H2O反应生成碳酸[反应(10)],这个过程可以移去细胞质内多余的CO2,增加产甲烷的效率. 随后四氢八叠甲烷蝶呤甲基辅酶M转移酶催化完成反应(11)产生CH3-S-CoM,这个过程与反应(5)相似,也能够产生钠离子梯度,用于合成ATP.
2.2.3 甲基营养途径 自然界中,仅甲烷八叠球菌目以及甲烷球菌目中的Methanosphaera能够利用甲基营养途径产甲烷[27].该途径包含两种代谢模式,第一种为H2依赖型代谢模式,它以H2作为电子供体,还原甲基化合物中的甲基基团产甲烷[62-63].第2种模型为严格的甲基营养型,一部分甲基化合物被氧化产生CO2以及还原当量,用于还原甲基化合物中的甲基基团产甲烷[18, 21]. 这也是大多数甲基营养型产甲烷菌的代谢途径,它们仅以甲基化合物为底物产甲烷,具体反应过程见图2.
甲基化合物首先在特殊的辅酶M甲基转移酶系统(Mt)的作用下以HS-CoM作为电子供体,将甲基基团转移到HS-CoM的巯基上产生CH3-CoM [反应(6)]. 不同的底物所对应的Mt不同,甲基营养型产甲烷菌能够利用的底物主要包括甲醇(Mta)[64]、一甲胺(Mtm)[65]、二甲胺(Mtb)[66]、三甲胺(Mtt)[67]、甲硫醇(Mts)[68]. 每种Mt均包含一个具有底物特异性的类咕琳蛋白和两个不同的甲基转移酶,分别表示为MT1(MtaB、MtmB、MtbB和MttB)和MT2(MtaA、MtbA和MtsA),其中MT1催化还原态的类咕琳蛋白甲基化,MT2催化类咕琳蛋白上的甲基基团转移到HS-CoM上,仅二甲硫醚所具有的Mt是由两个相同的MtsA组成[69-70]. 通过对这些甲基转移酶系统的基因序列对比分析发现,MT2蛋白序列具有高度相似性,其活性中心均含有锌,同时其对应的类咕琳蛋白的序列也具有一定的相似性,而用于激活底物的MT1蛋白不具有系统发育相似性[23].
随后,在H2存在的条件下,CH3-CoM利用H2作为电子供体经反应(12)和(13)产甲烷;在没有H2的条件下,一部分CH3-CoM经过反应(4)至反应(1)的逆反应被氧化产生CO2、F420H2和H2,另一部分CH3-CoM利用F420H2和H2作为电子供体经反应(12)和(13)产CH4.
2.3 能量产生比较产甲烷菌的能量产生主要依赖于钠离子或质子跨膜梯度,驱动位于细胞膜上的ATP合成酶将ADP转化成ATP,反应(1)、(5)、(9)、(11)、(12)、(13)与钠离子或质子转运相偶联. 不同途径生物产甲烷过程的总反应方程式及其自由能见表1,其中还原CO2产甲烷途径产生的净能量最高,甲基营养型次之,乙酸途径最低.
在绝大多数产甲烷过程中,甲基转移过程是能量储存的关键步骤,它能够直接驱动钠离子异位. 然而甲基营养型和氢营养型产甲烷菌的能量储存过程存在一定的差异[71]. 甲基营养型甲烷菌具有细胞色素和一个质子移位电子传输链,它们用于在反应最后储存产甲烷过程中释放的能量. 而氢营养型产甲烷菌不具备这些组分,同时,其反应第一步[反应(1)]是耗能反应,还不清楚在能量储存过程中如何获得反应(1)所需的能量. 近期,Thauer等提出了电子歧化机制(即释能的电子流动直接驱动耗能的电子流动)来解释这个问题[19]. 它们将利用H2/甲酸还原CO2产甲烷的途径根据菌体中是否含有细胞色素分为两类(I类:不含细胞色素;II类:含有细胞色素). 总体而言,这两类途径中涉及到能量消耗过程均为反应(1),储能的过程均为反应(5)、(12)、(13). 但是这两类途径在反应(1)和反应(13)的能量消耗和储存过程中存在一定的差异. I类途径利用黄素介导的电子歧化过程,利用Ech和Hdr酶复合体以及黄素蛋白和Fd作为电子载体,将反应(1)Fdox的还原过程(耗能过程)与反应(13)异质二硫化物的还原过程(产能过程)偶联在一起,并产生钠离子梯度[41].
II类途径反应(1)和反应(13)独立进行. 反应(1)所需的能量直接由钠离子所产生的电化学电势提供,反应(13)利用甲烷吩嗪还原性氢酶氧化H2,并且以甲烷吩嗪和细胞色素作为电子载体,还原CoB-S-S-CoM,这个过程会产生钠离子梯度[23]. II类途径产生的能量略高于I类途径[19].
对比表1数据可知,在甲基营养型产甲烷途径中,利用甲醇产甲烷过程中产生的净能量相对于其它甲基化合物更高,并且含氮的甲基化合物所产生的能量相近,但是都明显低于还原CO2途径. 甲基营养途径中,由于产生CO2的过程是反应(5)至反应(1)的逆反应,故产生CO2的过程是耗能反应[27].因此甲基营养途径产生的净能量低于还原CO2途径.
对于乙酸途径,其消耗能量的过程为反应(7),至少需要1个ATP用于活化乙酸;其能量产生的过程为反应(9)、(12)和(13),其中反应(12)和(13)产生的能量与另两个途径相近,而反应(9)产生的能量较低,从而导致其为产生净能量最低的产甲烷途径.
3 产甲烷菌的基因改造及代谢模型
近年来,通过传统研究方法主要包括菌种分离技术、酶分离技术、同位素示踪等方法已分离了约208个产甲烷菌种,研究了其生理特征、关键酶以及电子传递过程等,对产甲烷菌的基本代谢途径已经有了深入系统的认识. 但是,自然界中仍然还存在许多难以分离的产甲烷菌,其可能具有某些特殊的代谢途径. Andrew等在海洋沉积物中分离到3株Methanococcoides,它们能够通过部分脱甲基化作用,利用甜菜碱作为底物产甲烷[72]. 同时,由于部分产甲烷菌中的酶难以分离,因此一些认识是基于生物信息学比对或理论推测得到的.
随着基因改造、基因组测序、转录组测序和生物信息学等新技术的发展,对产甲烷菌的代谢途径和过程调控的认识已越来越深入全面. Methanococcus和Methanosarcina这两个属分别代表H2/CO2和甲基营养(包括乙酸)途径,对这两个属已经开发了一些遗传工具,研究其生化代谢和遗传特征,包括可复制的穿梭载体[73-74]、反选择[75-76]和异位整合[75, 77]等基因操作技术. Farkas等对古菌基因工程技术的方法及应用进行了总结[78]. 基因工程改造不仅可以拓宽产甲烷菌的代谢底物[79],也有助于发现新的代谢途径[80]. Daniel等通过基因工程的方法成功地将好氧细菌Pseudomonas veronii中的酯酶(可以水解多种酯键)基因转入Methanosarcina acetivorans菌中,取得了良好的效果,使得产甲烷菌能够利用乙酸甲酯和丙酸甲酯产甲烷[81]. Welander等通过对Methanosarcinabarkeri中一系列涉及产甲烷途径中编码C1氧化/还原酶的基因进行突变研究,发现当甲醇和乙酸同时作为底物时,产甲烷的过程中存在一个新的Mtr/Mer代谢旁路[80]. Rotaru等通过宏转录组等手段分析啤酒厂废水处理器中的菌群结构后,提出Geobacter和Methanosaeta这两种菌种间存在一种新的种间电子传递途径,即直接的电子传递途径(DIET)[82],打破了传统的观念,即产甲烷菌与其他菌群种间电子传递必须由H2或甲酸作为电子传递载体. 另一方面,代谢模型重组方法的提出使得利用计算机对产甲烷的生化代谢过程进行模拟、构建和预测成为可能. Adam等首先基于代谢底物最为广泛的Methanosarcina barkeri基因组构建了生物产甲烷的代谢重组模型[83],与现有的实验数据具有较高的相似度,证明了代谢重组可以用于古菌代谢状况的模拟和构建. Gonnerman等在此基础上,利用现有的数据对其进一步进行了完善[84].
Kumer等对基因组最大的古菌Methanosarcina acetivorans进行了代谢模型构建,其准确率达到了93.3%[85]. Oberhardt等[86]对基因组代谢重组的具体方法以及应用进行了详细总结. 目前已测序的产甲烷菌大约有32个种,然而对产甲烷菌的生理生化性质研究并不完整,基因代谢模型重组方法的预测还存在一定的偏差,但是,该方法在研究生物产甲烷代谢途径方面具有较大的发展前景.

4 结论与展望
产甲烷菌生长在严格厌氧的环境中,具有独特的生物化学代谢途径,但由于产甲烷菌难于分离培养,也难于对其进行遗传改造,加上产甲烷菌自身的代谢也相当复杂. 因此,目前对于产甲烷菌的生化代谢过程及调控还有很多工作要做.本文对目前的研究状况进行了总结,认为未来对产甲烷菌的研究将主要集中在以下几个方面:(1)产甲烷菌的生理生化特征研究,包括高效产甲烷菌的分离以及产甲烷菌中关键酶的研究等;(2)利用新技术和新方法发现、改造及模拟生物产甲烷的代谢通路;(3)产甲烷菌的生态学研究,如利用各种分子生物学技术,研究环境中产甲烷菌的分布、与其它菌群的关系及对全球变化的响应机制.
基于肠道微生物与宿主代谢和健康的紧密联系,微生态干预常常作为调控肠道健康的有效手段。猪肠道微生物组成及其代谢产物的变化,在各种机体代谢和免疫调节中发挥着重要作用。...
肠道微生物在人类健康与疾病中起着重要作用, 肠道微生物的代谢功能被认为是疾病发展的一个促进因素, 其产生的生物活性物质对宿主的生理、病理过程有重要影响。...
近年来,国内外有不少关于产蛋白质类抑菌物质乳酸菌的研究报道,如LGG(Lactobacillus rhamnosus GG)、ZJ19[19]和KCA386[20],对李斯特氏菌、枯草芽孢杆菌和多数乳酸菌有抑制作用。...
本研究对贮藏在4℃的冷鲜鸡进行菌相分析可知, 冷鲜鸡的腐败菌相以假单胞菌 (51.0%) 和乳酸菌 (31.5%) 为主, 其次是热杀索丝菌 (13.3%) 、肠杆菌 (4.3%) 。本研究对分离出的主要腐败菌进行分离、纯化, 然后进行菌落特征、菌体形态观察及生理生化鉴定, 初步确定...