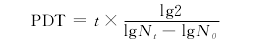藏獒(Tibetan Mastiff)属食肉目(Carnivora)犬科(Canidae),是原产于青藏高原地区的古老犬种,也是中国唯一的一个大型犬种,属于国家二级保护动物。由于近几十年来藏獒被大量贩运到内地省份,甚至国外,加上当地生存环境恶化,青海、西藏等原产地优良藏獒数量剧减,正面临着种群资源流失的危险(郭宪等,2008)。国内约20年前才开始了对藏獒的认识与研究,主要研究集中在藏獒疾病防治、饲养管理、繁殖培育、品种鉴别等方面,少量研究涉及藏獒血液生理生化特征(李动等,2000)、种群遗传多样性(Li等,2008)、选配选育(崔泰保等,2009)、精液保存(郑筱峰等,2010)等方面,而细胞、分子方面的研究较少。国外有研究报道应用动物体细胞克隆技术生产克隆狗获得成功(Jang等,2008),国内尚未开展此项研究的报道。体细胞克隆技术已成为保护珍稀动物资源的新方法。目前在国内已建立了大熊猫(张明等,2006)、黑麂(方俊顺等,2007)、朱鹮(王金焕等,2012)等珍稀动物皮肤成纤维细胞系进行细胞生物学特性和遗传资源保护研究。本研究利用组织块法建立了2株藏獒皮肤成纤维细胞系,对其体外培养的培养条件、生长特性、冷冻复苏、波形蛋白表达、细胞核型进行了研究,为藏獒体细胞克隆研究提供了供体细胞。
1材料与方法
1.1试 剂 及 仪 器 PBS、DMEM、D/F-12、TCM199、胰蛋白酶和乙二胺四乙酸二钠混和溶液、胎牛血清、EGF、bFGF均购自Gibco公司;二甲亚砜购自Amerisco公司;Giemsa染料、台盼蓝染料均购自上海生工生物工程技术服务有限公司。
台式离心机购自Eppendorf公司;二氧化碳培养箱购自三洋公司;超净工作台购自东联哈尔公司;倒置荧光显微镜购自尼康公司。
1.2皮肤组织的获取与处理 2只3月龄藏獒(1公1母)经耳部剪毛、清洗和消毒后,剪取皮肤组织约0.5cm2,放入磷酸缓冲液(phosphate bufferedsaline,PBS)溶液,4 ℃下2h内运回实验室。用PBS溶液反复冲洗组织块8~10次,用手术刀片刮去组织表面毛根及部分表皮,用眼科剪刀去除软骨,将皮肤组织剪成约1mm3小碎块。组织块经PBS溶液反复洗涤4次,用细胞培养液(D/F-12添加20%胎牛血清、100IU/mL青霉素、100μg/mL链霉素、40μg/mL表皮生长因子)离心洗涤3次,用1mL细胞培养液重新悬浮。
1.3细胞培养 为了增加组织块贴壁能力,先用胎牛血清涂布T25细胞培养瓶(Corning)底部,然后用吸管将组织块转移至细胞培养瓶,用牙科探针将组织块摆放于瓶底部,每瓶5~8块。将培养瓶倒置放入CO2培养箱培养2~4h后,加入3mL细胞培养液翻转培养瓶继续培养,每3d更换1次细胞培养液,观察细胞生长情况。当细胞从组织块周围游离出来并向周围成片生长时进行传代,用PBS溶液洗涤2次,用 牙 科 探 针 挑 取 组 织 块,加 入2 mL0.25%胰蛋白酶和0.04%乙二胺四乙酸二钠混和溶液于37℃消化细胞3min,加入2mL细胞培养液终止消化,于1000r/min离心细胞,弃上清,用细胞培养液重新悬浮细胞,计数后以5×104/mL的密度接种于新培养瓶继续培养。经过5~7d生长后,细胞达到85%~90%汇合,再次按1∶3或1∶4比例进行传代培养。
1.4细胞冻存与复苏 生长中的细胞达到85%~90%汇合时可以进行细胞冻存,经PBS洗涤,胰酶消化、离心后,在每一个T25培养瓶细胞沉淀物中加1mL预冷至4 ℃的细胞冻存液 (D/F-12添加10%胎牛血清、10%二甲亚砜),移到细胞冻存管(Corning),放入细胞冻存盒(Nalgene)于4 ℃平衡0.5h后,转移到-80℃低温冰箱保存24h后,将细胞冻存管投入液氮保存。复苏细胞时,将冻存管于37℃水浴中快速摇动解冻细胞,移到15mL离心管,加入9mL细胞培养液混匀,离心沉淀细胞,加入5mL细胞培养液重新悬浮细胞,移到T25细胞培养 瓶 培 养,24h后 换 培 养 液 去 除 漂 浮 的 死 亡细胞。
1.5细胞生长曲线绘制 取2瓶生长至85%汇合的F4代细胞用胰酶-EDTA混合液消化,用细胞培养液将细胞稀释至1×104/mL、3×104/mL和5×104/mL 3种 密 度,分 别 加 入24孔 细 胞 培 养 板(NUNC)孔中,每孔1mL,第1列加3孔,共加10列。将培养板放入培养箱中,每2d更换1次培养液。从第1列开始每天在固定时间取出培养板消化3个孔的细胞,稀释后用血球计数板进行细胞计数,取其平均值,以天数作为横坐标,以细胞数作为纵坐标,绘制细胞生长曲线。可用以下公式求得细胞群体倍增时间(population doubling time,PDT)。
式中,t代表培养时间;N0代表首次计数获得的细胞数;Nt代表培养t时间后的细胞计数。
1.6细胞波形蛋白免疫荧光分析 参考Bonifaci-no等(2007)方法,稍作修改。将细胞悬液按每孔4mL的量加入预先放置盖玻片(NUNC)的6孔板内,培养到细胞至50%~70%汇合。吸出培养基,每孔加入含2%甲醛的PBS,室温孵育10min,吸出甲醛,PBS洗涤2次。在盖玻片上,加2mL含10%FBS的PBS,放置10~20min。用含0.2%~0.5%Triton-X100和10% FBS的PBS稀释一抗(mono-clonal anti-vimentin antibody produced in mouse,1mg/mL,Sigma-ALDRICH Inc.)于1.5mL离心管中,稀释比例为1∶1000。用高速离心机最大速度离心抗体稀释液和对照组溶液,从沉淀物中吸出抗体溶液。加一抗25μL,用镊子取出盖玻片,再将其置于25μL的一抗溶液内,细胞面向下。室温于湿盒内孵育1h。取出盖玻片,细胞面朝上,加入含10% FBS的PBS,放置5min后吸出溶液,重复2次以上。用含0.2%~0.5% Triton-X100和10%FBS的PBS溶液稀释二抗(fluorescein(FITC)-con-jugated affinipure goat anti-mouse IgG(H+L),9.0mg/mL,Sigma-ALDRICH Inc.),稀释比例为1∶100,混匀后离心除去沉淀。在盖玻片上加一滴二抗25μL,将盖玻片置于二抗溶液内,盖上培养皿盖,避光存放,室温孵育1h。取出盖玻片,细胞面朝上,放入培养板,加入含10% FBS的PBS,放置5min,再吸出溶液;重复2次以上。滴加含0.2% Triton-X100和10μg/mL PI(prodipium iodide)的PBS孵育2min,用PBS洗涤3次。用抗荧光淬灭封片剂(fluoromount-GTM,Southern Biotech,Birming-ham USA)封片后,在荧光显微镜下观察。FITC用492nm激发光,PI用535nm激发光。通过与对照组比较,确定非特异染色区域。
1.7细胞核型分析 参考Freshney等(2008)方法,稍作修改。将5mL F5代细胞悬液以3×104/mL密度接种在T25培养瓶中培养3~5d后,加入秋水仙素使其终浓度为0.3μg/mL,作用4h。用胰酶消化细胞,离心后,加入0.075mol/L KCI混悬细胞,37 ℃静置13min。加入冰冷的醋酸甲醇,混合后离心,弃上清,边振荡边加入醋酸甲醇,冰上静置10min。离心细胞,弃上清,加入0.1~0.2mL醋酸甲 醇,振 荡 混 悬 细 胞。用 吸 管 将 细 胞 悬 液 从30cm处滴到凉的玻片上,倾斜玻片让液滴铺展开。火焰干燥玻片后,用相差显微镜观察,如细胞均匀铺展,制作更多的玻片。在玻片上加数滴纯Giemsa染液,染色4min,流水冲洗,干燥。在玻片上滴加1滴二甲苯,盖上盖玻片,在油镜下观察分散良好的染色体并拍照。用Photoshop软件剪切单个染色体,成对排列后,用尼康显微镜(Nikon Eclipse Ti)图像处理软件(NIS-Elements BR 3.00,SP1)进行染色体数据测量。
2结果与分析
2.1藏獒皮肤成纤维细胞体外培养生长情况及形态特征 用组织块法建立了2株藏獒皮肤成纤维细胞系,组织块经贴壁培养5~7d,周围可见梭形或铺路石样多边形细胞游出并向四周生长,随着培养时间延长至12~15d,组织块周围出现大片细胞生长区,大多数组织块周围的细胞生长区以梭形细胞为主,少量细胞生长区呈现梭形细胞和多边形细胞混合生长。组织块培养14~16d时进行传代培养,传代后细胞生长迅速,呈现栅栏状或漩涡状生长,于4~5d生长至90%汇合(图1),需再次进行传代培养。体外培养的藏獒皮肤成纤维细胞冻存和复苏后,经台 盼兰染料排 除试验测定,细胞存活率达88.7%,可正常生长,形态和传代时间未见明显变化。体外培养的藏獒皮肤成纤维细胞经15次传代培养后,细胞生长速度明显减慢,培养中大量细胞脱壁。
2.2细胞生长曲线特点 F4代藏獒皮肤成纤维细胞生长曲线见图2。由图2可知,体外培养细胞经过1d的潜伏期后开始快速增殖,存在着明显的对数生长期(3~7d),约在第7天达到平台期,平台期以后逐渐进入衰退期。当以较低细胞密度(1×104/mL)接种培养时,潜伏期延长(1~3d),对数生长期曲线较平缓,约在第9天达到平台期。3组培养细胞达到平台期时的细胞密度分别为4.5×105/mL、5.2×105/mL、8.6×105/mL。计算所得的PDT分别为46.1、39.4、48.5h,属于哺乳动物体细胞正常PDT范围。
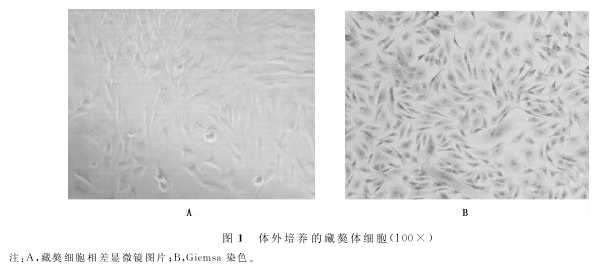
2.3藏獒体细胞波形蛋白免疫荧光分析结果 用波形蛋白单克隆抗体进行免疫荧光染色,与对照相比呈现明显的阳性结果,被绿色荧光标记的波形蛋白主要分布在细胞核周围区域(图3)。
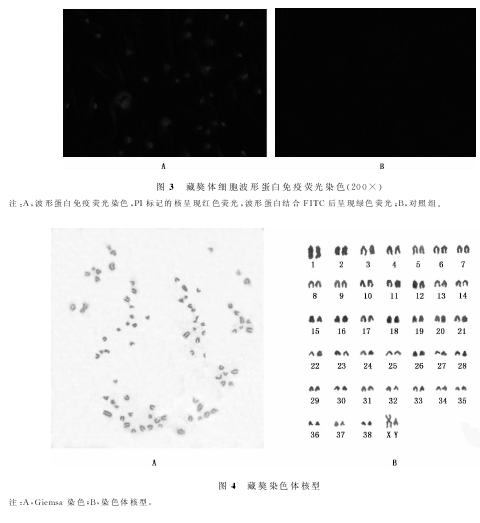
2.4细胞核型分析 F5代藏獒体细胞正常的染色体核型比率为91.4%。由图4可知,藏獒染色体2n=78,全部常染色体均为端着丝粒染色体,X染色体较大,为亚中着丝粒染色体,Y染色体为端着丝粒染色体。
3讨论
目前,国外已有报道成功地克隆了狗(Jang等,2008)和灰狼(Kim等,2007),而国内尚未开展这方面的研究。已有报道进行了德国牧羊犬(宁小檬等,2012)、比格犬(钟泉等,2010)等犬类成纤维细胞培养,但藏獒体细胞培养相关报道极少。本研究用组织块培养法成功建立了2株藏獒成纤维细胞,这2株细胞生长良好、增殖能力强,体外传代培养后冷冻保存了各代细胞40多管(2mL冻存管),在细胞水平保存了藏獒遗传资源,也为后期的藏獒体细胞核移植提供了供体细胞。
组织块培养是常用的动物体细胞原代培养方法,由于避免了长时间酶消化对细胞表面的破坏作用,所以组织块培养法能较好地保留来源组织的特征。供体细胞对体细胞核移植的生产效率有重要影响(Poehland等,2007),本研究用组织块法建立的藏獒成纤维细胞保持了较好的细胞活力,有利于提高藏獒体细胞核移植生产效率。体外培养的藏獒成纤维细胞生长特性及形态特点与已报道的犬类成纤维细胞相类似(宁小檬等,2012)。本研究利用多边形上皮样细胞胰酶消化需时较长和传代后贴壁较慢的特点,通过控制胰酶消化时间,在传代后15min从培养瓶吸去培养液并更换新培养液,经3~5次传代处理得到了较纯的梭形成纤维细胞群体。
体外分离培养的动物体细胞受到分离培养方法、培养环境等诸多因素的影响,随着群体染色体非整倍性的改变其增殖能力变化较大。测定细胞生长曲线能较好地反映出细胞的增殖能力,依此也可评估细胞的健康状况。本研究测定了藏獒成纤维细胞生长曲线,平台期密度最高值达到8.6×105/mL,最短PDT为39.4h,表明细胞增殖能力强、生长速度较快。波形蛋白(vimentin)是细胞中一种重要的细胞骨架成分,在皮肤组织中波形蛋白在成纤维细胞大量表达,可作为分离培养的成纤维细胞鉴定标志之一(Xu等,2010)。对所建立的藏獒成纤维细胞进行了波形蛋白表达研究,证实藏獒细胞呈现波形蛋白表达阳性,结合细胞形态特征可初步判定细胞群体属于成纤维细胞类型。
体外培养的动物体细胞与活体组织生活环境不同,随着传代次数的增加容易发生染色体变异。体细胞染色体的整倍性也关系到体细胞克隆胚胎和动物的发育能力(Jang等,2004)。对藏獒成纤维细胞进行了染色体整倍性研究,根据染色体整倍性状况来判定其能否作为藏獒体细胞核移植研究的供体细胞。同时,藏獒染色体核型研究对青海地区藏獒的分类、进化和遗传繁育有重要参考价值。以前的研究多是以外周血细胞为材料进行藏獒染色体核型分析,为了进一步研究青海地区藏獒体外培养细胞的染色体组型特征,试验对所建立的F5代藏獒体细胞进行了细胞遗传学分析。从统计数据显示,F5代藏獒体细胞正常的染色体核型比率为91.4%,出现了一定比例的非整倍性染色体组型和四倍体,有必要进行培养条件的优化来阻止其随着传代次数增加而发生较严重的染色体变异。染色体核型分析结果证实藏獒染色体2n=78,全部常染色体均为端着丝粒染色体,X染色体较大,为亚中着丝粒染色体,Y染色体为端着丝粒染色体,与已报道的用外周血细胞进行 的染色体核 型分析结果 相 一 致 (张 昱 等,2003;张亚君等,2009)。根据图像软件测量结果,对常染色体进行了排序,显示了藏獒染色体组型的基本特征。然而,藏獒染色体标本中存在着一些不易观测的微小染色体,用目前的方法进行准确配对存在着一定的困难,还需应用染色体显带、荧光标记染色体和分子探针技术进行进一步研究。
本研究建立了藏獒成纤维细胞株,冷冻保存了约40多管(2mL冻存管)传代细胞,对其体外培养条件、生长曲线、波形蛋白表达、染色体核型进行了研究。藏獒皮肤成纤维细胞系的建立,可以保存优秀藏獒种质资源,为以后开展藏獒分子生物学、细胞生物学研究提供了良好的材料,也为今后的藏獒体细胞克隆研究奠定了基础。用所建立的藏獒成纤维细胞作为供体细胞、用藏狗去核卵细胞作为受体胞质进行藏獒体细胞核移植研究,将所生产的藏獒克隆胚胎移植到藏狗受体输卵管中生产藏獒克隆后代,可以提高藏獒繁殖效率,快速扩繁优秀藏獒种群。这也是国内继藏獒精液保存技术应用于藏獒繁殖之后建立的另一项重要的藏獒辅助生殖技术,该项技术将有力地推动藏獒繁殖生物技术的发展和应用。同时,本研究所建立的藏獒体细胞培养技术体系能为犬类体细胞培养和建系提供参考。
参 考 文 献
1方俊顺,陶勇,章美玲,等.黑麂耳成纤维细胞培养及异种重构胚构建[J].农业生物技术学报,2007,15(2):228~232.
2王金焕,苏榕,苏伟婷,等.朱鹮细胞系的建立及其生物学特性观察[J].动物学研究,2012,33(6):591~596.
3宁小檬,邱桂斌,李祥瑞.德国牧羊犬成纤维细胞培养及其生长特性研究[J].中国畜牧兽医,2012,39(4):119~121.
4张亚君,张惠萍.藏獒染色体核型分析[J].青海畜牧兽医杂志,2009,39(4):14~15.
5张明,候蓉,郑鸿培,等.大熊猫皮肤成纤维细胞在不同培养液中的生物学特性研究[J].扬州大学学报(农业与生命科学版),2006,27(3):35~39.
6张昱,袁宁,王文青,等.藏獒(Tibetan Mastiff)的核型研究[J].青海医学院学报,2003,18(4):225~226.
7李动,李才让,尼玛才让,等.果洛藏獒血清蛋白质指标的研究[J].畜牧与兽医,2000,32(1):11~12.
8郑筱峰,刘栋,武彩红,等.甘油浓度和平衡时间对藏獒精液冷冻效果的影响[J].江苏农业科学,2010,(5):296~297.
9钟泉,闫福华,李艳芬.两种培养液对Beagle犬牙龈成纤维细胞生物学活性的影响[J].医学研究杂志,2010,39(8):42~45.
10郭宪,催泰保.藏獒品种资源保护与开发利用[J].家畜生态学报,2008,29(5):102~106.
11崔泰保,郭宪,鄢珣.河曲藏獒犬品种保护与选育研究[J].家畜生态学报,2009,30(2):22~25.
12Bonifacino J S,Dasso M,Harford J B,et al.章静波,方瑾,王海杰,等译.精编细胞生物学实验指南[M].北京:科学出版社,2007.
13Freshney R I.章静波,徐存栓,译.动物细胞培养———基本技术指南[M].北京:科学出版社,2008.
14Jang G,Park E S,Cho J K,et al.Preimplantational embryo de-velopment and incidence of blastomere apoptosis in bovine somat-ic cell nuclear transfer embryos reconstructed with long-term cul-tured donor cells[J].Theriogenology,2004,62:512~521.
15Jang G,Hong S G,Oh H J,et al.A cloned toy poodle producedfrom somatic cells derived from an aged female dog[J].Theriog-enology,2008,69:556~563.
16 Kim M K,Jang G,Oh H J,et al.Endangered wolves clonedfrom adult somatic cells[J].Cloning Stem Cells,2007,9:130~137.
17Li Q F,Liu Z S,Li Y X,et al.Origin and phylogenetic analysisof Tibetan Mastiff based on the mitochondrial DNA sequence[J].J Genet Genomics,2008,35:335~340.
18Poehland R,Al-Rostum F,Becher F,et al.Donor cell lines con-siderably affect the outcome of somatic nuclear transfer in thecase of bovines[J].Journal of reproduction and development,2007,53(4):737~748.
19 Xu H X,Yi Y,Li L,et al.Ultraviolet B-induced apoptosis ofhuman skin fibroblasts involves activation of caspase-8and-3withincreased expression of vimentin[J].Photodermatol Photoimmu-nol Ph,2010,26:198~204.