
载脂蛋白E(apo1ipoprotein E,apo E)是乳糜微粒(CM)、极低密度脂蛋白(VLDL)、高密度脂蛋白(HDL)的重要组分。
继人类apoE基因于1973年首次发现后,陆续在小鼠、大鼠、猪、狗、牛、猴子等动物体内也发现了它的踪影。而且在一些动物中,apoE基因的结构有较高的相似性,如人、猪和小鼠的apoE基因均由4个外显子和3个内含子组成。
apoE基因编码的apoE蛋白在稳定微管蛋白结构、细胞内信号传导、免疫调节、糖代谢、氧化应激、脂质代谢及其他细胞过程中发挥重要作用,与人类的衰老,心血管疾病密切相关,apoE基因的多态性及其表达越来越受到研究者的关注,其中小鼠被广泛用作该基因作用机制研究的动物模型。如apoE基因敲除小鼠的出现,增加了一个可用于评估研究人类衰老性疾病的动物模型,它有助于深化研究apoE基因的功能,为多种疾病的治疗提供了药物筛选的平台。尽管小鼠被广泛用作该基因作用机制研究的动物模型,但未见该基因在小鼠各种组织表达的研究报道。本研究通过对小鼠apoE基因表达谱的分析,为小鼠的apoE基因的研究及其动物模型的利用积累基础性的资料。
1、材料与方法
1.1试验动物:健康清洁级昆明种小鼠3只,雌性,40d龄,平均每只体重(28±3)g(广西医科大学实验动物中心提供,批号:06002002001)。处死动物前禁食12h,仅供饮水。颈椎脱臼处死动物,取心、肝、脾、肺、肾、脑、脊髓、胃、小肠、胸腺、肾上腺、胰腺、膀胱、子宫、主动脉、血液、腹肌等17种组织,每样组织标本约100mg,分别放入含有500μLRNA保存液(北京康为世纪生物科技公司)的1.5mLEP管中备用。
组织样本采集均于处死动物后30min之内完成,所用解剖工具和EP管均用0.1%DEPC(北京天根生化科技公司)水浸泡过夜后高温高压消毒。
1.2方法
1.2.1总RNA抽提:总RNA提取选用上述小鼠的心、肝等17种不同组织,取80~100mg组织样在无RNA酶的研磨器中匀浆后采用Trizol-异丙醇(美国Invitrogen公司)沉淀法提取总RNA,1%的琼脂糖凝胶电泳验证RNA的完整性,并于-70℃保存备用,具体操作按照Invitrogen公司提供的RNA提取试剂盒说明书进行。
1.2.2总RNA检测及浓度测定:总RNA的完整性可通过普通琼脂糖凝胶电泳检测。微量核酸蛋白分析仪(美国Quawell Technology.Inc)测量总RNA样品浓度,每个样本重复测量3次,取平均值。
1.2.3总RNA反转录:在经DEPC处理过的0.2mL离心管中加入总RNA,其中:肝RNA取3μL,脊髓、胰腺、心、肺、脾、肾、脑、胃、小肠、胸腺、肾上腺、膀胱、子宫、主动脉、血液和腹肌RNA各取5μL,分别加入1μLOligo(dT)18(100μmol/L)和1μLRandom Primer(100μmol/L)(加拿大MBIFermentas公司),用RNase-freeddH2O将体系补足至12μL。弹指混匀后短暂离心,65℃孵育5min,迅速置于冰上。
向反应体系加入5×MuLVBuffer4μL,d NTPs(10mmol/μL)2μL,Ribolock Inhibitor(5U/μL)1μL,M-MuLV反转录酶(5U/μL)1μL,使反应终体积为20μL,混合均匀并短暂离心,于45℃温育60min,70℃5min以灭活反转录酶,然后放置于冰上冷却。
1.2.4引物设计与PCR扩增:PCR扩增的引物设计参照GenBank中公布的Mus musculus apolipoprotein E的mRNA核酸序列(NM_009696.3),PCR引物由Oligo6.0软件设计,由上海生物工程公司合成。上游引物apoE-F:5’
-gaacaac-ccgcctcgtgacag-3’;下游引物apoE-R:5’
-tggcagtgcgctggcgac-ctt-3’,目的片段的长度为781bp。使用β-actin作为内参,上游引物β-actinF5’
-tgaccggcctgtatgctatc-3’,下游引物β-actinR5’
-tcacatgtctcgatcccagtag-3’,片段长度310bp。PCR反应条件:94℃预变性5min;94℃变性1min,61.5℃退火45s,72℃延伸1min,共35个循环,72℃延伸10min。取PCR产物5μL进行1.5%琼脂糖凝胶电泳,并在凝胶成像系统(美国Bio-Rad公司)上观察扩增效果并照相。
2、结果
2.1 17种组织总RNA的检测:小鼠17种组织总RNA1%琼脂糖凝胶电泳显示出2条清晰的条带,分别为28S和18S,表明总RNA较完好。经微量核酸蛋白分析仪测定,所提取的总RNA在260nm的吸收值与280nm的吸收值比值均在1.8~2.0之间,提示无蛋白质和其他杂质污染,提取的总RNA质量符合实验要求,可用于后续组织表达谱分析。
2.2 小鼠apoE基因组织表达谱分析:将小鼠各个组织反转录获得的cDNA作为模板用于组织表达谱分析。经PCR扩增后,取5μL产物在1.5%的琼脂糖凝胶中电泳。用Im-ageJ2X图像分析软件对3次电泳的图像进行处理和分析,并计算各组织的apoE基因相对表达量。结果显示:在40d龄小鼠的17种组织中,apoE都有不同程度的表达,各组织按相对表达量的大小依次为肝(62.2%)、脊髓(61.8%)、脑(58.0%)、肺(57.1%)、肾(55.4%)、心(55.3%)、脾(48.5%)、胸腺(35.8%)、小肠(29.6%)、胃(22.7%)、膀胱(18.5%)、血液(15.1%)、肾上腺(13.3%)、子宫(10.0%)、胰腺(8.7%)和主动脉(6.0%),但在腹肌(0.0%)无表达(图1)。
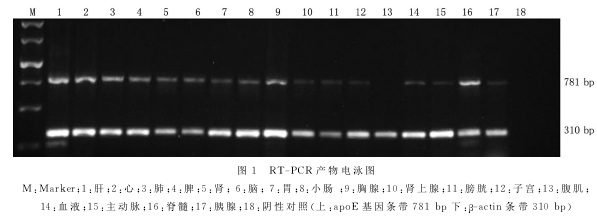
3、讨论
根据GenBank公布的资料,人(GeneID:348)、猪(GeneID:397576)和小鼠(GeneID:11816)3个物种的apoE基因结构都比较相似,均由4个外显子和3个内含子组成,第1,2号外显子都很短且对应的外显子长度都接近,约70bp。尽管这些物种的apoE基因的细微结构存在差异,但毫无疑问它们的功能是一样的,是参与胆固醇和脂类代谢的重要基因。小鼠的apoE基因位于7号染色体,其编码的apoE的氨基酸序列与人的有30%的差异,这些差异多存在于N端和C端,2个物种的apoE受体结合域(136~160bp)高度保守,25个残基中有21个是相同的,但从功能上看,这二者功能的相似度有多大还不清楚。国内外的许多研究都借助apoE基因敲除小鼠作为疾病模型,模拟糖尿病人由于血脂异常导致的神经性病变。用高脂饲料喂养apoE基因敲除小鼠时,小鼠血中胆固醇含量增高而且动脉出现粥样硬化等症状。另外,其巨噬细胞、T细胞和平滑肌细胞的生理反应和人类心血管疾病中的反应极为相似。可见,研究小鼠的apoE基因表达谱可以与人或其他物种的互相比较,从而为apoE基因作用机制积累基础性的资料。
为准确检测apoE基因表达,本研究在小鼠apoE基因的中段设计引物,目的片段长度为781bp,涵盖了apoE基因第1,2,3号外显子的全部和第4号外显子的一部分。结果显示apoE在肝表达量最高,脊髓和脑亦是高表达的组织。小鼠apoE基因在肝和中枢神经组织的高表达,提示这些组织是小鼠apoE的主要代谢场所,该基因在维护中枢神经系统的功能方面起着重要的作用,这与人和猪的apoE基因表达基本相同。
人体很多组织均有apoE合成,除了肝和脑外,肾也是apoE基因高表达区,猪的肾表达显然没有肝和脑的高。而小鼠肾的表达略高于大脑。小鼠和人的心、脾、胃均有表达,但猪的则未见有表达。根据现有的资料来看,小鼠和人的apoE基因表达一致的组织种类多于小鼠和猪。小鼠和人的apoE基因除了4个外显子有很高的同源性外,在基因的5’端约200bp的侧翼序列同样有较高的同源性。造成人、猪和小鼠的apoE表达方面的差异的原因除了遗传构成的原因外,可能涉及到其他调控系统。
人的巨噬细胞也是apoE合成的主要细胞之一,它可以通过合成分泌apoE,参与神经的再生与修复。虽然本研究没有专门分离小鼠的巨噬细胞,但小鼠的胸腺、主动脉和血液中存在着巨噬细胞,所以尚不能断定apoE基因的mRNA是由这些组织的实质细胞还是由其中所含的巨噬细胞产生,或者二者皆参与了apoE基因的表达。
薛越强等在构建人apoE基因的转基因小鼠时,发现人apoE基因在Fl代转基因鼠的多种组织中均有表达,其中最强的表达出现在肾,在脑和心中有中等程度的表达,而肝的表达较少,脾中则近乎没有表达。这与人的apoE基因在肝表达最强、脑次之以及小鼠的肝表达最强、脊髓次之明显不同,这些结果表明,apoE基因在转基因小鼠体内的表达有组织特异性,不同的遗传背景会导致apoE基因的表达谱的改变,在利用小鼠作为研究人类疾病模型时,应加以考虑。
参考文献:
[1]Shore VG,Shore B.Heterogeneity of human plasmavery low density lipoproteins.Separation of species dif-fering in protein components[J].Biochemistry,1973,12(3):502-507.
[2]Mahley RW.Apolipoprotein E:cholesterol transportprotein with expanding role in cell biology[J].Science,1988,240(4 852):622-630.
[3]Reardon CA,Getz GS.Mouse models of atherosclerosis[J].Current Opinion in Lipdology,2001,12(2):167-173.
[4]Horiuchi K,Tajima S,Menju M,et al.Structure and ex-pression of mouse apolipoprotein E gene[J].Journal ofBio1ogica1Chemistry,1989,106(1):98-103.
[5]Weisgraber K H.Apolipoprotein E:structure-functionrelationships[J].Ady Protein Chem,1994,45:249-302.
[6]Lucy M,Hinder,Andrea M,et al.Apolipoprotein Eknockout as the basis for mouse models of dyslipi-demia-induced neuropathy[J].Experimental Neurolo-gy,2013,239:102-110.
[7]Kitagawa K,Matsumoto M,Hori M,et al.Neuroprotec-tive effect of apolipoprotein E against ischemia[J].An-nals of the New York Academy of Sciences,2002,977(1):468-475.
[8] 李仕新,高萍,李加琪,等.猪载脂蛋白E基因的组织表达谱分析[J].四川农业大学学报,2011,29(4):540-543.
[9]Boyles JK,Zoellner CD,Anderson LJ,et al.A role forapolipoprotein E,apolipoprotein A-I,and low densitylipoprotein receptors in cholesterol transport during re-generation and remyelination of the rat sciatic nerve[J].Clin Invest,1989,83(3):1 015-1 031.
[10]薛越强,屠亚军,杨鹏,等.apoE4近交系转基因鼠的高脂血症表现和自发变换行为损害[J].中国生物化学与分子生物学报,2002,18(6):772-775.广西医科大学学报2013Dec;30(6)
本文简要分析了基因编辑技术原理及其作用机制, 并探讨了其在基因治疗中的应用现状和进展, 最后结合实际情况, 指出基因编辑技术在应用过程中的挑战及解决路径...
转基因是利用基因工程技术而整合到动物受体细胞基因组中的外源基因,转基因技术是使用基因工程技术使外源基因稳定整合到动物受体细胞基因组中,并能够得到表达和遗传的生物技术,由此得来的动物即为转基因动物。...
枯草芽孢杆菌(Bacillussubtilis)是革兰氏阳性细菌,是一种重要工业酶制剂的生产菌,中国农业部批准使用的安全菌株,现已广泛应用于食品发酵行业.在基因工程操作中,因为高拷贝外源质粒在B.subtilis中的稳定性较差,造成复制过程中大量单链脱氧核糖核酸...
石油是一种黏稠、深褐色的液体,由不同烃类化合物和其他有机化合物组成的复杂混合物,其中包括一些有机金属组分,主要是矾和镍化合物。...
从基因的可专利性、目前基因技术保护存在的问题, 及对我国基因技术立法保护等方面进行论述, 以期有助于完善我国基因专利保护的立法。...
动物卵母细胞体外成熟(IVM)、体外受精(IVF)、卵胞浆内单精子注射(ICSI)和克隆等技术是动物胚胎工程的主要研究内容之一。近年来,家畜卵母细胞的体外成熟培养技术得到进一步提高,不仅为家畜胚胎生物技术提供了大量卵源,同时也是研究卵母细胞发生和发...
讨论了基因编辑技术的应用历史, 特别在农业应用方面, 重点关注了CRISPR/Cas9系统在水稻基因编辑中的应用, 阐述了CRISPR/Cas9在基因组编辑领域的问题和其他应用方面的困难...
0、引言STK11(serine/threoninekinase11,STK11)基因最早是从Peutz-Jeghers综合征(Peutz-Jegherssyndrome,PJS)患者中发现的,目前被认为是一种抑癌基因,参与多个生物学过程和信号通路。我们构建含目的基因STK11的EGFP融合载体转染A549和H460细胞,并探讨其...
分子筛多孔晶体材料因其特殊的孔道结构,被广泛用于吸附分离、催化反应、离子交换等领域,在石油化工、精细化工及功能材料中有重要应用....
本文简要概述了抑制性差减杂交技术的基本原理、优越性、缺陷及其在相关基因克隆方面的应用研究进展。大家在相关论文写作时,可以参考这篇题目为抑制性差减杂交技术在基因克隆中的运用现状的基因工程论文。原标题:抑制性差减杂交技术(SSH)及其应用研究进...