维生素对人体生长、代谢、发育过程中发挥着重要的作用,是人和动物为维持正常的生理功能而必须从食物中获得的一类微量有机物质,下面我们就为大家介绍一下关于维生素论文范文,供给大家作为一个参考。
关于维生素论文范文第一篇:维生素在炎症性肠病中的研究
作者:邢晗 杜美萱 马嘉泽 丁康 张苏闽
作者单位:南京中医药大学研究生院 南京中医药大学附属南京中医院肛肠科
摘要:炎症性肠病(IBD)是一种病变可累及整个消化道的慢性炎症性疾病,其病因尚未明确。由于其病程迁延、病情反复难愈,往往会对患者的营养状况造成严重影响。IBD患者营养不良的情况中常包含多种维生素缺乏,其原因可能与摄入过少、肠道吸收障碍、肠道细菌过度生长及相关药物使用有关。本文现对IBD相关的几种常见维生素在IBD中的研究作一综述,旨在对IBD维生素缺乏的临床研究及治疗起到帮助。
关键词:炎症性肠病;维生素;肠上皮屏障;兔疫调节;
作者简介:邢晗(1995.6-),男,江苏镇江人,硕士研究生,主要从事炎症性肠病和肛门外科疾病的诊治研究;*张苏闽(1957.5-),男,江苏南京人,本科,主任中医师,主要从事炎症性肠病和肛门外科疾病的诊治研究;
基金:国家中医药管理局"中医肛肠病学"重点学科青年人才培育计划重点项目(编号:GCPY201902);
Abstract:Inflammatory bowel disease(IBD) is a chronic inflammatory disease in which the disease can affect the entire digestive tract, and its etiology is unclear.Due to the prolonged course of the disease and the repeated difficulty in healing, it often has a serious impact on the nutritional status of patients.Malnutrition in patients with IBD often includes a lack of multivitamins. The reasons may be related to insufficient intake, intestinal absorption disorders, overgrowth of intestinal bacteria, and the use of related drugs.This article now reviews the research of several common vitamins related to IBD in IBD, aiming to help clinical research and treatment of IBD vitamin deficiency.
Keyword:Inflammatory bowel disease; Vitamins; Intestinal epithelial barrier; Immune regulation;
炎症性肠病(IBD)包括溃疡性结肠炎(UC)与克罗恩病(CD),是一种可累及整个消化道的慢性炎症性疾病,其具体病因尚不明确,目前认为可能与遗传、免疫、感染、环境及肠道微生物等多种因素的综合作用有关,常用治疗药物包括5-氨基水杨酸制剂(5-ASA)、糖皮质激素、微生态制剂、免疫抑制剂和生物制剂等。由于IBD病程漫长、病情反复迁延不愈,肠道溃疡和炎症、肠道吸收障碍等病理现象在疾病过程中又持续存在,因此很多患者在疾病活动期或缓解期都存在着多种营养元素缺乏的状况。IBD患者常见的营养元素缺乏包括蛋白质、脂类、维生素、微量元素与矿物质等。其中,维生素是一类维持正常生理功能的有机微量物质,在人体的生长发育和代谢中发挥重要作用。因其大部分都必须通过食物摄入,故近年来维生素的缺乏在食物摄取和吸收不足的IBD相关疾病中受到重视。除维生素本身的功能外,其中一部分在IBD疾病本身产生影响,现将维生素D、维生素B12与叶酸、维生素A、维生素K在IBD中的研究进行综述,旨在为该病的治疗提供理论参考。

1 维生素D
人体的维生素D主要来源于自然界的光照和食物摄入。进入体内的维生素D在肝脏中羟基化为25-羟基维生素D[25(OH)D],在肾脏中进一步羟基化为1,25二羟基维生素D[1,25(OH)2D]进而与维生素D受体(vitamin D receptor,VDR)结合并参与靶基因的表达调控。目前临床上一般通过测定血清25(OH)D来评估机体维生素D的水平,根据参考值分级[1]:25(OH)D小于30 ng/ml可被定义为不足,小于20 ng/ml即为缺乏,小于10 ng/ml为严重缺乏。维生素D的缺乏在IBD患者中具有普遍性。有研究显示[2],UC患者中有31.6%存在维生素D缺乏,而在CD患者中缺乏更为广泛为38.1%.导致患者缺乏维生素D的原因众多,除了常见的食物摄入不足与缺少日照外[3],糖皮质激素的使用与胃肠道手术是IBD患者维生素D吸收减少的特异性因素[4,5].
维生素D在维持骨量和调节钙磷平衡上起到重要作用,是主要的骨骼生长及重塑因子,其缺乏往往对骨质影响较为明显。在IBD患者中,骨质疏松是常见并发症,发病率达18%~42%,而受其影响发生的骨折风险约比普通人群高40%[6].但有研究表明[7],维生素D可能只与IBD疾病活动本身有关,与骨质相关指标无明显关联。在对血清25(OH)D与IBD相关疾病指标进行测定分析后,Lopez-Munoz P等[8]发现,IBD患者血清25 (OH)D与粪便钙卫蛋白水平呈负相关,UC患者中C反应蛋白与血清25(OH)D水平相关。Garg M等[9]利用PCR对IBD患者肠道VDR基因表达进行测定,并与相应的炎症程度相比较,发现前后存在显著的反比关系。这表明维生素D及VDR可能影响IBD疾病活动度及炎症水平。
最新的一些研究分析了维生素D在IBD炎症过程中的具体作用,包括保护肠上皮屏障、调节免疫系统与肠道菌群等,而维生素D与VDR的缺乏可能会引起这些功能障碍并加重炎症。肠上皮屏障主要功能为抵御病原体、各种抗原与有毒物质,在感染或炎症的条件下这种屏障会遭到破坏。紧密连接蛋白是构成肠上皮屏障的重要分子,Zhang YG等[10]观察到由硫酸葡聚糖钠(DSS)与沙门氏菌诱导的小鼠肠炎模型中,紧密连接蛋白Claudin-2表达明显上调,在进行VDR敲除的小鼠中更为明显,而上调维生素D或VDR会对感染或炎症导致的肠上皮屏障损伤起到保护作用。相类似的研究亦表明[2],维生素D通过调节紧密连接蛋白或抑制上皮凋亡来保护肠上皮屏障。免疫系统分为先天性与适应性免疫,在先天性免疫中,维生素D刺激多种免疫细胞产生对肠道具有保护作用的抗菌肽(如β-防御素2与凯萨林菌素抗菌肽),这种刺激作用受到核苷酸结合寡聚化结构域蛋白2(NOD2)的调控,而维生素D可以通过调节NOD2来保证抗菌肽的产生,从而一定程度上预防IBD的发生[11,12].在适应性免疫中,VDR对于控制炎症细胞CD8+T细胞的增殖非常重要,1,25(OH)2D抑制了Th1与Th17等免疫细胞,同时促进了调节性T细胞(Tregs)的表达而对炎症起到了抑制作用[2,13].肠道菌群失调是IBD肠道炎症发生的另一重要因素,维生素D与VDR的缺乏可能会导致变形菌定植增加,引起其他菌群失调,维生素D可能通过调节肠道菌群而对IBD产生治疗作用[12].另外,维生素D在促进抗炎因子IL-10生成、抑制抗肿瘤坏死因子-α(TNF-α)的表达中也有着重要作用[14].
2 维生素B12与叶酸
维生素B12(钴胺素)与叶酸(维生素B9)是水溶性维生素,对于人体内红细胞的生成和神经系统的调节至关重要[15].其中,维生素B12是唯一一种需要借助胃十二指肠中由壁细胞分泌的内在因子才可吸收的维生素,在此之前,通过胃中的盐酸和胃蛋白酶与其结合形成复合物,然后复合物通过回肠末端的粘膜被吸收[16].相较而言,叶酸广泛存在于各种动植物食物中,一般在近端小肠被吸收。由于维生素B12与叶酸一般在小肠进行吸收,CD常累及上消化道,并且许多CD患者进行小肠段切除术(尤其回肠末段),而UC患者的病变部位通常在结肠,所以维生素B12与叶酸的缺乏在CD患者中更为常见,在UC患者与普通人群中并无明显差异[15,16].但目前有研究指出[17],无确切证据表明维生素B12的缺乏与回肠切除相关,可能仅取决于疾病活动程度,但回肠切除30 cm以上的患者往往存在叶酸缺乏并需要补充治疗。除此之外,远端肠道瘘管形成与小肠细菌过度生长亦会导致维生素B12缺乏[16],IBD患者叶酸的缺乏则很有可能归因于5-ASA及免疫抑制剂的使用[17,18].
维生素B12能够降低体内同型半胱氨酸(HCY)或甲基丙二酸(MMA)的浓度。一般情况下,血清钴胺素<148 pmol/L(200 ng/L)和HCY或MMA升高往往可定义为维生素B12缺乏症[19].维生素B12缺乏往往引起巨幼细胞性贫血或神经症状[20].24%IBD患者会发生贫血[18],包括27%的CD患者与21%的UC患者,而在IBD患者出现的所有贫血类型中,由维生素B12和叶酸缺乏引起的巨幼细胞性贫血仅占1.5%,大部分贫血患者仍然属于缺铁性贫血,而维生素B12与叶酸又与铁的吸收息息相关,因此仍不可忽视其对贫血的影响。维生素B12及叶酸缺乏导致的神经系统症状较为多见,但并无相关文献准确说明神经症状在IBD中的特殊性,Becker J等[21]报道了IBD患者不安腿综合征的出现可能与维生素B12和叶酸的缺乏有关。故维生素B12与叶酸缺乏导致的相关症状在IBD患者与普通人群中可能并无明显差异。
维生素B12与叶酸的缺乏在IBD肠道炎症起到的作用目前被广泛研究。Harb Z等[22]在DSS诱导的小鼠结肠炎模型中发现维生素B12缺乏引起抗炎因子IL-10的表达减少,与之相应的是促炎因子白介素-1β和单核细胞趋化蛋白-1的表达的升高。Melhem H等[23]认为维生素B12与叶酸的匮乏通过促进了SIRT1内质网应激而加强了肠道炎症。高同型半胱氨酸血症常常并发于低维生素B12水平,Gao X等[24]在大鼠体内注射了不同剂量的HCY,发现HCY可以剂量依赖的形式通过MAPK通路诱导CD4+T细胞分化为Th17细胞,进而促进了炎症。关于对肠道菌群的影响,Lurz E等[25]利用对DSS诱导的肠炎模型小鼠体内维生素B12进行增减后得出结论,维生素B12并不会影响肠道内菌群的种类,但会导致具体菌群中存在数量的变化(乳酸杆菌的减少及类杆菌的增多)。近年有研究报道[26],叶酸的缺乏导致患结直肠癌的风险增高,尤其在IBD患者中,5-ASA的广泛使用竞争性地减少了机体对叶酸的吸收,增大了IBD转化为结直肠癌的可能性,而适量地补充叶酸可以有效地降低这种风险。
3 维生素A
维生素A是一种脂溶性维生素,指所有具有视黄醇生物活性的化合物的统称,包括视黄醇、视黄醛、视黄酸与视黄酯等。维生素A的缺乏在夜盲症中的作用为人熟知,实际上,它调节多种生物过程,如胚胎发育、细胞分化和增殖、维持上皮细胞完整性和免疫功能等[27].维生素A的摄入通常来自食物,包括植物中所含的类胡萝卜素和动物中的视黄酯。通过测定血清中视黄醇浓度的下降可提示维生素A缺乏,但很少有对IBD患者进行维生素A水平的测定的研究。此前,Fabisiak N等[28]对323例CD患者和761名正常对照人群及114例UC患者和472名正常对照人群进行体内维生素A水平的测定,发现IBD患者组维生素A水平明显低于正常对照组。
研究显示[29],维生素A参与了维持肠道粘膜完整性和调节正常免疫功能。脂多糖(LPS)可通过诱导如Zo-1、Occludin和Claudin-1等紧密连接蛋白的减弱而破坏了肠上皮屏障,同时增加了肠壁通透性,进一步加重了炎症。He C等[30]通过实验发现维生素A能够上调紧密蛋白的表达而恢复LPS带来的炎症损伤。在免疫调节上[31],维生素A能够参与调节CD4+T细胞分化和维持CD4+T细胞稳态,包括对一些自身免疫性疾病动物模型的免疫反应做出相应调节,例如类风湿关节炎、1型糖尿病和实验性脊髓炎等。全反式维甲酸(ATRA)是维生素A中活性最强的表现形式,也是重要的肠道免疫调节剂,可增强Tregs的效应,抑制Th17的产生及其功能。Hong K等[32]使用ATRA对DSS诱导的肠炎模型小鼠进行干预,发现ATRA下调了NF-κB与TNF等炎症因子的表达,从而抑制了巨噬细胞过度激活而引发的适应性免疫反应。维生素A的缺乏会引起肠道菌群的失调,而这种结果正是来自于维生素A调节肠道屏障与免疫反应的间接作用[33].IBD相关结直肠癌的发生可能与ATRA缺乏有关,而ATRA的治疗作用可能是由CD8+T细胞介导的,ATRA诱导了肿瘤细胞的凋亡从而对结直肠癌起到了治疗作用[34].对于IBD相关的结直肠癌,ATRA可能是有效的治疗靶点。
4 维生素K
维生素K包含多种形式,常见的有K1、K2、K3、K4,其中最主要的形式是叶醌(维生素K1)和甲萘醌(维生素K2)。人体内维生素K的补充来源于食物(尤其为绿色蔬菜)摄入和肠道细菌合成。一般而言,维生素K被认为与凝血功能相关,比如它作为凝血因子γ-谷氨酰羧化酶的辅酶以及多种凝血因子的合成物质[35],而维生素K的缺少会引起这些凝血因子数量及功能的低下,导致多种出血性疾病的发生。
近年,维生素K在骨骼代谢和血管生成中的作用得到明确,在此方面,维生素K2的作用尤为重要。相关文献表明[36],维生素K2可以通过促进成骨细胞分化和骨钙素羧化、上调骨骼生长因子(如碱性磷酸酶和胰岛素样生长因子-1等)和减少成骨细胞中促凋亡蛋白的表达来促进骨骼生长。基质Gla蛋白是由血管平滑肌细胞和软骨细胞合成的维生素K依赖性细胞外基质蛋白,一般用于预防血管钙化,目前被认为可能是间充质基质细胞介导的免疫调节治疗实验性IBD小鼠新的重要介质。在血管中,维生素K2通过基质Gla蛋白和富含Gla蛋白的羧化作用减少羟基磷灰石的形成,通过增加生长停滞特异性基因6来抑制血管平滑肌细胞的凋亡,并减少血管平滑肌向成骨细胞的转化。
在炎症治疗上,维生素K被证明可降低NF-κB磷酸化并增加具有抗氧化作用的Nrf2蛋白的表达,从而对血管炎症起到治疗作用[37].在DSS诱导的肠炎模型小鼠中,Shiraishi E等[38]发现维生素K缺乏组小鼠细胞中促炎因子IL-6表达高于维生素K增加组,抗炎因子IL-10却明显低于增加组,说明了维生素K的缺乏对肠道炎症有促进作用。Brnic D等[39]对IBD患者及普通人群血浆中去磷酸化及去羧基化的基质Gla蛋白(dp-uc MGP)进行测定,发现前者dp-uc MGP明显高于后者,并且dp-uc MGP与粪便钙卫蛋白和C反应蛋白水平呈正比,这也侧面反应了维生素K相关蛋白的缺乏会促进IBD炎症发展,但具体的作用方式需要进一步研究。
5 总结
维生素作为重要的营养物质,其缺乏在所有人群中都较为常见,而在IBD患者中,越来越多的研究表明,这种缺乏所带来的不仅是营养不良或是维生素的功能障碍,更多的是对IBD疾病起到的严重影响,包括疾病活动度、炎症相关因素及IBD相关疾病转化等。虽然在过去的研究中,许多维生素已被证明存在IBD方面的病理生理学作用,但其他多种维生素仍缺乏IBD相关的流行病学及统计证据,并且在临床患者中缺少具体的病例研究,而且这些成果目前局限于许多基础实验之中,对临床IBD患者难以起到确切的诊疗作用,这也是维生素缺乏在IBD中需要进一步研究的目标与方向。
参考文献
[1]Eastell R,O'Neill TW,Hofbauer LC,et al.Postmenopausal osteoporosis[J].Nat Rev Dis Primers ,2016(2):16069.
[2]Gubatan J,Moss AC.Vitamin D in inflammatory bowel disease:more than just a supplement[J] .Curr Opin Gastroenterol,2018,34(4):217-225.
[3]Vemnia P.Burrelli Scotti G,Dei Giudici A,et al.Inadequate sunlight exposure in patients with inflammatory bowel disease[J]J Dig Dis,2018,19(1):8-14.
[4]Chedid VG,Kane SV.Bone Health in Patients With Inflammatory Bowel Diseases[J].J Clin Densitom,2020,23(2):182-189.
[5]Lima CA,Lyra AC ,Rocha R.et al.Risk factors for osteoporosis in inflammatory bowel disease patients[J] World J Gastrointest Pathophysiol,.2015.6(4)。210-218.
[6]Oh HJ,Ryu KH,Park BJ,et al.Osteoporosis and Osteoporotic Fractures in Gastrointestinal Disease[J]J Bone Metab,2018,25(4):213-217.
[7]Weisshof R,Chermesh 1.Micronutrient deficiencies in inflammatory bowel disease[J].Curr Opin Clin Nutr Metab Care,2015,18(6):576-581 .
[8]Lopez-Munoz PBeltran B,Saez-Gonzalez E,et al.Infuence of Vitamin D Deficiency on Inflammatory Markers and Clinical Disease Activity in IBD PatientsIJ.Nutrients ,2019, 11(5):1059.
[9]Garg M.Royce sG,Tikellis C,et al.The intetinal vitamin D receptor in inflammatory bowel disease:inverse correlation with inflammation but no relationship with circulating vitamin D status[J].Therap Adv G
astroenterol,2019(12)-:1756284818822566.
[10]Zhang YG,Lu R,Xia Y,et alLack of Vitamin D Receptor Leads to Hyperfunction of Claudin-2 in Intestinal Inflammatory Responses[J].Inflamm Bowel Dis 2019,25(1):97-110.
[1]Dimitrov V,White JH.Vitamin D signaling in intestinal innate immunity and homeostasis[J].Mol Cell Endocrinol,.2017(453)-68-78.
[12]Tabatabaeizadeh SA,Tafazoli N,Ferms GA,et al.Vitamin D,the gut microbiome and inflammatory bowel diseasel[J]J Res Med Sci,2018(23):75.
[13]Yamamoto E,Jorgensen TN Ilmmunological effects of vitamin D and their relations to autoimmunity[J].J Autoimmun,2019(100):7-16.
[14]Olmedo-Martin RV,Gonzalez-Molero 1,Olveira G,et al.Vitamin D in Inflammatory Bowel Disease Biological,Clinic al and Therapeutic Aspects[J] Curr Drug Metab ,2019,20(5)-390-398.
[15]Battat R,Kopylov U,Byer J,et al.Vitamin B12 deficiency in inflammatory bowel disease:a prospective observational pilot study[J] Eur J Gastroenterol Hepatol,2017,29(12):1361-1367.
[16]Huang S,Ma J,Zhu M,et al.Status of serum vitamin B12 and folate in patients with inflammatory bowel disease in China[J].Intest Res ,2017,15(1):103-108.
[17]Ghishan FK,Kiela PR.Vitamins and Minerals in Inflammatory Bowel Disease[J] Gastroenterol Clin North Am,2017 ,46(4):797-808.
[1 8]Madanchi M,Fagagnini S,Fournier N,et al.The Relevance of Vitamin and Iron Deficiency in Patients with Inflammatory Bowel Diseases in Patients of the Swiss IBD Cohort[J] Inflamm Bowel Dis ,2018,24
(8):1768-1779.
[1 9]Martinez Gomez MJ,Melian Fernandez C ,Romeo Donlo M.Nutricion en enfermedad in amatoria intestinalNutrition in inflammatory bowel disease][J]. Nutr Hosp,2016,33(Suppl 4):348.
[20]Battat R,Kopylov U,Szilagyi A.et al.Vitamin B12 deficiency in inflammatory bowel disease: prevalence,isk factors,evaluation,and management[J.Inflamm Bowel Dis,2014,20(6):1120-1128.
[21]Becker J,Berger F,Schindlbeck KA,et al.Restless legs syndrome is a relevant comorbidity in patients with inflammatory bowel disease[J].Int J Colorectal Dis,2018,33(7):955-962.
[22]Harb Z,Deckert V,Bressenot AM,et al.The deficit in folate and vitamin B12 triggers liver macrovesic ular steatosis and inflammation in rats with dextran sodium sulfate-induced colitis[J].J Nutr Biochem,20
20(84):108415.
[23]Melhem H,Hansmannel F,Bressenot A,et al.Methyl-deficient diet promotes colitis and sIRT1-mediated endoplasmic reticulum stress[J]. Gut,2016,65(4):595-606.
[24]Gao X,LiJ,Chen M. Effect of Homocysteine on the Differentiation of CD4+T Cells into Th17 Cells[J]. Dig Dis Sci,2018.6312)-3339-3347.
[25]Lurz E,Horne RG,Maattanen P,et al.Vitamin B12 Deficiency Alters the Gut Microbiota in a Murine Model of Colitis[J]. Front Nutr,2020(7):83.
[26]Burr NE,Hull MA,Subramanian V.Folic Acid Supplementation May Reduce Colorectal Cancer Risk in Patients With Inflammatory Bowel Disease:A Systematic Review and Meta-Analysis[J].J Clin Gastroe
nterol,2017,51(3):247-253.
[27]Bar-EI Dadon S,Reifen R.Vitamin A and the epigenome[J].Crit Rev Food Sci Nut,2017,57(11):2404-2411.
[28]Fabisiak N,Fabisiak A,Watala C,et al.Fat-soluble Vitamin Deficiencies and Inflammatory Bowel Disease :Systematic Review and Meta-Analysis[J]J Clin Gastroenterol,.2017,51(10):878-889.
[29]Pattanakits akul P,Chongviriyaphan N,Pakakasama S.et al.Effect of vitamin A on intestinal mucosal injury in pediatric patients receiving hematopoietic stem cell transplantation and chemotherapy:a quas
ai-randomized trial[J.BMC Res Notes ,2020,13(1):464.
[30]He C,Deng J.Hu X,et al.Vitamin A inhibits the action of LPS on the intestinal epithelial barrier function and tight junction proteins[J].Food Funct,2019, 10(2):1235-1242.
[31]de Medeiros PHQS,Pinto DV,de Almeida JZ.et al.Modulation of Intestinal Immune and Barrier Functions by Vitamin A:lmplic ations for Current Understanding of Malntrition and Enteric Infections in Child
ren[J.Nutrients,2018,10(9):1128.
[32]Hong K,Zhang Y,Guo Y,et al.Al-trans retinoic acid attenuates experimental colitis through inhibition of NF-KB signaling[J.Immunol Lett,2014,162(1 Pt A):34-40.
[33]Cantomna MT,Snyder L,Arora J.Vitamin A and vitamin D regulate the microbial complexity, barrier function,and the mucosal immune responses to ensure intestinal homeostasis[J].Crit Rev Biochem Mol B
iol,2019,54(2):184-192.
[34]Bhattacharya N,Yuan R,Prestwood TR,et al.Normalizing Microbiota-Induced Retinoic Acid Deficiency Stimulates Protective CD8(+)T Cell-Mediated Immunity in Colorectal Cancer[J].mmunity,2016,45(3):
641-655.
[35]Hao Z,Jin D,Chen X,et al.y-GlutamyI carboxylase mutations dffrentially affect the biological function of vitamin K-dependent proteins[J] Blod,2021,137(4)-:533-543.
[367]illa JKD,Diaz MAN,Pizziolo VR,et al.ffect of vitamin K in bone metabolism and vascular calcific ation:A review of mechanisms of action and evidences[J].Crit Rev Food Sci Nutr,2017,57(18):3959-397
[37]Dihingia A,Ozah D,Baruah PK,et al.Prophylactic role of vitamin K supplementation on vascular inflammation in type 2 diabetes by regulating the NF-KB/Nrf2 pathway via activating Gla proteins[J].Food F
unct,2018.,9(1):450-462.
[38]Shiraishi E, ljima H,Shinzaki S,et al.Vitamin K deficiency leads to exac erbation of murine dextran sulfate sodium-induced clitis[J.J Gastroenterol,2016,51(4):346-356.
[39]Bmic D,Martinovic D,Zivkovic PM,et al.lnactive matrix Gla protein is elevated in patients with inflammatory bowel disease[J].World J Gastroenterol,20.2632)4866-4877.
文献来源:邢晗,杜美萱,马嘉泽,丁康,张苏闽。维生素在炎症性肠病中的研究[J].医学信息,2021,34(12):28-31.
关于维生素论文范文第二篇:补充维生素D对空腹血糖受损患者胰岛素抵抗的影响
作者:曾雅琳 王晓华
作者单位:南华大学附属长沙中心医院健康管理中心
摘要:目的:通过对空腹血糖受损人群进行维生素D的补充后,观察其血糖及胰岛素抵抗、25(OH)D等代谢指标是否得到改善,并分析25(OH)D与胰岛素抵抗是否存在相关性。方法:将2018年1-12月在我中心体检诊断空腹血糖受损的70例患者分为对照组与干预组,各35例,均予饮食+运动干预,在此基础上干预组再补充阿法骨化醇软胶囊12周。观察患者干预前后体重指数(BMI)、血清25(OH)D、空腹血糖(FBG)、空腹胰岛素(Fins)、糖化血红蛋白(HbA1c),并计算胰岛素抵抗指数(IRI)、胰岛素分泌指数,分析血清25(OH)D与空腹血糖受损相关指标的相关性。结果:干预组治疗后血清25(OH)D明显升高,FBG、Fins、HbA1c、BMI均较干预前下降,HOMA-IR较干预前改善差异具有统计学意义(P<0.05);HOMA-β干预前后比较差异无统计学意义(P>0.05)。对照组FBG、Fins、BMI较干预前下降,HOMA-IR较干预前改善,差异有统计学意义(P<0.05);血清25(OH)D、HbA1c、HOMA-β前后比较差异无统计学意义(P>0.05)。干预后两组间比较发现血清25(OH)D、FBG、Fins、HbA1c、BMI、HOMA-IR、HOMA-β差异均无统计学意义(P均>0.05)。血清25(OH)D与FBG、Fins、HbA1c、HOMA-IR、HOMA-β没有相关性(P均>0.05)。结论:饮食+运动能明显改善胰岛素抵抗及降低血糖;小剂量短时间补充活性维生素D对改善胰岛素抵抗及胰岛β细胞功能和降低血糖无明显益处;血清25(OH)D水平与空腹血糖、空腹胰岛素、糖化血红蛋白、胰岛素抵抗和胰岛β细胞功能指数无明显相关性。
关键词:空腹血糖调节受损;血清25(OH)D;胰岛素抵抗;
随着我国人民生活水平不断提高和人口老年化进程不断加剧,糖尿病发病率越来越高。我国成人糖尿病患病率为10.9%,糖尿病前期为35.7%[1].合并空腹血糖受损和糖耐量异常者6年累计糖尿病发生率高达64.5%[2].近年来的研究发现维生素D与糖尿病关系密切,有学者发现胰岛β细胞上存在维生素D受体(VDR),维生素D活化后可以抑制胰岛β细胞凋亡、促进胰岛素分泌[3],从而减少胰岛素抵抗及糖尿病产生。本课题通过对空腹血糖受损人群进行维生素D的补充后,观察其血糖及胰岛素抵抗、25(OH)D等代谢指标是否得到改善,并分析25(OH)D与胰岛素抵抗是否存在相关性。

1 资料与方法
1.1 一般资料
选取2018年1-12月在我中心体检诊断空腹血糖受损的患者70例。纳入标准:符合WHO(1999)糖代谢状态分类标准,空腹血糖受损:静脉血空腹血糖≥6.1mmol/L、<7.0mmol/L,OGTT试验,糖负荷2h血糖<7.8mmol/L.排除标准:(1)曾经确诊为糖尿病者;(2)检查前1个月曾有影响血糖的因素存在,如严重创伤、感染等;(3)检查前12个月内使用全身糖皮质激素者或1个月内使用过非甾体类抗炎药物者;(4)因为其他疾病或药物引起空腹血糖升高者;(5)肝肾疾病、骨质疏松及其他代谢性骨病,近期服用维生素D类药物及钙剂者。所选患者均签署了知情同意书,且经过南华大学附属长沙中心医院伦理委员会审批。采用随机数字法分为干预组和对照组。两组间年龄、BMI、血清25(OH)D、空腹血糖、空腹胰岛素、糖化血红蛋白、胰岛素抵抗指数、胰岛素分泌指数比较差异均无统计学意义(P均>0.05),具有可比性。
1.2 方法
1.2.1 两组患者均在营养师指导下进行饮食干预,同时根据患者体重、身高、喜好制定运动治疗方案。干预组在饮食+运动干预基础上予以阿法骨化醇软胶囊(阿法迪三,国药准字J20130162,规格0.25μg×20粒)0.25μg/次,2次/d, 疗程为12周。记录所有患者的性别、年龄等基本资料,由同一体重计测量身高、体重并计算体重指数(BMI)。
1.2.2 两组患者均于治疗前、后清晨空腹(禁食10~12h)抽取肘正中静脉血检测血清25(OH)D、空腹血糖(FBG)、空腹胰岛素(Fins)、糖化血红蛋白(HbA1c)。采用化学发光免疫分析法测定血清25(OH)D水平,葡萄糖氧化酶法测FBG,ELISA检测Fins.采用稳态模型评估法(HOMA)中HOMA-IR计算胰岛素抵抗指数:HOMA-IR=Fins(mU/L)×FBG(mmol/L)/22.5;HOMA-β计算胰岛素分泌指数:HOMA-β=20×Fins/(FBG-3.5)。
1.3 统计学方法
应用SPSS17.0统计学软件包进行数据分析,计量数据以均数±标准差(x?±s)表示,两组间比较采用独立样本t检验,组内前后对照比较采用配对样本t检验。双变量相关分析采用Pearson相关分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者干预前后组内、组间比较
干预组治疗前后对比发现血清25(OH)D明显升高,FBG、Fins、HbA1c、BMI均较干预前下降,HOMA-IR较干预前改善,差异均有统计学意义(P<0.05);HOMA-β干预前后比较差异无统计学意义(P>0.05)。对照组前后进行对比发现FBG、Fins、BMI较干预前下降,HOMA-IR较干预前改善,差异均有统计学意义(P<0.05);血清25(OH)D、HbA1c、HOMA-β干预前后比较差异无统计学意义(P>0.05)。见表1.干预后组间各指标比较,差异无统计学意义(P<0.05)。
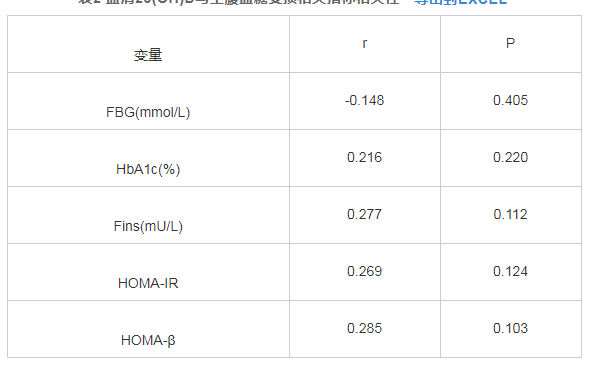
2.2 血清25(OH)D与空腹血糖受损相关指标相关性
血清25(OH)D与FBG、Fins、HbA1c、HOMA-IR、HOMA-β没有相关性(P>0.05),见表2.
表1 两组患者干预前后组内组间比较(x?±s) 导出
BMI26.72±2.7225.79±2.253.650.0026.78±2.6126.34±2.342.200.04-0.960.35
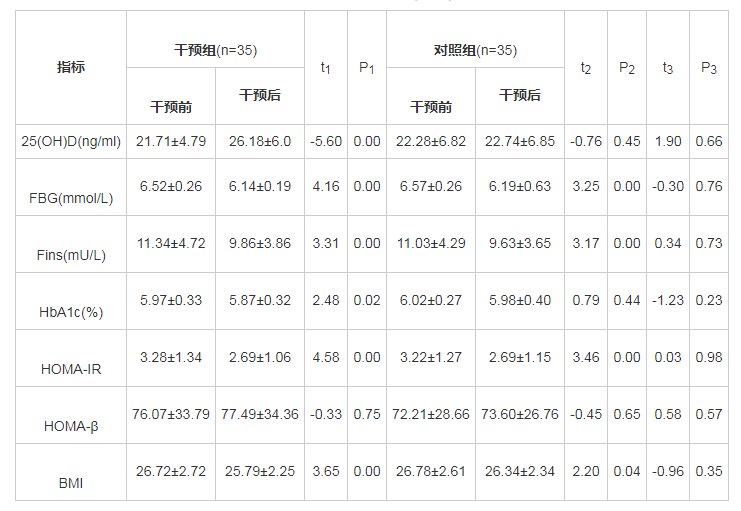
注:t1:干预组治疗前后对比;t2:对照组治疗前后对比;t3:治疗后两组比较。
3 讨论
胰岛素抵抗(IR)是2型糖尿病发病的重要因素,在糖尿病前期就已经存在。维生素D是生理条件下葡萄糖刺激胰岛素分泌及维持正常糖耐量的必须物质,有研究发现维生素D缺乏可降低胰岛β细胞分泌胰岛素量并加重胰岛素抵抗[4].同时也有研究显示维生素D缺乏与胰岛素抵抗及胰岛β细胞功能没有相关性[5,6].
本文对糖尿病前期人群中的空腹血糖受损患者进行饮食+运动干预,发现FBG、Fins、BMI均较干预前下降,HOMA-IR较干预前明显改善,提示强化生活方式干预对降低血糖及胰岛素抵抗改善有明显作用。同时本文还发现对空腹血糖受损患者在饮食+运动基础上予以短期(12周)小剂量活性维生素D后血清25(OH)D水平明显上升,但是FBG、Fins、HbA1c、HOMA-IR、HOMA-β与对照组相比并无统计学差异,提示短期小剂量补充活性维生素D对降低血糖及改善胰岛素抵抗和胰岛β细胞功能无明显益处。Li X等[7]进行荟萃分析观察到补充维生素D并不能明显改善FBG、Fins、HbA1c, 这与本文结果一致。目前尚不清楚维生素D实现非骨骼功能的适当剂量。Nazarian S等[8]在一项前瞻性研究中发现大剂量短时间补充维生素D(10 000IU/d, 4周)后,空腹血糖受损患者胰岛素敏感性明显改善。本文对血清25(OH)D水平与FBG、Fins、HbA1c、HOMA-IR、HOMA-β进行相关性分析,发现其并无明显相关性,这与Fondjo LA等[5]、Sheth JJ等[9]研究一致。
表2 血清25(OH)D与空腹血糖受损相关指标相关性
文献来源:曾雅琳,王晓华。补充维生素D对空腹血糖受损患者胰岛素抵抗的影响[J].医学理论与实践,2021,34(11):1870-1872.
综上所述,饮食+运动能明显改善胰岛素抵抗及降低血糖;小剂量短时间补充活性维生素D对改善胰岛素抵抗及胰岛β细胞功能和降低血糖无明显益处;血清25(OH)D水平与空腹血糖、空腹胰岛素、糖化血红蛋白、胰岛素抵抗和胰岛β细胞功能指数无明显相关性。
参考文献
[1] Wang L,Gao P,Zhang M,et al.Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013 [J].Jama,2017,317(24):2515.
[2]中华医学会糖尿病学分会,中国医师协会营养医师专业委员会中国糖尿病医学营养治疗指南(2013)J]糖尿病临床, 2016,10(7):289-307.
[3] Berridge MJ.Vitamin D deficiency and diabetes[J] Biochem J,2017 ,474(8):1321-1332.
[4] Liu E,Meigs JB,Pittas AG,et al.Predicted 25-hydroxyvitamin D score and incident type 2 diabetes in the framingham offspring Study[J].Am J Clin Nutr,20
10,91(6):1627-1633.
[5] Fondjo LA,Owiredu W,Sakyi SA,et al.Vitamin D status and its association with insulin resistance among type 2 diabetics:A case -control study in Ghana
[J]. PLoS One 2017,12(4):e175388.
[6] Bril F,Maximos M, Portillo-Sanchez P,et al.Relationship of vitamin D with insulin resistance and disease severity in non-alcoholic steatohepatitis[J]J Hep
atol,2015,62(2):405-411.
[7]Li X,Liu Y,Zheng Y,et al.The Effect of vitamin D supplementation on glyc emic control in type 2 diabetes patients:A systematic review and Meta-Analysis
[J].Nutrients, 2018, 10(3):375.
[8] Nazarian S,St Peter JV,Boston RC.et al.Vitamin D3 supplementation improves insulin sensitivity in subjects with impaired fasting glucose[J].TransI Res,2
011,158(5):276-281.
[9] Sheth JJ,SHAH A.et al.Does vitamin D play a significant role in type 2 diabetes?[J] BMC Endocr Disord,2015,15.5.
文献来源:曾雅琳,王晓华。补充维生素D对空腹血糖受损患者胰岛素抵抗的影响[J].医学理论与实践,2021,34(11):1870-1872.