摘 要: 为了明确藻类对重金属的耐受性和富集特征, 采用室内培养法, 研究铜绿微囊藻 (Microcystis aerugino-sa) 对不同质量浓度Zn2+和Cd2+的富集能力以及对其胁迫的生理响应。结果表明, 铜绿微囊藻对Zn2+、Cd2+均有一定的富集作用, 而且Zn2+的富集量明显高于Cd2+。当Zn2+质量浓度为0. 05 mg/L时, 铜绿微囊藻的比生长速率最快, 当Zn2+质量浓度超过0. 05 mg/L时, 铜绿微囊藻的生长受到抑制, 即Zn2+对铜绿微囊藻的生长具有低质量浓度促进, 高质量浓度抑制的作用。Cd2+对铜绿微囊藻的生长不具有低质量浓度促进作用, 质量浓度为0. 05 mg/L的Cd2+作用96 h后, 铜绿微囊藻的生长受到明显抑制, Cd2+质量浓度越高, 其对铜绿微囊藻生长的抑制作用越明显。Zn2+、Cd2+质量浓度分别为0. 20 mg/L和0. 15 mg/L时, 连续培养24 h后, 铜绿微囊藻的酯酶活性均显着升高, 当Zn2+、Cd2+质量浓度分别达到0. 20 mg/L和0. 25 mg/L时, 与对照相比, 藻细胞光系统II (PSII) 最大光能转化效率 (Fv/Fm) 显着降低。在Zn2+、Cd2+胁迫下, 铜绿微囊藻的超氧化物歧化酶 (SOD) 活性、过氧化氢酶 (CAT) 活性以及丙二醛 (MDA) 含量均发生变化。
关键词: 铜绿微囊藻; 锌; 镉; 生理响应; 富集能力;
Abstract: In order to study the tolerance and enrichment characteristics of algae to heavy metals, the enrichment ability and physiological response of Microcystis aeruginosa to different concentrations of Zn2+ and Cd2+ were investigated by using indoor culture methods. The results showed that Microcystis aeruginosa had a certain enrichment effect on Zn2+ and Cd2+ , and the enrichment of Zn2+ in Microcystis aeruginosa was obviously higher than that of Cd2+ . Microcystis aeruginosa grew fastest when the concentration of Zn2+ was 0. 05 mg/L, while the growth was inhibited when the concentration of Zn2+ exceeded 0. 05 mg/L. The low concentrations of Zn2+ could promote the growth of Microcystis aeruginosa, while high concentrations could inhibit its growth, which was called the hormesis effect. However, the growth of Microcystis aeruginosa was not promoted by low concentration of Cd2+ and was obviously inhibited after being treated with 0. 05 mg/L Cd2+ for 96 h. With the increase of Cd2+ concentration, the inhibitory effect of Cd2+ on the growth of Microcystis aeruginosa became more and more obvious. When the concentration of Zn2+ and Cd2+ reached 0. 20 mg/L and 0. 15 mg/L, the esterase activity of Microcystis aeruginosa increased significantly after continuous culture for 24 hours. When the concentration of Zn2+ and Cd2+ reached 0. 20 mg/L and 0. 25 mg/L, respectively, the Fv/Fmvalue was significantly decreased. The activities of superoxide dismutase ( SOD) and catalase ( CAT) and the content of malondialdehyde ( MDA) changed under the stresses of Zn2+ and Cd2+ .
Keyword: Microcystis aeruginosa; Zn; Cd; physiological response; enrichment ability;
随着工农业的快速发展, 大量重金属进入水环境, 这不仅污染水体, 还导致其在生物体内富集, 并通过食物链传递, 将其作用放大, 最终危害人类健康[1]。藻类是水域生态系统的初级生产者, 藻细胞壁及细胞内含有可与重金属离子结合的功能基团, 如氨基、硫代基等[2,3,4], 对水体中的重金属具有一定的耐受性[5]。在相同质量浓度条件下, 铜绿微囊藻对Cd2+的吸附效率大于Cu2+和Ni2+, 而且自然条件下生长的铜绿微囊藻的吸附能力比室内培养的铜绿微囊藻强[6,7]。不同藻类对Zn2+和Cd2+的耐受性存在较大差异, 点状念珠藻 (Nostoc punctiforme) 可以耐受1.43 mg/L的Zn2+, 聚球藻 (Synechococcus sp.IU625) 可耐受25.00 mg/L的Zn2+[8]。
藻类在吸附重金属离子的过程中也会遭受其毒害, 与藻类亲和性越强的重金属离子对藻类生长的抑制作用越强[9]。已有研究结果表明, 江苏省5大湖泊 (太湖、滆湖、洪泽湖、高宝邵伯胡和骆马湖) Cd2+的平均质量浓度为1.02μg/L, 其中太湖南泉湖区Zn2+和Cd2+全年平均质量浓度可达31.89μg/L和0.29μg/L, 最高质量浓度分别为77.00μg/L和2.20μg/L[10,11]。锌是藻类生长所必须的微量元素, 适量的Zn2+能维持藻类正常的生理代谢, 但过量的Zn2+会与类金属硫蛋白结合, 导致细胞膜受损, 光合作用下降[12,13]。Cd2+是常见的重金属污染物之一, 能破坏藻类叶绿体结构, 抑制叶绿素合成, 也能导致抗氧化酶失活、蛋白质变性以及细胞膜损伤等[14]。有研究结果表明, 0.05 mg/L的Cd2+可显着抑制铜绿微囊藻生长, 在Cd2+胁迫下, 藻细胞会发生膜脂过氧化和膜蛋白的聚合作用, 使膜系统变性, 高质量浓度Cd2+导致藻细胞表面及周围絮状物增多, 部分藻细胞甚至破碎溶解, 细胞趋于死亡, Cd2+对斜生栅藻 (Scenedesmus obliquus) 生长的影响表现为低质量浓度 (<0.10 mg/L) 促进, 高质量浓度抑制[15]。高质量浓度的Zn2+和Cd2+均会导致铜绿微囊藻细胞内叶绿素a、叶绿素b、类胡萝卜素、藻胆素等色素含量以及光系统II (PSII) 最大光能转化效率降低, 并抑制藻胆体向PSII反应中心进行能量传递[16,17]。
在一些经济发达地区, 水体正遭受重金属污染, 且常伴有大规模的藻类水华。在适宜风场作用下, 水柱中的蓝藻上浮至水面, 并进行水平漂移运动, 这使得较大区域的藻类大量聚集在某特定区域[18]。在水体表面的水平漂移过程中, 藻类也会携带其吸收、吸附的物质一起运动, 当聚积的藻类死亡分解后, 其体内富集的物质被释放, 又重新回到水环境中, 从而改变物质的空间分布[19,20]。铜绿微囊藻是形成藻类水华的主要物种, 对重金属具有较强的富集能力。因此, 本研究拟采用室内培养法, 开展不同锌质量浓度、镉质量浓度下铜绿微囊藻毒理学试验, 以期阐明铜绿微囊藻对重金属胁迫的生理响应机制和耐受能力, 以及藻细胞密度、酯酶活性、PSII最大光能转化效率 (Fv/Fm) 、超氧化物歧化酶 (SOD) 活性、过氧化氢酶 (CAT) 活性、丙二醛 (MDA) 含量在不同锌质量浓度、镉质量浓度下的变化。
1 材料与方法
1.1 试验藻种及培养
试验使用的铜绿微囊藻 (Microcystis aeruginosa) 购自中国科学院水生生物研究所淡水藻种库。培养试验前, 玻璃器皿均用10%的盐酸溶液浸泡3 d, 再用去离子水冲洗并烘干。铜绿微囊藻扩大培养前, 根据Rippka等[21]方法配制的BG11培养基及玻璃器皿均经120℃高压蒸汽灭菌锅 (YXQ-LS-50A, 博讯公司产品) 灭菌30 min。在无菌操作台 (ESCO AC2-4S, 艺思高公司产品) 中, 将适量藻液转接至含有500 ml BG11培养基的锥形瓶中, 并置于光照培养箱 (GZX-300BSH-III, 新苗公司产品) 中进行扩大培养, 光照度为 (35±5) μmol/ (m2·s) , 光暗比为1∶1, 温度控制在 (25±1) ℃, 在培养过程中定期摇动锥形瓶, 保持试验藻种健康生长。
1.2 试验处理
与扩大培养条件相同, 使用改良的BG11培养基 (无Zn2+) 对铜绿微囊藻进行3 d饥饿培养[22], 以减少BG11培养基中原有Zn2+的干扰。无菌条件下, 取290 ml改良的BG11培养基加入500 ml锥形瓶中, 然后分别加入5 ml不同质量浓度的Zn SO4·7H2O、Cd Cl2·2.5H2O (分析纯) 溶液, 再加入5 ml经过饥饿培养的铜绿微囊藻液, 使Zn2+、Cd2+质量浓度梯度均为0 mg/L、0.05 mg/L、0.10 mg/L、0.15 mg/L、0.20mg/L和0.25 mg/L。采用流式细胞仪检测铜绿微囊藻的初始状态, 以保证新接入藻的状态符合试验要求。根据经济合作与发展组织 (OECD) 标准, 利用藻类进行毒性试验时, 藻的初始密度多设定在1 ml约1.00×105个 (对数生长期) , 以此来比较不同物质的毒性大小[23]。本试验初始时刻藻的密度为1 ml 1.14×106个, 铜绿微囊藻处在对数生长期。Zn2+、Cd2+每个质量浓度均设3个重复, 连续培养144 h。在铜绿微囊藻培养的第0 h、24 h、48 h、72 h、96 h、120 h和144h测定藻密度、酯酶活性、PSII最大光能转化效率 (Fv/Fm) , 在铜绿微囊藻培养的第0 h、48 h、96 h和144 h测定超氧化物歧化酶活性、过氧化氢酶活性、丙二醛含量, 在铜绿微囊藻培养的第144 h测定藻细胞中Zn2+和Cd2+的富集量。
1.3 指标测定
1.3.1 藻密度和酯酶活性
无菌条件下, 铜绿微囊藻培养的第0 h、24 h、48 h、72 h、96 h、120 h和144h, 采集藻液2 ml, 使其通过孔径为45μm的尼龙筛网, 将藻液分成2份 (体积各约1 ml) , 分别测定酯酶活性和藻细胞密度。向1份藻滤液中加入二乙酸荧光素 (FDA, Sigma公司产品) , 使FDA浓度为25μmol/L, 25℃暗室温育8 min后, 使用流式细胞仪 (BD AccuriTMC6, 贝克顿-狄金森公司产品) 测定酯酶活性, 用流式细胞仪直接测定另一份藻滤液的藻细胞密度。流式细胞仪为双激光配置:第1激光的激发波长为488 nm, 异硫氰酸荧光检测通道 (FL1) (530 nm/30 nm) 收集FDA荧光, 甲藻素-叶绿素-蛋白质复合荧光检测通道 (FL3, 长通滤光片670 nm) 收集藻密度荧光, 第2激光激发波长为640 nm, 进样流速为1μl/s, 上样体积为10μl[24]。酯酶活性用荧光强度百分比表示, 即:相对荧光强度=测定荧光强度/初始荧光强度×100%。
1.3.2 总蛋白质含量、SOD活性、CAT活性以及MDA含量
无菌条件下, 于铜绿微囊藻培养的第0 h、48h、96 h和144 h, 采集适量藻液至15 ml离心管中, 在冷冻台式离心机 (5810R, 艾本德公司产品) 中离心 (4℃、10 000 r/min) 10 min, 收集藻细胞, 使藻细胞重悬于无菌预冷的0.05 mol/L磷酸盐缓冲液 (PBS, p H=7.8) 中, 冰浴下采用超声波细胞破碎仪 (X0-1000D, 先欧公司产品) 破碎藻细胞, 直至镜检无完整细胞, 离心 (4℃、10 000 r/min) 10 min, 取上清液, 上清液为待测粗酶液。提取藻细胞内的MDA时, 将离心收集的藻细胞重悬于10%的三氯乙酸 (TCA) 中, 超声破碎, 离心, 取上清液, 上清液为待测粗MDA提取液。
蛋白质含量采用考马斯亮蓝法测定[25]。SOD活性采用氮蓝四唑 (NBT) 光还原法测定, 以1 mg蛋白质在1 ml反应液中使NBT光还原反应抑制率达50%时所对应的SOD量为1个活力单位, SOD活性单位为U/mg。CAT活性采用紫外吸收法[26]测定, 以1 mg蛋白质1 s分解1μmol H2O2的量为1个活力单位, CAT活性单位为U/mg。MDA含量采用硫代巴比妥酸法 (TBA) [27]测定, 单位为nmol/mg。
1.3.3 光合荧光
采用浮游植物荧光仪 (PhytoPAM, Walz公司产品) 测定叶绿素荧光参数。取藻液2 ml, 暗适应3 min后进行测量, 直接在仪器上读取PSII最大光能转化效率 (Fv/Fm) 数值, 该数值可反映铜绿微囊藻潜在的最大光合速率。
1.3.4 藻细胞中锌和镉的富集量
铜绿微囊藻毒理试验培养第144 h, 采集藻液50 ml至离心管, 在离心机 (TDL-40B, 安亭公司产品) 中以4 000 r/min离心15min, 将铜绿微囊藻与改良的BG11培养基分离, 倾倒出培养基, 将沉淀的藻细胞重悬于无菌去离子水中, 10 min后小心吸取上部藻细胞悬液, 弃去离心管底部杂质, 再将吸取的藻液以4 000 r/min离心15 min, 收集藻细胞, 倾倒清洗液。将含有铜绿微囊藻的离心管置于冷冻干燥机 (FD-1A-50, 博医康公司产品) 中, 待藻样冻干至恒质量后称取0.05 g至聚四氟乙烯消解管中, 加5 ml硝酸, 过夜, 12 h后将消解管置于微波消解罐中, 开盖, 130℃消解2 h, 然后加高氯酸2 ml, 160℃消解1 h, 再升温至180℃消解赶酸, 直至溶液近干时停止加热, 冷却至室温后加5 ml 2%的稀盐酸, 直至粘在消解管壁的消解产物完全溶解, 用去离子水将消解管中的溶液和沉淀全部转移至50 ml容量瓶中, 定容, 摇匀, 放置过夜, 12 h后将容量瓶中的上层清液倒入15 ml离心管中, 采用电感耦合等离子体质谱仪 (ICP-MS, Agilent 7700X, 安捷伦公司产品) 分别测定藻细胞中锌和镉的富集量。
1.4 数据处理与统计
采用Microsoft Excel 2010处理数据, 用SPSS21.0对试验结果进行单因素方差分析 (ANOVA) , 并用最小显着性差异法 (LSD) 对组间差异进行多重比较, 采用GraphPad Prism 5软件作图。
2 结果与分析
2.1 铜绿微囊藻对锌、镉的富集作用
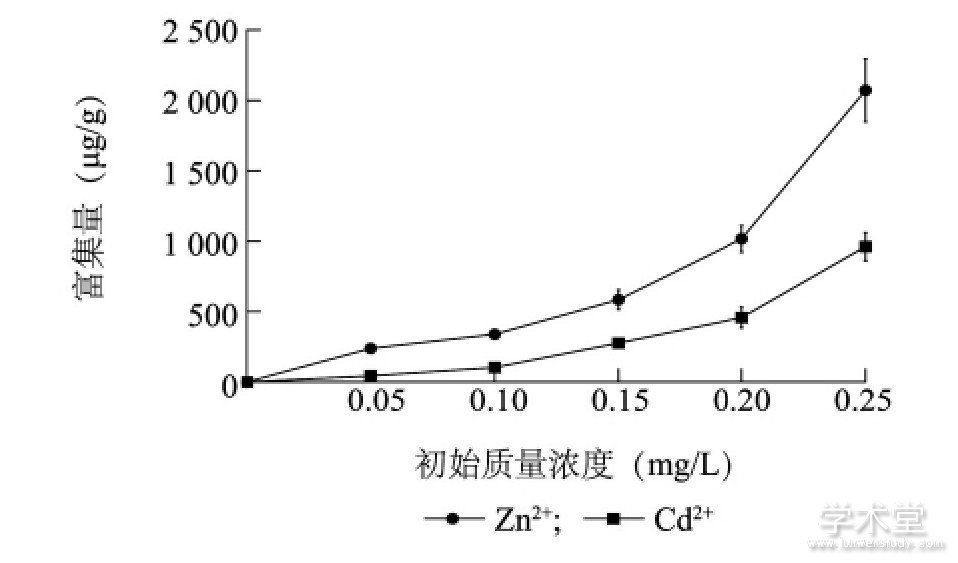
图1显示, 铜绿微囊藻对锌、镉的富集量均随Zn2+、Cd2+初始质量浓度的升高而增大。当Zn2+、Cd2+的初始质量浓度由0.05 mg/L增加至0.25mg/L时, 铜绿微囊藻对Zn2+、Cd2+的富集量分别为238.27~2 071.45μg/g和43.72~961.67μg/g, 5个处理下的平均含量分别为850.21μg/g和368.57μg/g。铜绿微囊藻对Zn2+、Cd2+均有一定的富集能力, 当初始质量浓度相同时, 单位质量藻体对Zn2+的富集量显着高于其对Cd2+的富集量 (P<0.05) 。
图1 铜绿微囊藻中Zn2+和Cd2+的富集量Fig.1 Enrichment of Zn2+and Cd2+in Microcystis aeruginosa
2.2 Zn2+和Cd2+对铜绿微囊藻细胞密度的影响
图2显示, 在培养期间, Zn2+质量浓度为0.05mg/L处理组的铜绿微囊藻细胞密度与同时期对照组相比, 显着增加了13.30%~22.90% (P<0.05) , 说明低质量浓度Zn2+能够促进铜绿微囊藻生长。Zn2+培养48 h, 0.20 mg/L和0.25 mg/L处理组的藻细胞密度显着低于同期对照组 (P<0.05) , 培养144h铜绿微囊藻细胞密度分别下降了35.01%和70.03%, 表明高质量浓度Zn2+对铜绿微囊藻细胞生长具有抑制作用。Cd2+培养72 h, 各质量浓度处理组铜绿微囊藻细胞密度均显着低于同期对照组 (P<0.05) , 培养144 h, 与对照组相比, 0.05 mg/L、0.10mg/L、0.15 mg/L、0.20 mg/L、0.25 mg/L的Cd2+处理组铜绿微囊藻细胞密度分别下降了10.10%、11.31%、10.63%、22.89%和42.69%。当Zn2+和Cd2+初始浓度相同且大于等于0.20 mg/L时, Zn2+对铜绿微囊藻的抑制作用比Cd2+更加显着, 这与重金属离子与藻类亲和性越强, 对藻类生长抑制作用越强的结论一致。有研究结果[20]表明, Cd2+暴露48 h内对普通小球藻 (Chlorella vulgaris) 的毒性高于Zn2+, 但长时间暴露后Cd2+的毒性小于Zn2+, 这与Zn2+和Cd2+抑制铜绿微囊藻的效应一致。
图2 Zn2+和Cd2+对铜绿微囊藻细胞生长的影响Fig.2 Effects of Zn2+and Cd2+on the growth of Microcystis aeruginosa
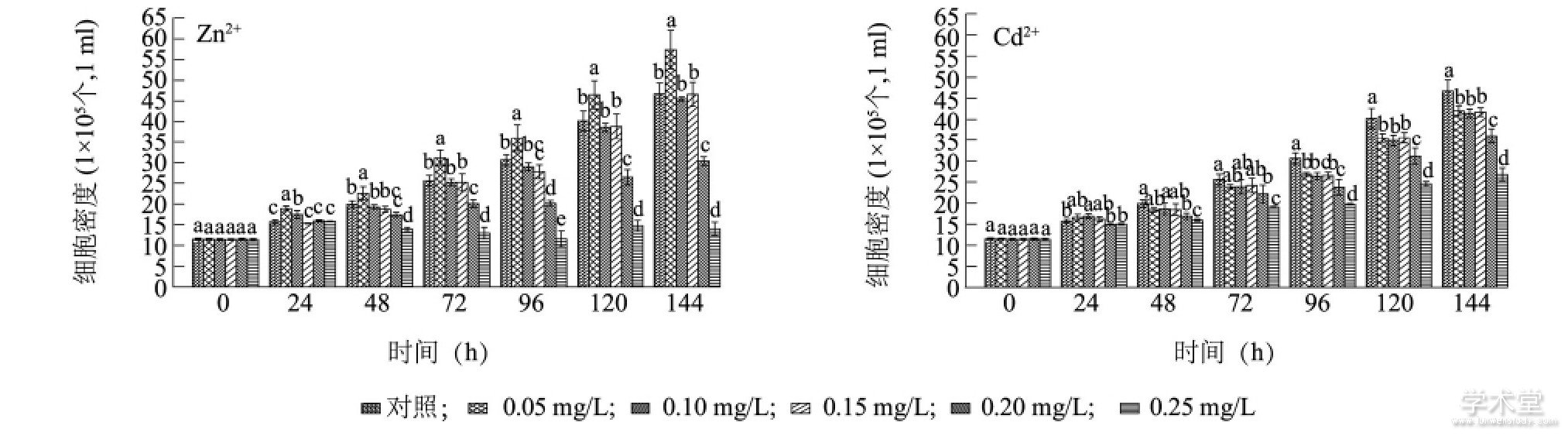
图中不同小写字母表示同时刻不同质量浓度重金属处理的藻细胞密度差异显着。
2.3 Zn2+和Cd2+对铜绿微囊藻酯酶活性的影响
酯酶活性可以反映细胞的新陈代谢特性, 是比较敏感可靠的毒理学指标。二乙酸荧光素 (FDA) 染料能够透过细胞膜被酯酶水解, 本身没有荧光, 但其水解产物可以发出荧光。因此, 可以通过检测相应的荧光信号来反映藻细胞的活性[28]。
图3显示, Zn2+培养24 h, 0.05 mg/L处理组的相对荧光强度与对照组无显着性差异 (P>0.05) , 但Zn2+质量浓度高于0.10 mg/L处理组的相对荧光强度均明显高于对照组。48 h后, 0.15 mg/L处理组的相对荧光强度不断下降, 96 h后与同期对照组无显着性差异 (P>0.05) , 但0.20 mg/L和0.25 mg/L处理组的相对荧光强度始终显着高于同期对照组 (P<0.05) 。培养48~144 h, 0.20 mg/L Zn2+和0.25mg/L Zn2+处理组的相对荧光强度分别是同期对照组的217.5%、246.5%、280.7%、209.2%、191.3%和481.8%、502.2%、483.5%、320.2%、267.6%。Cd2+培养24 h, 各质量浓度处理组藻细胞的相对荧光强度均显着高于同期对照组 (P<0.05) 。培养48 h后, 0.05 mg/L和0.10 mg/L处理组的相对荧光强度与同期对照组无显着性差异, 但0.15 mg/L、0.20mg/L和0.25 mg/L处理组的相对荧光强度始终显着高于同期对照组 (P<0.05) , 培养96 h时达到最大, 分别是对照组相对荧光强度的272.8%、537.2%和757.3%。重金属培养48 h, 质量浓度为0.25 mg/L的Zn2+和Cd2+处理组的相对荧光强度分别是培养24 h时相对荧光强度的206.1%和118.7%。
图3 Zn2+和Cd2+对铜绿微囊藻酯酶活性的影响Fig.3 Effects of Zn2+and Cd2+on the esterase activity of Microcystis aeruginosa
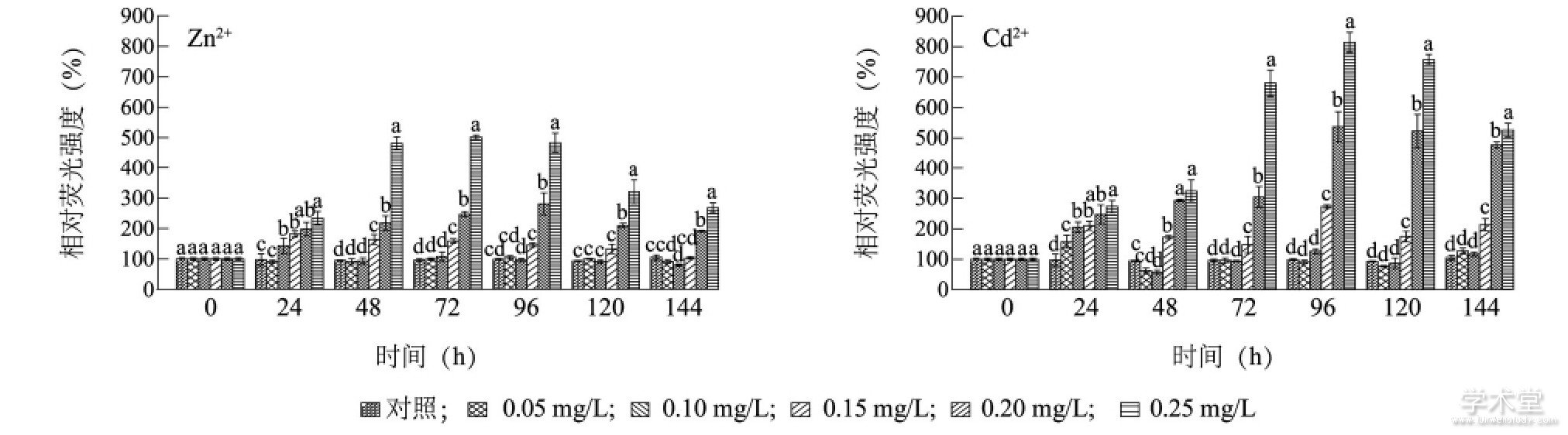
图中不同小写字母表示同时刻不同质量浓度重金属处理的藻细胞相对荧光强度差异显着。
2.4 Zn2+和Cd2+对铜绿微囊藻光合作用的影响
PSII最大光能转化效率又称PSII的光化学最大量子产量, 是暗适应下PSII的最大光化学效率, 反映了光合自养生物潜在的最大光合作用能力, 常作为植物光合性能是否受损的敏感性指标[29]。
图4显示, 在培养120 h内, Zn2+质量浓度低于0.25 mg/L处理组藻细胞Fv/Fm值持续快速增长, 120 h后逐渐稳定, 而且除了0.20 mg/L处理组的Fv/Fm值显着低于其他组外 (P<0.05) , 各组间差异不显着。Zn2+浓度为0.25 mg/L处理组的Fv/Fm值在培养24 h后显着低于同期对照组 (P<0.05) , 培养期间各采样时刻的Fv/Fm值之间无显着差异, 72h后, 0.25 mg/L处理组的Fv/Fm值均显着低于同期各质量浓度组的Fv/Fm值 (P<0.05) 。Cd2+对铜绿微囊藻Fv/Fm值的影响与Zn2+类似, 培养期间, 各质量浓度组的Fv/Fm值在120 h前持续上升, 120 h后保持稳定。48 h后, Cd2+质量浓度为0.25 mg/L处理组的Fv/Fm值显着低于同期各质量浓度组 (P<0.05) , 但高于同质量浓度Zn2+胁迫下藻细胞的Fv/Fm值。
图4 Zn2+和Cd2+对铜绿微囊藻光合作用的影响Fig.4 Effects of Zn2+and Cd2+on the photosynthesis of Microcystis aeruginosa
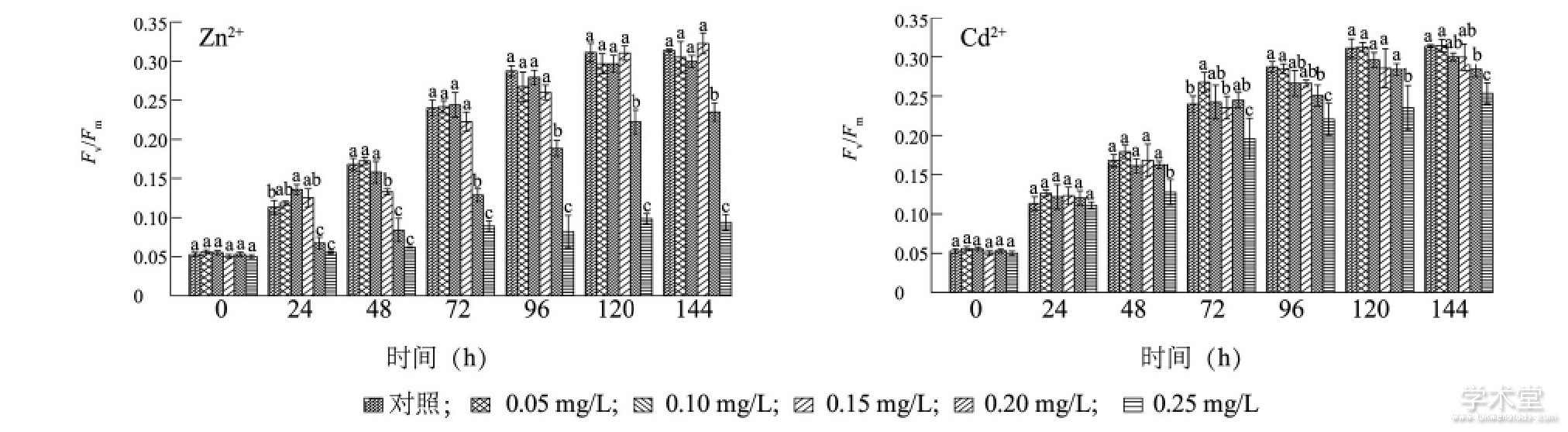
图中不同小写字母表示同时刻不同质量浓度重金属处理的藻细胞Fv/Fm值差异显着。
2.5 Zn2+和Cd2+对铜绿微囊藻抗氧化性的影响
图5显示, Zn2+暴露48 h, 各质量浓度处理下藻细胞内SOD活性与同期对照组相比无显着性差异 (P>0.05) 。0.10 mg/L和0.25 mg/L Zn2+处理组的CAT活性分别显着低于和高于同期对照组 (P<0.05) , 表明高质量浓度的Zn2+刺激了藻细胞内CAT活性的升高。培养96 h, 0.15 mg/L和0.20 mg/L Zn2+处理组的SOD活性显着高于同期对照组 (P<0.05) , 但0.25 mg/L Zn2+处理组的SOD活性显着低于同期对照组 (P<0.05) 。培养96 h, 0.05 mg/L和0.10 mg/L Zn2+处理组的CAT活性显着低于同期对照组 (P<0.05) , 0.15~0.25 mg/L处理组的CAT活性与对照组相比, 无显着性差异 (P>0.05) , 表明低质量浓度Zn2+在一定程度上抑制了藻细胞内CAT活性。培养144 h, 0.15~0.25 mg/L Zn2+处理组藻细胞内SOD活性显着高于同期对照组 (P<0.05) , 0.20 mg/L和0.25 mg/L处理组的CAT活性也显着高于同期对照组 (P<0.05) , 表明高质量浓度的Zn2+长时间暴露后刺激了藻细胞抗氧化酶活性的升高。
培养48 h, 0.10 mg/L Cd2+处理组藻细胞内SOD活性显着高于同期对照组 (P<0.05) , 而0.05~0.25 mg/L处理组的CAT活性也显着高于同期对照组 (P<0.05) 。Cd2+暴露96 h, 0.05 mg/L处理组的SOD活性显着低于同期对照组 (P<0.05) , 0.05~0.15 mg/L处理组的CAT活性也显着低于同期对照组 (P<0.05) , 但0.25 mg/L处理组的CAT活性显着高于同期对照组 (P<0.05) 。培养144 h, 各Cd2+处理组藻细胞内SOD活性均显着高于同期对照组 (P<0.05) , 且0.25 mg/L Cd2+处理组的SOD活性最高, 0.25 mg/L Cd2+处理组的CAT活性显着高于同期对照组 (P<0.05) , 表明高质量浓度Cd2+处理提高了细胞内SOD和CAT活性。与Zn2+的胁迫类似, 藻细胞内MDA的产生表现出一定的剂量效应, 即重金属质量浓度越高, MDA的含量越多, 但同时刻高质量浓度 (0.20~0.25 mg/L) Cd2+处理藻细胞产生的MDA含量低于同质量浓度Zn2+处理藻细胞产生的MDA含量。
图5 Zn2+和Cd2+对铜绿微囊藻SOD活性、CAT活性和MDA含量的影响Fig.5 Effects of Zn2+and Cd2+on SOD activity, CAT activity and MDA content of Microcystis aeruginosa
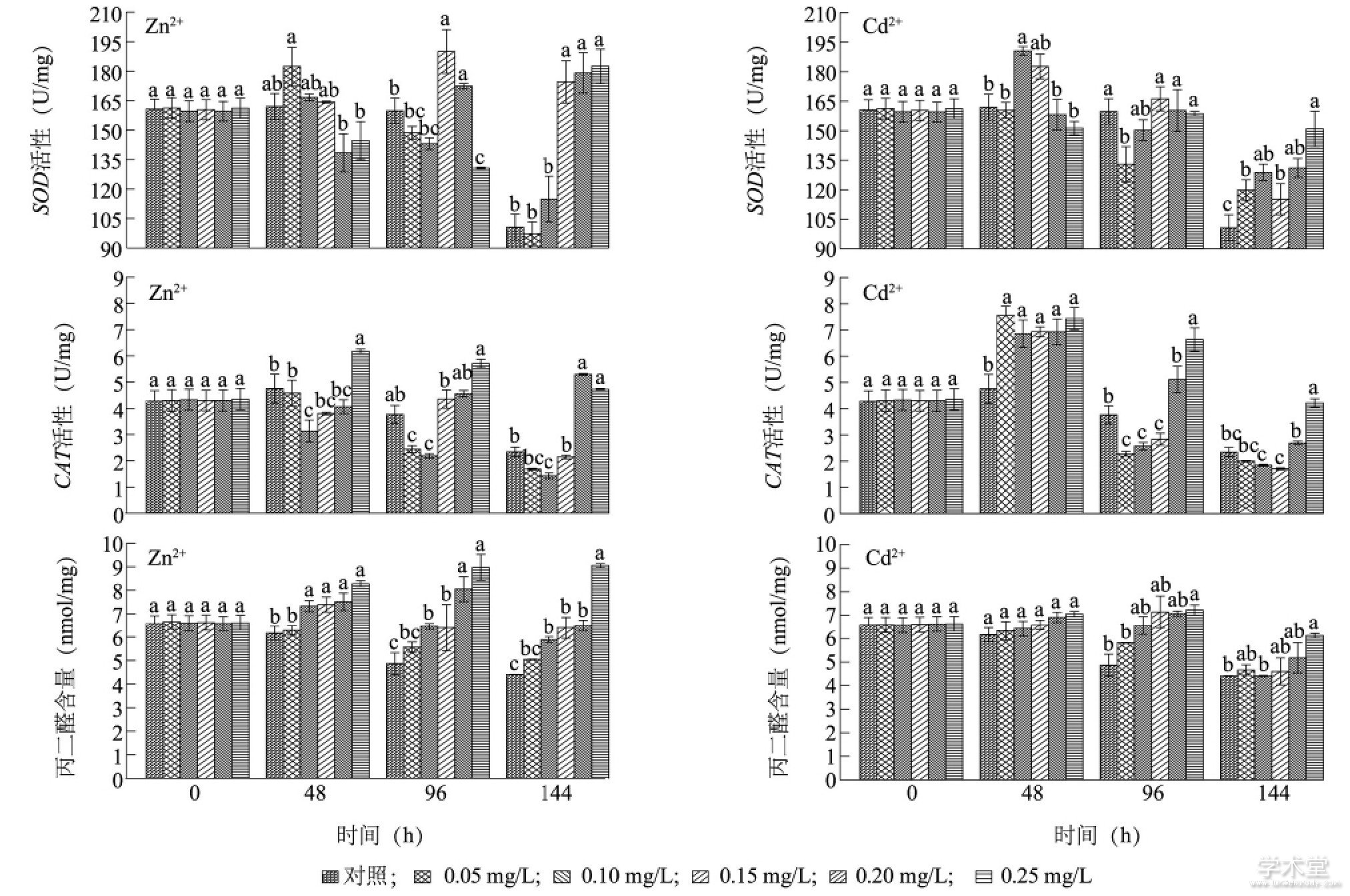
图中不同小写字母表示同时刻不同质量浓度重金属处理的藻细胞SOD活性、CAT活性和MDA含量的差异显着。
3 讨论
藻类细胞壁上存在大量的氨基、羟基、硫代基、酰胺基等官能团, 可与重金属离子结合, 与重金属亲和力强的官能团数量、水合离子半径以及电子层结构特性等均是导致藻类对不同重金属离子亲和性及富集能力存在差异的重要因素[30,31,32]。锌、镉均为过渡金属元素, 具有相同电荷数和配位键数, 但在本研究中铜绿微囊藻对锌、镉的富集量之比随二者初始质量浓度的增加而下降, 比值由4.5逐渐下降至2.2。Fisher[9]认为, Zn2+、Cd2+易与含硫、氮和氧官能团结合, Zn2+水合半径比Cd2+小, 使得铜绿微囊藻对Zn2+的亲和力强于Cd2+, 这可能是导致铜绿微囊藻对Zn2+有更高富集性的主要原因。刘璐等[15]的研究结果表明, 随着Cd2+初始质量浓度的升高, 铜绿微囊藻和斜生珊藻对Cd2+的富集量逐渐增多, 当Cd2+质量浓度为0.20 mg/L时, 铜绿微囊藻和斜生珊藻细胞内的Cd2+含量分别为546.00μg/g和769.00μg/g, 与本研究相同初始Cd2+质量浓度处理下的铜绿微囊藻Cd2+富集量 (457.52μg/g) 基本相当。当Zn2+、Cd2+质量浓度持续增大到0.25 mg/L时, 部分藻细胞膜遭受到损伤, 甚至死亡, 细胞比表面积增大, 表面暴露出更多可与重金属结合的活性官能团, 故仍能富集一定量的重金属, 但藻体富集重金属的机制由细胞吸收转变为吸附[33]。
碳酸酐酶催化水体中的无机碳转化为碳水化合物, 而锌是碳酸酐酶的重要组分, 适量的Zn2+能提高光合作用强度, 促进藻类生长, 但高浓度的Zn2+阻碍叶绿体还原型辅酶II形成, 导致核酸分解[34]。聚球藻 (Synechococcus sp.IU 625) 可耐受高达25 mg/L的Zn2+, 但50 mg/L的Zn2+使聚球藻细胞丧失活力, 藻细胞分裂不完全, 细胞表面出现褶皱, 对细胞产生直接的毒害作用[8]。Cd2+是铜绿微囊藻生长的非必需元素, 当Cd2+积累到一定量时会对铜绿微囊藻产生毒害作用, 这与刘璐等[15]的研究结果一致。当Cd2+质量浓度达到25 mg/L时, 对螺旋藻细胞生长的抑制率接近50%, 并且藻胆蛋白质的质量浓度显着下降[35]。随着Cd2+质量浓度的增加, 四尾栅藻 (Scenedesmus quadricanda) 细胞内叶绿素a、叶绿素b、类胡萝卜素等色素以及可溶性酚的含量下降, 超氧化物阴离子和过氧化氢的含量增加[17,36]。可见, 由于不同藻类的形态、细胞膜和细胞壁等生理结构存在差异, 所以其对同种重金属会表现出不同的耐受性。
连续培养24 h后, Zn2+、Cd2+质量浓度分别达到0.20 mg/L和0.15 mg/L时, 铜绿微囊藻的酯酶活性均显着高于同期对照组, 但藻细胞密度始终低于同期对照组, 表明Zn2+和Cd2+的胁迫作用抑制了铜绿微囊藻的生长, 但却促使藻细胞酯酶活性升高。酯酶活性的升高表明藻细胞新陈代谢活动增强, 一方面可能是重金属加速了细胞膜上磷脂代谢, 从而刺激了胞内的酯酶, 进而提供更多的能量来维持细胞生长, 是重金属压力下短时间内生物进行自我保护和修复的一种应急方式[37,38]。另一方面, 可能是高质量浓度重金属促使藻细胞膜的生理状态发生改变, 膜系统代谢功能紊乱, 抑制了铜绿微囊藻的生长繁殖[38], 从而使藻细胞密度降低。有研究指出, 当Zn2+、Cd2+浓度分别达到0.15μmol/L和0.12μmol/L时, 近头状伪蹄形藻 (Pseudokirchneriella subcapitata) 的酯酶活性均受到显着抑制, 当Zn2+、Cd2+浓度分别达到0.60μmol/L和0.50μmol/L时, 酯酶活性抑制率分别达到17%和28%, 表明藻细胞对锌、镉胁迫的耐受性较低[39]。用Cu2+处理铜绿微囊藻1 h后, 藻细胞酯酶活性略有升高, Cu2+质量浓度为13~101μg/L时, 胞内酯酶活性先升高后降低, 表明细胞内的酯酶受到了刺激[40]。Lage等[41]认为, 这种刺激可能是因为Cu2+的进入使细胞内离子重新调节, 进而引起细胞内p H上升导致的, 也有可能是Cu2+胁迫下, 生物短时间内进行自我保护的一种应急方式。
Zn2+和Cd2+胁迫下铜绿微囊藻的Fv/Fm值和藻细胞密度的变化趋势相似, 即高质量浓度Zn2+和Cd2+胁迫均能降低藻细胞密度和Fv/Fm值, Fv/Fm值的降低说明PSII活性受损严重, 电子传递过程受阻, 铜绿微囊藻的光合作用受到了抑制[42], 进而使铜绿微囊藻的生长受到抑制, 藻细胞密度降低。培养24 h后, 当Zn2+和Cd2+质量浓度分别达到0.20mg/L和0.25 mg/L时, 铜绿微囊藻的Fv/Fm值均显着低于同期对照组, 说明藻的光合作用受到了抑制, 重金属质量浓度越高, 铜绿微囊藻光合作用受抑制的程度越大, 且在相同高质量浓度 (0.25 mg/L) 的胁迫下, Zn2+对铜绿微囊藻生长的抑制作用比Cd2+明显。锌浓度高于23μmol/L时, 会抑制大多数蓝藻的光合作用和生长[43]。1 mmol/L的Zn2+和Cd2+可在短期 (0.5~2.0 h) 内迅速降低蛋白核小球藻S-39 (Chlorella pyrenoidosa Chick S-39) 的光合放氧速率和Fv/Fm值, 使PSII光合电子传递过程受到抑制[[44]]。Zn2+和Cd2+胁迫均能降低普通小球藻 (Chlorella vulgaris) 的生物量, 但暴露96 h后, PSII光化学最大量子产量增长了约10%, 这可能是低浓度重金属刺激效应的结果[[22]]。
在藻体正常的生理代谢过程中, 活性氧自由基的产生和清除处于动态平衡状态, 但当藻体受到不良环境胁迫时, 细胞内会产生大量的氧自由基, SOD、CAT等抗氧化酶组成了清除细胞内多余氧自由基的防护体系, 氧自由基可被抗氧化酶最终分解为H2O和O2, 从而阻止其对藻细胞的伤害。当抗氧化酶保护系统受到破坏时, 活性氧的积累会引起膜组分不饱和脂肪酸的过氧化, 导致MDA等膜脂质过氧化产物增多[45]。低质量浓度Zn2+和Cd2+可对铜绿微囊藻的生长产生抑制作用, 但藻细胞可通过SOD和CAT逐渐清除多余的氧自由基, 从而达到保护藻细胞的目的。当Zn2+和Cd2+质量浓度达到0.25 mg/L时, 随着培养时间的延长, CAT活性先升高后降低, 表明细胞前期受到抗性诱导作用, 但仍无法清除大量的氧自由基, 最终使酶结构遭到破坏, 发生膜脂过氧化和膜蛋白聚合作用, 使膜系统变性, MDA含量增加, 进而使藻细胞生长受到强烈抑制甚至死亡, 使藻细胞密度降低。Choudhary等[46]研究了不同质量浓度Zn2+ (0.05~0.20 mg/L) 对螺旋藻-S5 (Spirulina platensis-S5) 的毒性作用, 发现螺旋藻-S5细胞内的MDA含量、SOD活性以及脯氨酸含量均显着增加, 且脯氨酸的增长百分比由0.05 mg/L Zn2+处理的38.4%增加到0.20 mg/L Zn2+处理的93.3%, MDA含量的增加表明螺旋藻-S5在Zn2+胁迫下形成了活性氧自由基, 而SOD活性和脯氨酸含量升高则表明, 藻细胞受到抗性诱导作用后细胞内清除氧自由基的机制开始发挥作用。
参考文献:
[1]陈祯东, 陈日钊, 张紫英, 等.南宁市罗非鱼池塘表层沉积物铜、锌、氮、磷含量及其生态风险分析[J].南方农业学报, 2018, 49 (9) :1865-1872.
[2] PEREIRA S, MICHELETTI E, ZILLE A, et al. Using extracellu-lar polymeric substances (EPS) -producing cyanobacteria for thebioremediation of heavy metals:do cations compete for the EPSfunctional groups and also accumulate inside the cell?[J]. Micro-biology, 2011, 157 (2) :451-458.
[3]汪苹, 胡章立.衣藻细胞的重金属结合特性及其抗性机制[J].环境科学与技术, 2009, 32 (1) :84-89.
[4]陈镜伊, 唐婉莹, 尹洪斌, 等.蓝藻的生消过程对镉污染沉积物的生物有效性[J].江苏农业科学, 2018, 46 (20) :320-324.
[5] CHAKRABORTY N, BANERJEE A, PAL R. Biomonitoring of lead, cadmium and chromium in environmental water from Kolkata, Northand South 24-Parganas using algae as bioreagent[J]. Journal of AlgalBiomass Utilization, 2011, 2 (3) :27-41.
[6]吴文娟, 李建宏, 刘畅, 等.微囊藻水华的资源化利用:吸附重金属离子Cu2+、Cd2+和Ni2+的实验研究[J].湖泊科学, 2014, 26 (3) :417-422.
[7] SINGH S, PRADHAN S, RAI L C. Comparative assessment ofFe3+and Cu2+biosorption by field and laboratory-grown Microcystis[J]. Process Biochemistry, 1998, 33 (5) :495-504.
[8] NEWBY J R R, LEE L H, PEREZ J L, et al. Characterization ofzinc stress response in cyanobacterium Synechococcus sp. IU 625[J]. Aquatic Toxicology, 2017, 186:159-170.
[9] FISHER N S. On the reactivity of metals for marine phytoplankton[J]. Limnology and Oceanography, 1986, 31 (2) :443-449.
[10]王伟, 樊祥科, 黄春贵, 等.江苏省五大湖泊水体重金属的监测与比较分析[J].湖泊科学, 2016, 28 (3) :494-501.
[11] SU Y, LIU H, YANG J. Metals and metalloids in the water-bloom-forming cyanobacteria and ambient water from nanquan coast ofTaihu lake, China[J]. Bulletin of Environmental Contaminationand Toxicology, 2012, 89 (2) :439-443.
[12] SUMAN T Y, RAJASREE S R R, KIRUBAGARAN R. Evaluationof zinc oxide nanoparticles toxicity on marine algae Chlorella vul-garis through flow cytometric, cytotoxicity and oxidative stress a-nalysis[J]. Ecotoxicology and Environmental Safety, 2015, 113:23-30.
[13]杨洪, 黄志勇.锌胁迫对小球藻抗氧化酶和类金属硫蛋白的影响[J].生态学报, 2012, 32 (22) :7117-7123.
[14] FERNANDEZ-GARCA N, MARTM C, JIMENEZ A, et al.Sub-cellular distribution of glutathione in an Arabidopsis mutant (vtc1) deficient in ascorbate[J]. Journal of Plant Physiology, 2009, 166 (18) :2004-2012.
[15]刘璐, 闫浩, 夏文彤, 等.镉对铜绿微囊藻和斜生栅藻的毒性效应[J].中国环境科学, 2014, 34 (2) :478-484.
[16] XU K, LI Z K, QIU B S, et al. Different responses to high lightstress of toxic and non-toxic Microcystis aeruginosa acclimated un-der two light intensities and zinc concentrations[J]. Toxicological&Environmental Chemistry, 2013, 95 (7) :1145-1156.
[17]尹文珂, 程金凤, 肖婉露, 等.四尾栅藻对重金属镉胁迫的响应[J].农业环境科学学报, 2015, 34 (4) :633-638.
[18]孔繁翔, 马荣华, 高俊峰, 等.太湖蓝藻水华的预防、预测和预警的理论与实践[J].湖泊科学, 2009, 21 (3) :314-328.
[19]倪利晓, 马艳艳, 叶祥, 等.藻细胞活性及营养盐水平对铜绿微囊藻吸附镉的影响研究[J].环境科技, 2013, 26 (3) :1-4.
[20]江江, 李玉成, 王宁, 等.巢湖蓝藻聚集对重金属迁移释放的影响[J].湖泊科学, 2017, 29 (3) :558-566.
[21] RIPPKA R, DERUELLES J, WATERBURY J B, et al. Genericassignments, strain histories and properties of pure cultures of cya-nobacteria[J]. Microbiology, 1979, 111 (1) :1-61.
[22] OUYANG H L, KONG X Z, HE W, et al. Effects of five heavymetals at sub-lethal concentrations on the growth and photosynthe-sis of Chlorella vulgaris[J]. Chinese Science Bulletin, 2012, 57 (25) :3363-3370.
[23]欧阳慧灵, 孔祥臻, 何玘霜, 等. Cu2+对普通小球藻的光合毒性:初始藻密度的影响[J].生态毒理学报, 2011, 6 (5) :499-506.
[24]吴洁, 陈晓娣, 韩萍芳, 等.离子液体对微藻的急性毒性效应[J].安全与环境学报, 2016, 16 (1) :381-386.
[25] BRADFORD M M. A rapid and sensitive method for the quantita-tion of microgram quantities of protein utilizing the principle of pro-tein-dye binding[J]. Analytical Biochemistry, 1976, 72 (1/2) :248-254.
[26] BEAUCHAMP C, FRIDOVICH I. Superoxide dismutase:im-proved assays and an assay applicable to acrylamide gels[J]. Ana-lytical Biochemistry, 1971, 44 (1) :276-287.
[27] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by a-scorbate-specific peroxidase in spinach chloroplasts[J]. Plant andCell Physiology, 1981, 22 (5) :867-880.
[28]王执伟, 刘冬梅, 张文娟, 等.溴酸盐对普通小球藻的生长以及生理特性的影响[J].环境科学, 2016, 37 (6) :2158-2163.
[29] KUMAR K S, DAHMS H U, LEE J S, et al. Algal photosyntheticresponses to toxic metals and herbicides assessed by chlorophyll afluorescence[J]. Ecotoxicology and Environmental Safety, 2014, 104 (2) :51-71.
[30] VERHEYEN L, VERSIEREN L, SMOLDERS E. Natural dis-solved organic matter mobilizes Cd but does not affect the Cd up-take by the green algae Pseudokirchneriella subcapitata (Korschik-ov) in resin buffered solutions[J]. Aquatic Toxicology, 2014, 154:80-86.
[31] SHENG P X, TING Y P, CHEN J P, et al. Sorption of lead, cop-per, cadmium, zinc, and nickel by marine algal biomass:charac-terization of biosorptive capacity and investigation of mechanisms[J]. Journal of Colloid and Interface Science, 2004, 275 (1) :131-141.
[32] GONZLEZ-DVILA M. The role of phytoplankton cells on thecontrol of heavy metal concentration in seawater[J]. Marine Chem-istry, 1995, 48 (3/4) :215-236.
[33] DA COSTA A A, DE FRANCA F P. Cadmium uptake by Spirulinamaxima:toxicity and mechanism[J]. World Journal of Microbiolo-gy and Biotechnology, 1998, 14 (4) :579-581.
[34]张铁明, 杜桂森, 杨忠山, 等.锌对2种淡水浮游藻类增殖的影响[J].西北植物学报, 2006, 26 (8) :1722-1726.
[35]刘慧, 张宇宏, 张少斌, 等. Cd2+胁迫对螺旋藻生长、光谱特性及藻胆蛋白质量浓度的影响[J].生态环境学报, 2007, 16 (3) :767-770.
[36] KOVˇCIK J, KLEJDUS B, TORK F, et al. Comparison of meth-yl jasmonate and cadmium effect on selected physiological parame-ters in scenedesmus quadricauda (chlorophyta, chlorophyceae) [J]. Journal of Phycology, 2011, 47 (5) :1044-1049.
[37]冯政, 郑新梅, 刘红玲, 等.全氟辛酸对斜生栅藻细胞膜特性影响研究[J].生态毒理学报, 2010, 5 (4) :537-542.
[38] JIAO Y, OUYANG H L, JIANG Y J, et al. Effects of phosphorusstress on the photosynthetic and physiological characteristics ofChlorella vulgaris based on chlorophyll fluorescence and flow cyto-metric analysis[J]. Ecological Indicators, 2017, 78:131-141.
[39] MACHADO M D, SOARES E V. Use of a fluorescence-based ap-proach to assess short-term responses of the alga Pseudokirchneriel-la subcapitata to metal stress[J]. Journal of Applied Phycology, 2015, 27 (2) :805-813.
[40]于洋, 孔繁翔, 王美林, 等.应用流式细胞技术研究铜对藻细胞膜完整性及脂酶活性的影响[J].应用与环境生物学报, 2006, 12 (5) :706-709.
[41] LAGE O M, SANSONETTY F, O'CONNOR J E, et al. Flow cyto-metric analysis of chronic and acute toxicity of copper (II) on themarine dinoflagellate Amphidinium carterae[J]. Cytometry, 2001, 44 (3) :226-235.
[42] MURCHIE E H, LAWSON T. Chlorophyll fluorescence analysis:aguide to good practice and understanding some new applications[J]. Journal of Experimental Botany, 2013, 64 (13) :3983-3998.
[43] XU K, JUNEAU P. Different physiological and photosynthetic re-sponses of three cyanobacterial strains to light and zinc[J]. Aquat-ic Toxicology, 2016, 170:251-258.
[44] PLEKHANOV S E, CHEMERIS Y K. Early toxic effects of zinc, cobalt, and cadmium on photosynthetic activity of the green algaChlorella pyrenoidosa Chick S-39[J]. Biology Bulletin of the Rus-sian Academy of Sciences, 2003, 30 (5) :506-511.
[45] COLLN J, PINTO E, PEDERSEN M, et al. Induction of oxida-tive stress in the red macroalga Gracilaria tenuistipitata by pollutantmetals[J]. Archives of Environmental Contamination and Toxicolo-gy, 2003, 45 (3) :337-342.
[46] CHOUDHARY M, JETLEY U K, KHAN M A, et al. Effect ofheavy metal stress on proline, malondialdehyde, and superoxidedismutase activity in the cyanobacterium Spirulina platensis-S5[J].Ecotoxicology and Environmental Safety, 2007, 66 (2) :204-209.
生物物种名录是一个自然地理区域或行政单元的生物区系本底性的基础资料,及时更新生物物种名录对于生物多样性研究和保护与利用实践都是十分重要的。水生植物编目面临的第一个问题就是哪些植物是水生植物。...
新疆天山动植物保护地,位于达坂城区原天山牧场二队,东临乌拉泊牧场白杨沟村,西至祁家沟,南距吐乌大高速公路约1km、距离乌鲁木齐市区25km,北到柳木湖,占地75km2。这里沟壑纵横,丘陵起伏地形复杂,从南端海拔1165m,到北端的高海拔1778m,...
民族植物学是研究人与植物之间相互作用的一门学科[1].近年来,海南黎族的民族植物研究有了快速的发展,黎族地区特有的植物种类和优良的药用植物种质资源吸引了众多学者投身于黎族医药的挖掘和整理工作中,并取得了一定的成果[2-6],发掘出一批疗效好、可...
文章归纳了光温耦合对调控种子萌发、植物形态建成、开花时间和增强耐受性等方面的研究,经分析表明光温信号在分子水平上有较大的相互作用,并且证明光照和温度对植物生长发育过程中有着复杂的耦合作用。...
引言现代生态位理论的研究集中在生态位宽度、生态位重叠和生态位相似性比例等生态位测度的定量研究上,这些数据的积累是生态位理论指导林业、保护区实践生产活动的必要基础.植被演替过程中生态位宽度的变化能反映出不同植物种群对不同资源的适应能力差异,...
昆明长水国际机场区域内复杂的自然生态环境和优越的自然资源,为鸟类的栖息、取食和繁殖创造了良好的条件,孕育了丰富的鸟类多样性,鸟的种类和数量较多,对飞机飞行安全造成潜在威胁。...
1概述八大山自然保护区位于贵州省西部的盘县东北部,北与水城相邻、东与普安接壤,包括保基、淤泥、普古3个彝族苗族乡,由八大山和文阁大山组成,总面积26577hm2。地理位置为东径1044131~1045747,北纬255335~260612。区内出露地层为泥盆系、...
野牡丹属Melastoma Linn.为野牡丹科(Melastomaceae)植物,全世界约有100余种,分布于亚洲南部至大洋洲北部[1,2,3].我国有9种1变种,其中有1变种和2个特有种,多为草本,少为灌木或者小乔木[4],多分布于长江流域以南各省(区)。...
植物生长需要光作为能量进行光合作用,而且光还是重要的植物发育调控信号。在植物光信号传导调控过程中,存在大量重要的调控因子,这些调控因子与光敏色素等光受体蛋白等进行协同调控,共同参与光信号传导途径中一系列相关蛋白的翻译调控,从而影响植物暗形...
喀斯特地区地表地下双层岩溶地貌发育良好,生境异质性高是该地区最典型的一个特征,区域内地形、土壤、气候等环境因子存在较大的差异,直接影响植被演替过程和分布格局。...