
禽流感(Avian Influenza)是由A型流感病毒引起的一种禽类(家禽和野禽)的感染和/或疾病综合征,该病毒由8个基因片段构成,其中最短的一个基因为非结构基因(non-structural gene,NS)。病毒复制过程中,NS基因编码一个mRNA转录本,该转录本可被选择性的剪切并表达两个重要的功能蛋白,分别是26kDa的NS1蛋白和14kDa的NEP(nuclear exportprotein,NEP)蛋白(通常被称为NS2蛋白)。
NS1蛋白以二聚体形式存在,在病毒的复制过程中发挥着重要的作用,mRNA的合成、剪切、蛋白磷酸化甚至诱导细胞凋亡都与这个蛋白禽流感(Avian Influenza)是由A型流感病毒引起的一种禽类(家禽和野禽)的感染和/或疾病综合征,该病毒由8个基因片段构成,其中最短的一个基因为非结构基因(non-structural gene,NS)。病毒复制过程中,NS基因编码一个mRNA转录本,该转录本可被选择性的剪切并表达两个重要的功能蛋白,分别是26kDa的NS1蛋白和14kDa的NEP(nuclear export protein,NEP)蛋白(通常被称为NS2蛋白)。
NS1蛋白以二聚体形式存在,在病毒的复制过程中发挥着重要的作用,mRNA的合成、剪切、蛋白磷酸化甚至诱导细胞凋亡都与这个蛋白相关。同时,有研究表明该蛋白在非特异性免疫反应中会抑制Ⅰ型干扰素的合成。NS1蛋白含有两个核定位信号区,其中34~38位氨基酸残基的Asp-Arg-Leu-Arg-Arg信号区非常保守,在所有的甲型流感病毒中都相同。第二个信号区位于203~230位氨基酸残基处,大多数甲型流感病毒中都有这一序列。NS1蛋白是决定AIV对感染细胞的破坏力的关键因素,影响AIV的致病性和毒力;NS2具有调节非结构蛋白合成的作用,在病毒感染细胞过程发挥重要的作用。在细胞感染流感病毒的早期就可发现细胞核内有大量的NS1聚集,细胞浆内也有NS1聚集;而NS2合成较晚,主要存在于细胞浆,也可在细胞核内发现。
目前福建省分离的禽源流感毒株包括H5N1、H6N6、H9N2等亚型,本研究拟对福建省鸡源、鸭源、鹅源等不同源的流感毒株的NS基因进行遗传进化分析,进一步探讨福建省不同亚型之间和同一亚型内不同毒株的NS基因与国内代表株禽流感病毒NS基因的特性差异,为进一步了解福建省不同亚型禽流感病毒的NS基因遗传进化关系及毒力变异奠定基础,为深入了解流感病毒的致病机制与NS基因之间交互作用提供理论依据。
1、材料与方法
1.1材料
9~10日龄SPF鸡胚购自北京梅利亚实验动物有限公司。
2株鸡源禽流感病毒FZ-04、FZ-11株,5株鸭源禽流感病毒A/duck/Fujian/FQ2/2007(H9N2)、A/Duck/Fujian/FQ107/2007(H9N2)、A/duck/Fujian/MH/2003(H9N2)、A/Duck/Fujian/FZ01/08(H9N2)、A/Muscovyduck/Fujian/CL/1997(H9N2)毒株均由本禽病室于1997-2011年从福建地区分离保存,毒株分离与增殖见文献。大肠杆菌DH5α由本室保存。
1.2仪器和试剂
凝胶成像分析系统(BIO-RAD)、PCR仪(Eppendorf公司),Trizol购自In-vitrogen。胶回收试剂盒和质粒提取试剂盒均购自美国OmegaBio-Tek公司。大肠杆菌(Escherichiacoli)DH5α感受态细胞自制。
AMV反转录酶、ExTaqDNA聚合酶和pMD18-T载体均购自宝生物工程(大连)有限公司。
1.3引物设计
FZ-04株禽流感病毒NS基因特异引物参考文献。反转录引物序列为5′-AG-CAAAAGCAGG-3′。引物由宝生物工程(大连)有限公司合成。
1.4毒株NS基因扩增
毒株分离、增殖以及病毒RNA提取详见文献。用流感的反转录引物Uni-12,按照AMV反转录酶说明书进行反转录合成cDNA。
PCR扩增以cDNA为模板,反应体系为50μL:10×Buffer5μL,dNTPmixture(2.5nmol/L)4μL,Ex-TaqDNApolymerase0.5μL,引物(20μmol/L)各1μL,模板cDNA1μL,ddH2O37.5μL。反应条件:94℃预变性5min,按94℃30s,55℃35s,72℃2min,进行35个循环,最后72℃延伸10min。取5μL产物经1%琼脂糖凝胶电泳检测扩增结果。
1.5NS基因的遗传进化分析
将毒株NS基因的PCR产物经切胶回收试剂盒纯化后与pMD18-T载体连接,转化DH5α感受态细胞,PCR方法鉴定重组质粒,阳性质粒送大连宝生物公司测序。分别应用DNAstar5.0和MEGA4.0分析软件(ByClust-alWMethod)对NS基因序列与GenBank中登录的国内流感病毒典型代表株及福建省不同时期分离的H5N1、H9N2和H6N6亚型流感毒株进行核苷酸序列同源性比较和遗传进化分析。遗传进化分析所涉及的毒株见表1。
2、结果
2.1NS基因核苷酸测序结果及核苷酸同源性分析
FZ-04、FZ-11毒株NS基因扩增的长度均为887bp,GenBank基因登录号分别为KF550969、KF550968。由DNAstar软件分析可知,两个毒株NS1基因完整的阅读框为654bp(从27~680bp),编码217个氨基酸;NS2基因编码区则由27~56bp及529~864bp构成,共编码121个氨基酸,不存在氨基酸缺失或插入现象。
MegAlign软件分析可知,FZ-04株与福建株CK/FJ/G9/09(H9N2)同源性最高(99.0%),FZ-11株与广西省马源分离株EQ/GX/3/2011(H9N2)同源性最高(99.4%)。FZ-04,FZ-11毒株与福建H5N1毒株同源性分别为88.2%~89.3%,88.3%~89.2%;与福建H9N2毒株的同源性分别为92.7%~99.0%,93.2%~99.4%;与疫苗株CK/SD/6/96同源性分别为92.6%、93.2%,与国内H5N1代表株GS/GD/1/96同源性最低,分别为70.8%和70.6%,与福建省H6N6代表株同源性分别为89.6%和90.1%。
2.2NS基因遗传进化分析
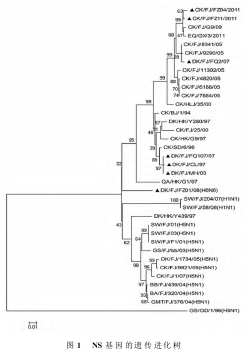
从遗传进化树分析可知(图1),福建省H5、H9亚型禽流感毒株分别聚合在两个不同的大分支上。Gen Bank中与本研究的两株病毒NS基因亲缘关系最近的毒株为CK/FJ/G9/09株,与国内高致病性禽流感代表株GS/GD/1/96遗传距离最远,CK/BJ/1/94毒株位于进化分析的根部,表明其余的H9N2亚型毒株都是该毒株与其他亚系毒株之间基因交流的产物。NS基因与广西省马源流感株EQ/GX/3/2011遗传距离很近,可能是禽源流感病毒基因重组后感染了马类造成的。
福建省禽流感NS1氨基酸序列比对结果(图2和表2),FZ-04和FZ-11毒株NS1蛋白羧基末端存在13个氨基酸缺失,与福建省分离的H9N2亚型毒株序列长度相同,而福建省H5N1毒株NS1蛋白80-84位有5个氨基酸缺失,总长度为225bp。本研究中福建省H9N2毒株的NS1蛋白羧基端不存在PL基序(ESEV/EPEV),而国内首次分离的高致病性GS/GD/1/96代表株和福建9株H5N1病毒SW/FJ/F1/01、GS/FJ/bb/03、CK/FJ/9821/05等存在ESEV基序,有一株病毒CK/FJ/1/07(H5N1)则呈现GSEV遗传多态性。
3、讨论
根据NS基因核苷酸同源性不同分为A和B两个等位基因群,群内同源性相对比较高。
A群包含禽源和哺乳动物源流感病毒,而B群主要包含禽源流感病毒和一种马流感,有研究报道A等位基因群中欧亚H9N2亚型流感毒株又被分为3个不同的亚群,分别为DK/HK/Y280/97株为代表的Y280亚群、DK/HK/Y439/97株为代表的Y439亚群及QA/HK/G1/97株为代表的G1亚群。本研究中所涉及的毒株GS/GD/1/96属于B等位基因群,其他的都属于A等位基因群。根据GenBank提交的序列信息可知,福建省分离的禽源流感毒株目前已见报道的有3种亚型,分别是H5N1、H9N2和H6N6亚型,福建H9N2亚型毒株都属于Y280亚群,而福建H5N1流感毒株则属于Y439亚群,H6N6亚型鸭源DK/FJ/FZ01/08株则是独立的一分支。
本研究中FZ-04和FZ-11的NS1基因编码217个氨基酸,其羧基末端存在13个氨基酸缺失,早期报道野外分离的禽流感病毒的某些毒株,NS1蛋白的羧基端有氨基酸缺失现象,而近几年研究发现多数低致病性毒株羧基端存在氨基酸缺失现象,本研究中福建省H9N2毒株都存在羧基末端氨基酸缺失现象,与其亚群代表株Y280不同,Y280株不存在基因缺失现象。令人感兴趣的是,本研究的21株病毒中仅福建H5N1高致病性流感毒株NS1蛋白80-84位有5个氨基酸缺失(图2),而H9N2亚型毒株和H6N6毒株在这几个位点不存在缺失现象,这是否可作为福建省区分高致病性和低致病性禽流感病毒的标志之一,有待于进一步研究。近年来关于NS1蛋白这几个位点氨基酸缺失的报道比较多,欧新华等报道从湖南长沙市禽类农贸市场分离到8株H5N1病毒的NS1蛋白80-84位点均存在氨基酸缺失。
福建省AIV的NS1氨基酸序列中有11个氨基酸位点高度保守(分别是第55、69、77、87、103、106、118、129、143、152和185位),已有研究证实第69位和第77位氨基酸位点突变会影响NS蛋白正确的亚细胞定位,从而减弱病毒的复制能力;同时,有研究报道称103、106位氨基酸位点分别从L(亮氨酸)突变成F(苯丙氨酸)和I(异亮氨酸)突变成M(蛋氨酸),将会增强禽源和人源流感毒株的毒力,其他7个氨基酸位点在不同亚型上(H5N1或H9N2)氨基酸不同,而同一亚型内(H5N1或H9N2)的毒株的7个氨基酸位点相同(见表2),这是否能够成为福建省高致病性H5N1株和低致病性H9N2株流感病毒的区分标志之一,有待于后续深入研究。本研究中仅QA/HK/G1/97株NS蛋白92位氨基酸为E(谷氨酸),其他毒株该位点氨基酸均为D(天冬氨酸),有研究分析该位点由D突变为E,会降低NS1蛋白磷酸化程度,并增强NS1对dsRNA的结合能力,从而提高病毒对干扰素的抗性。因此,研究禽流感病毒NS基因遗传进化关系,有助于进一步了解福建省流感病毒变异情况,为深入了解流感病毒的致病机制与NS基因间交互作用提供理论依据。
2013年3月31日,中国首次发现人感染H7N9禽流感病例,国家卫生计生委于2013年11月1日宣布将人感染H7N9禽流感纳入法定乙类传染病进行管理[1].H7N9禽流感高死亡率引起发公众关注,为提高对人感染H7N9禽流感的认识,本文就其研究进展予以综述。...
人流感病毒和禽流感病毒在感染宿主后, 不仅会引起呼吸系统疾病, 还有可能会导致中枢神经系统相关病症.中枢神经系统功能的紊乱, 会加剧患者的临床症状, 导致癫痫、昏迷、多器官功能受损甚至死亡....
每次流感大流行都对国际社会稳定和经济发展带来严重影响,因此很有必要研发流感防治药物。目前有两类(神经氨酸酶抑制剂和M2蛋白阻滞剂)应用于流感病毒的药物,但是随着其耐药性逐渐出现,开发有效的靶向不同的病毒蛋白抗流感药物是迫切需要的。流感病毒R...
在培养流感病毒当中, 对实验室严格消毒并加以防护, 当调配好病毒生长液, 在没注入双抗前提取一部分生长液, 之后再注入双抗到生长液中, 将提取的两种生长液标本进行阴性对照培养;以利于及时查找到污染菌与病菌来源, 并实施执行预防措施, 避免延误培养流感病毒...