摘 要: 目的:探索肥胖复合牙周炎建模的主要实验因素对结扎后体重丢失 (POWL) 的影响。方法:建立饮食诱导型肥胖与结扎诱导牙周炎的小鼠复合模型。四因素方差分析判别饲料期 (8、16、30周) 、饲料、结扎、结扎期 (5、10d) 对POWL的效应。结果:肥胖小鼠、牙周炎小鼠的POWL比各自对照组分别高70% (10.4%vs.6.1%, P<0.001) 、30% (9.6%vs.7.4%, P=0.002) 。随着肥胖程度增加, 肥胖小鼠的POWL不断加重 (P<0.001) , 与对照组的POWL差距拉大, 且丢失体重恢复更困难。在特定饲料期 (16周) , POWL随结扎期延长而加重。结论:建立肥胖复合牙周炎模型时, POWL在主要实验因素 (肥胖及其程度、牙周炎及其程度) 的组内分布均不对称, 应慎重评估并弱化其对实验目标的潜在干扰。
关键词: 混杂效应; 肥胖; 牙周炎; 体重丢失;
Abstract: Objective:To explore the effects of main experimental factors on post-operative weight loss (POWL) when establishing combined obesity and periodontitis models.Methods:Combined models of diet-induced obesity and ligation-induced periodontitis were established.Effects of feeding duration (8, 16and 30weeks) , diet, ligation and ligation duration (5and 10days) on POWL were evaluated by 4-way ANOVA.Results:DIO and periodontitits mice had 70% (10.4%vs.6.1%, P<0.001) and 30% (9.6%vs.7.4%, P=0.002) higher POWL, respectively, in contrast to their corresponding controls.As severity of obesity increased, POWL of the DIO mice was elevated and more difficult to recover and POWL difference between DIO mice and the controls was further enhanced.More POWL went with longer ligation duration after specific feeding duration (16weeks) .Conclusion:When establishing combined obesity and periodontitis models, imbalanced POWL occurs within groups of the main experimental factors (including obesity and periodontitis and their severity) , which should be critically assessed to minimize
Keyword: Confounding effect; Obesity; Periodontal diseases; Weight loss;
肥胖作为糖尿病等重大疾病的前期状态[1], 与牙周炎的相关性不断被临床研究证实[2,3]。大量动物研究相继开展, 试图阐释其生物学机制[4,5,6,7]。饮食诱导型肥胖 (diet-induced obesity, DIO) 是最能模拟人类食源性肥胖的模型。结扎诱导的牙周炎 (ligation-induced periodontitis, LIP) , 与细菌灌饲和内毒素注射等方法相比, 则更能模拟人类牙周炎的菌斑堆积属性, 且牙周组织破坏显着[6]。因此, DIO与LIP的复合模型常用来探索两种疾病的相互关系[6,8,9,10]。
然而, 两种模型的复合存在固有的冲突性。DIO的肥胖状态依赖于能量摄入大于支出, 并以体重增加作为其重要特征之一。LIP的建立常伴随反复重大刺激, 特别是麻醉副作用、结扎创伤和感染[6,11]。这些刺激势必造成动物的饮食障碍、能量收支改变和器官病理状态, 并反映为大幅的术后体重丢失 (post-operative weight loss, POWL) [6,11]。由于肥胖与正常体重个体对应激性刺激的耐受力差异, 前者的POWL更加严重, 从而对肥胖模型的增重特征造成威胁[6]。笔者前者研究表明, 与对照组相比, DIO小鼠的结扎相关麻醉副作用和POWL更严重[6,11]。POWL的不对称分布对DIO与LIP复合模型的代谢指标分析产生明显遮盖效应, 造成结果误判[6]。这些问题不仅造成DIO与LIP的复合困难, 而且给后续实验分析引入重大不确定因素。POWL在肥胖小鼠、牙周炎小鼠与各自对照组之间的不对称分布现象在前期研究已得到阐释[6]。然而, 尚不清楚POWL是否受肥胖程度、牙周炎诱导期的影响。本研究利用已建立的DIO与LIP复合模型, 探索建模的主要实验因素 (包括肥胖及其程度、牙周炎及其诱导期) 对POWL的影响。

1 材料与方法
1.1 DIO模型
将298只C57BL/6J小鼠 (雄性, 6周龄) 分为3个饲料诱导期, 即8周 (n=96) 、16周 (n=88) 、30周 (n=114) 。每个饲料期均再分为高脂 (High fat, HF) 和低脂 (Low fat, LF) 饲料组。HF组、LF组分别喂以60%kcal HF、10%kcal LF饲料 (D12492/D12450B, Research Diets公司, 美国) 诱导肥胖或作为正常体重对照[6]。每周测量体重。动物由广东省医学实验动物中心提供和饲养, 实验在该中心伦理委员会批准下进行。
1.2 LIP模型
饲料诱导至8、16、30周时, 进入牙周结扎期, 期间饲料不变。HF、LF组均再分为牙周炎 (P组) 和牙周健康对照 (C) 组, 分别进行牙周结扎和假性结扎, 每组再分为5d、10d结扎期。具体操作参照笔者前期研究[12], 具体分组及样本量见表1。结扎期满, 处死小鼠, 计算POWL= (结扎前体重-结扎后体重) /结扎前体重×100%。
1.3 统计学分析
以饲料期、饲料、结扎、结扎期4个因素作为主效应, 以POWL作为因变量, 进行四因素方差分析 (SPSS 17.0, IBM) 。单独效应行单因素方差分析, 多重比较采用LSD法。均数±标准差行统计描述, P<0.05为差异有统计学意义。
图1 饲料诱导8周 (1a) 、16周 (1b) 、30周 (1c) 时的小鼠体形及丝线结扎示意图 (1d, 箭头示丝线结扎的第二磨牙) Fig.1 Body figures of the mice and illustration of silk ligatures. (1a) 8weeks; (1b) 16weeks; (1c) 30weeks; (1d) arrows indicate the silk-ligated second molars.
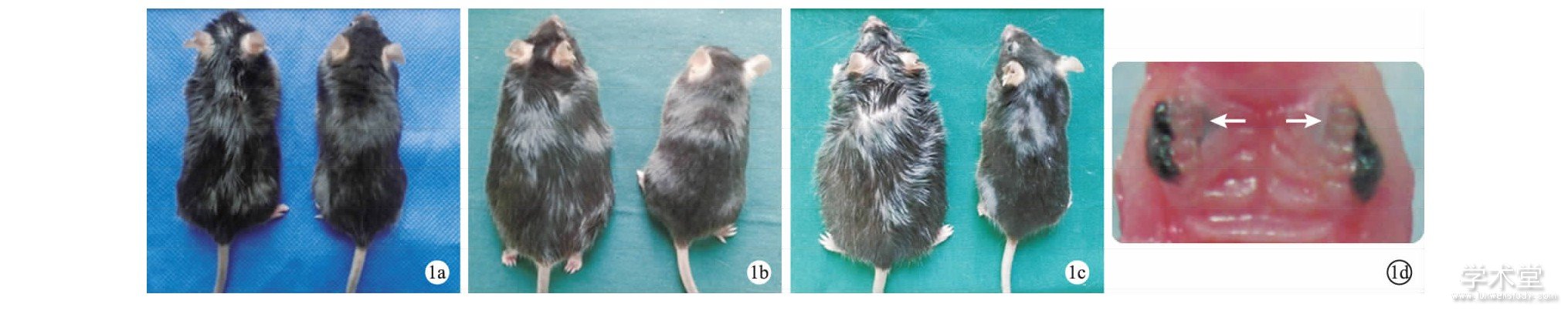
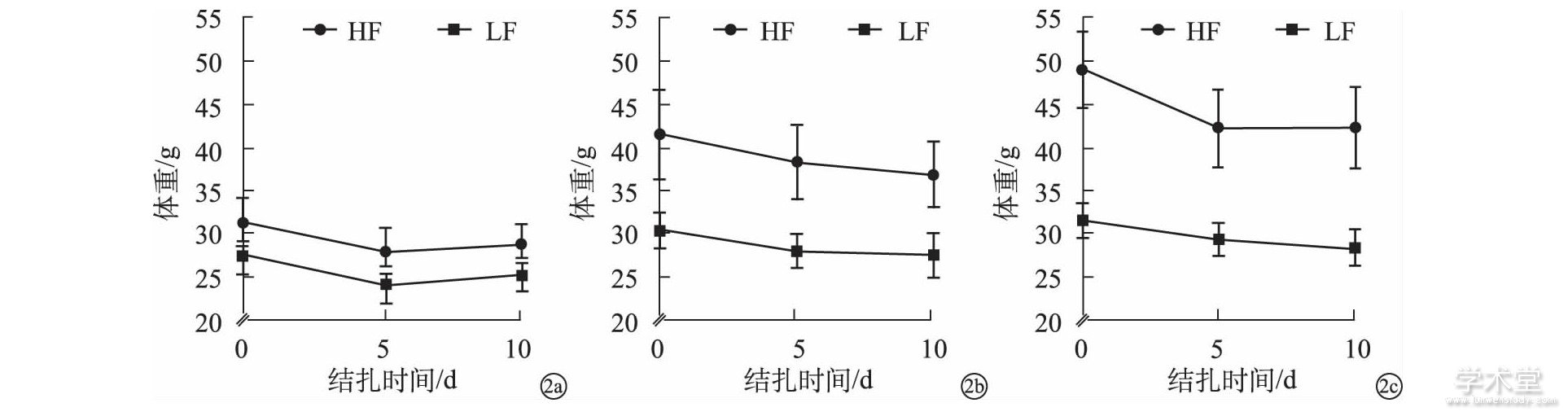
图2 8周 (2a) 、16周 (2b) 、30周 (2c) 饲料期时不同饲料组的体重随结扎期的变化Fig.2 Body weight change with ligation duration in different diet groups after 8- (2a) , 16- (2b) , and 30-week (2c) feeding durations.
2 结果
2.1 POWL的总体情况
图1显示肥胖模型各时期体形及丝线结扎诱导牙周炎示意图。结扎前, DIO小鼠 (HF组) 在8周、16周、30周时相对于正常体重对照 (LF组) 的体重优势分别为15%、36%、55%。结扎后, 所有组均发生POWL, 平均为 (8.5±8.8) %。结扎前至结扎后10d, 8周小鼠体重先降后升, 16周、30周小鼠体重不断下降或在10d时达平台期 (图2) 。综合来看, 16周、30周小鼠丢失的体重相对于8周恢复更困难。
2.2 饲料期、饲料、结扎、结扎期对POWL的影响
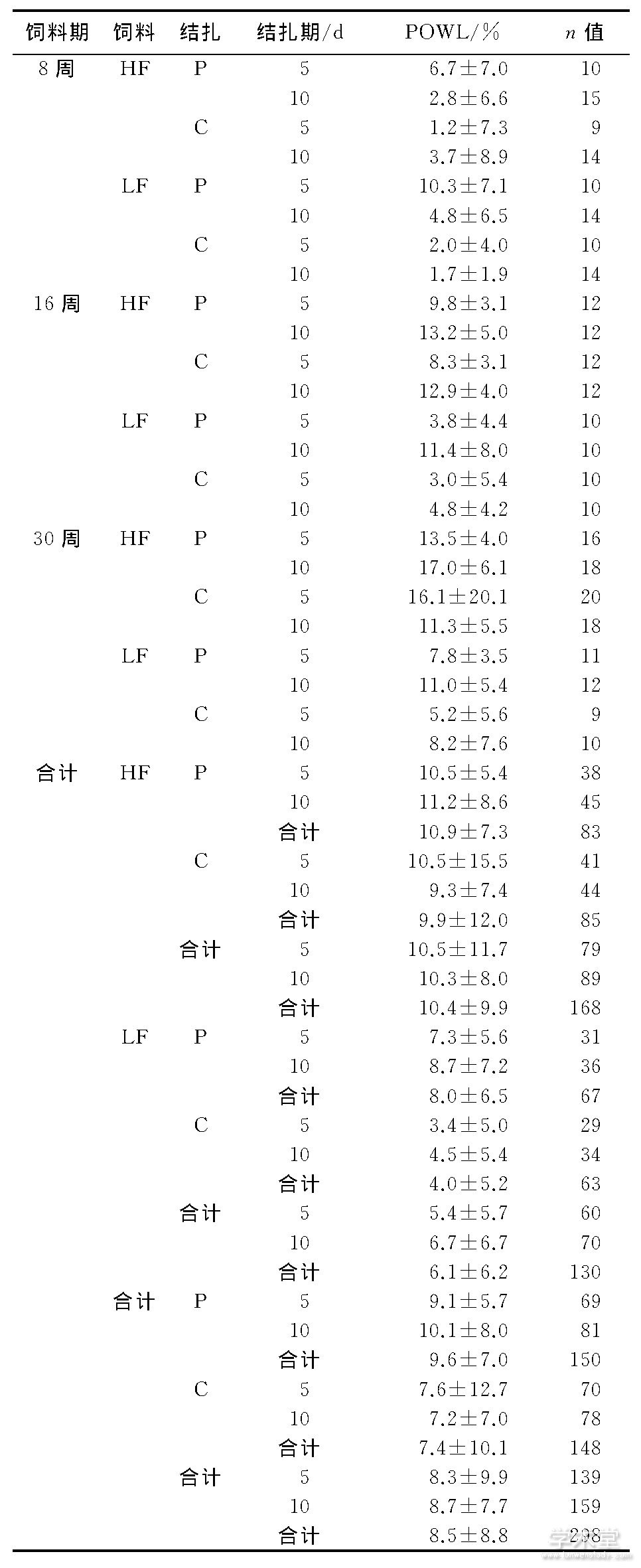
四因素方差分析显示, 饲料期、饲料、结扎、结扎期4个因素对POWL无显着交互效应 (F=1.529, P=0.219) , 主要看各自主效应。结合数值 (表1) , DIO小鼠、牙周炎小鼠的POWL比各自的对照组分别高70% (10.4vs.6.1 (%) , F=15.299, P<0.001) 、30% (9.6vs.7.4 (%) , F=9.641, P=0.002) 。从8~30周, POWL不断升高 (F=21.753, P<0.001) , 16周为8周的2倍以上 (8.6%vs.4.0%, P<0.001) , 30周比16周高42% (12.2%vs.8.6%, P<0.001) 。结扎期的主效应无统计学意义。
2.3 饲料期与结扎期对POWL的交互作用
鉴于饲料期与结扎期显着交互 (F=3.661, P=0.027) , 以饲料期为拆分变量, 分析结扎期对POWL的单独效应。结果显示, 8周时, 结扎10d与5d的POWL相当 (5.3%vs.3.2%, P=0.140) ;16周时, 结扎10d比5d高66% (10.8%vs.6.5%, P<0.001) ;30周时, 10d与5d的POWL相当 (12.4%vs.12.0%, P=0.803) , 见表1。总体上, 随着结扎期延长, POWL在特定饲料期呈加重变化。
2.4 饲料期与饲料对POWL的交互作用
鉴于饲料期与饲料显着交互 (F=6.722, P=0.001) , 以饲料期为拆分变量, 分析饲料对POWL的单独效应。结果显示, 8周时, DIO小鼠 (HF组) 与正常体重对照组 (LF组) 的POWL相当 (3.8%vs.4.4%, P=0.623) ;16周、30周时, DIO小鼠比对照组的POWL分别高90% (11.0%vs.5.8%, P<0.001) 、75% (14.5%vs.8.3%, P=0.001) , 见表1。总体上, 随着饲料期延长, DIO小鼠与对照组的POWL差距拉大。
以饲料为拆分变量, 分析饲料期对POWL的单独效应。结果显示, 对于DIO小鼠 (HF组) , 饲料期从8~16周 (3.8%vs.11.0%, P<0.001) , 以及从16~30周 (11.0%vs.14.5%, P=0.035) , POWL不断增高。对于正常体重对照 (LF组) , 饲料期从8~16周 (4.4%vs.5.8%, P=0.313) , 以及从16~30周 (5.8%vs.8.3%, P=0.066) , POWL均无显着变化, 但30周比8周的POWL显着增高 (P=0.004) , 见表1。总体上, 随着饲料期延长, DIO小鼠的POWL不断加重, 而正常体重对照则变化不明显。
表1 不同饲料期、饲料、结扎、结扎期的POWLTab.1 POWL at different levels of feeding duration, diet, ligation, and ligation duration.
3 讨论
POWL在牙周炎小鼠与其对照组间的不对称分布, 与笔者前期研究一致[6]。通过对比两组的POWL程度可知, 麻醉副作用是导致POWL的主因, 贡献率达77% (7.4/9.6) 。本研究中的水合氯醛麻醉副作用在笔者前期研究已详述, 包括心肺功能抑制、腹膜炎等[11]。牙周结扎虽对POWL的贡献较少 (23%) , 却是牙周炎小鼠与其对照组POWL不对称的主因, 可能机制包括牙周炎和结扎创伤相关的能量消耗、精神改变、咀嚼不适和进食减少等[6]。这种不对称源于此模型对结扎操作的依赖性, 难以消除, 但可尽量缩小或通过选择合理替代模型而避免。相比之下, 麻醉对POWL的贡献重大, 提示牙周炎组与对照组均进行麻醉的必要性。如果对照组如以往部分研究不行麻醉, 牙周炎组的POWL (参照本研究) 将低于对照组10%左右, 接近体重过轻的诊断标准[13]。在此情况下, 宿主免疫背景可因为麻醉副作用和体重过轻而改变[14,15]。不对称的宿主背景则可能夸大或掩盖牙周炎的局部效应和系统效应。另外, 本研究新发现, 随着结扎期延长, POWL在特定饲料期呈加重变化, 可能的原因是麻醉副作用从5~10d仍处于进展期[11]。在此情况下, 以往研究常规使用的频繁麻醉和结扎换线措施, 可能使动物面临持续而严重的麻醉副作用和POWL, 从而增加死亡风险或加重宿主免疫背景的不对称。
DIO小鼠与其对照组的POWL不对称, 亦与笔者前期研究一致[6]。而且, 相比于牙周炎小鼠与其对照组 (30%) , DIO小鼠与其对照组的POWL (70%) 不对称更严重。与前者不对称的主因归于牙周结扎不同, 后者不对称的主因可能归于麻醉不良反应。肥胖个体较正常体重者对麻醉副作用更易感, 在临床和动物研究中均有体现[16,17]。可能源于系统性免疫代谢紊乱和脂肪比例升高导致药物代谢变慢, 从而增强了麻醉效应包括其副作用[11]。本研究将DIO小鼠的饲料期设定为8周、16周、30周, 分别代表肥胖的不同程度, 即超重、显性肥胖、糖尿病性肥胖[18]。在此基础上, 本研究新发现, 随着肥胖程度增加, DIO小鼠的POWL不断加重, 尽管DIO小鼠相对于对照组的体重优势仍然明显。而且, 随着结扎期延长, 8周DIO小鼠的体重丢失部分回增, 而16周、30周DIO小鼠的体重未见恢复, 提示中重度肥胖动物对麻醉的耐受性较差。在不对称情况下, POWL不论轻重, 均可能对实验本身产生影响。POWL轻, 可能产生“类减肥效应”, 从而中和牙周炎的负面效应。POWL严重, 则威胁肥胖状态甚至动物生存, 比如30周DIO小鼠的POWL (14.5%) 已非常接近动物安乐死的标准 (体重丢失15%~30%) [19]。为此, 针对肥胖模型的特定背景, 应制定特殊的动物福利和实验方案[17]。
基于本研究发现和上述讨论, 笔者对肥胖与牙周炎的复合模型建立有如下建议。实验设计方面, 随机化处理和体重配对分组有利于均衡各变量的组间差异。对于单纯牙周炎模型, 假手术操作特别是麻醉应作为重要对照因素。若有多个结扎感染期, 应保证不同感染期的麻醉时点和次数一致。对于肥胖 (尤其中重度) 与牙周炎的复合模型, 应尽量避免重复麻醉和结扎。若因感染期较长 (如>4周) 而不得不重复操作, 可考虑更安全的吸入性麻醉 (如异氟烷) [17], 适当拉长麻醉周期 (如10d~2周检查1次丝线脱落与否) [18,20], 或选择非麻醉状态即可完成的细菌灌饲模型。必要时 (如研究牙周炎对肥胖模型的系统效应) , 可考虑同时设计麻醉对照及非麻醉对照, 从而更利于分离出混杂效应 (麻醉) 和主效应 (肥胖、牙周炎) 。实验过程中, 术前镇静、术中快而熟的微创操作 (如颊侧打结、单侧结扎以留对侧正常咀嚼功能) 、术后护理 (止痛、饮食调整如饲料软化和补充生理葡萄糖水、饲料性状对照) 等精细化措施, 有利于减少POWL并促进恢复[21]。数据收集阶段, 处死后尸检麻醉副作用的重要目标脏器, 利于排除异常值[11]。数据分析阶段, 以POWL作为协变量纳入协方差分析或多元回归分析, 有利于排除POWL的混杂效应[6]。
综上所述, 建立肥胖复合牙周炎模型时, POWL在主要实验因素 (肥胖及其程度、牙周炎及其程度) 的组内分布均不对称, 应慎重评估并弱化其对实验目标的潜在干扰。
参考文献:
[1] Afshin A, Forouzanfar MH, Reitsma MB, et al.Health effects of overweight and obesity in 195countries over 25years[J].N Engl J Med, 2017, 377 (1) :13-27.
[2] Khan S, Barrington G, Bettiol S, et al.Is overweight/obesity a risk factor for periodontitis in young adults and adolescents?a systematic review[J].Obes Rev, 2018, 19 (6) :852-883.
[3] Martinezherrera M, Silvestrerangil J, Silvestre FJ.Association between obesity and periodontal disease.A systematic review of epidemiological studies and controlled clinical trials[J].Med Oral Patol Oral Cir Bucal, 2017, 22 (6) :e708-e715.
[4] Wu C, Liu C, Luo K, et al.Changes in expression of the membrane receptors CD14, MHC-Ⅱ, SR-A, and TLR4in tissue-specific monocytes/macrophages following Porphyromonas gingivalis-LPS stimulation[J].Inflammation, 2018, 41 (2) :418-431.
[5] Muluke M, Gold T, Kiefhaber K, et al.Diet-induced obesity and its differential impact on periodontal bone loss[J].J Dent Res, 2016, 95 (2) :223-229.
[6] Yu T, Zhao L, Huang X, et al.Postoperative weight loss masks metabolic impacts of periodontitis in obese rodents[J].J Periodontol, 2017, 88 (6) :e97-e108.
[7] Huang X, Yu T, Ma C, et al.Macrophages play a key role in the obesity induced periodontal innate immune dysfunction via NLRP3pathway[J].J Periodontol, 2016, 87 (10) :1195-1205.
[8] Zuza EP, Garcia VG, Theodoro LH, et al.Influence of obesity on experimental periodontitis in rats:histopathological, histometric and immunohistochemical study[J].Clin Oral Investig, 2018, 22 (3) :1197-1208.
[9] Cavagni J, de Macedo IC, Gaio EJ, et al.Obesity and hyperlipidemia modulate alveolar bone loss in Wistar rats[J].J Periodontol, 2016, 87 (2) :e9-e17.
[10]余挺, 赵莉, 章锦才, 等.超重小鼠应对牙周感染的血清炎症因子反应[J].口腔医学研究, 2018, 34 (6) :644-647.
[11]余挺, 赵莉, 章锦才, 等.麻醉对肥胖复合牙周炎模型副作用的研究[J].口腔医学, 2018, 38 (10) :885-889.
[12] Yu T, Zhao L, Huang X, et al.Enhanced activity of the macrophage M1/M2phenotypes and phenotypic switch to M1in periodontal infection[J].J Periodontol, 2016, 87 (9) :1092-1102.
[13] Mahan L.Krause's Food, Nutrition&Diet Therapy[M].10th ed.Philadelphia:W.B.Saunders Co., 2000.
[14] Dobner J, Kaser S.Body mass index and the risk of infectionfrom underweight to obesity[J].Clin Microbiol Infect, 2018, 24 (1) :24-28.
[15] Ibrahim MK, Zambruni M, Melby CL, et al.Impact of childhood malnutrition on host defense and infection[J].Clin Microbiol Rev, 2017, 30 (4) :919-971.
[16]Kiekkas P, Stefanopoulos N, Bakalis N, et al.Perioperative adverse respiratory events in overweight/obese children:systematic review[J].J Perianesth Nurs, 2016, 31 (1) :11-22.
[17] Good DJ.Using obese mouse models in research:special considerations for IACUC members, animal care technicians, and researchers[J].Lab Anim (NY) , 2005, 34 (2) :30-37.
[18]余挺, 赵莉, 章锦才, 等.高脂软饲料增加肥胖复合牙周炎小鼠模型丝线松脱率的研究[J].口腔医学, 2018, 38 (6) :491-494.
[19] Franco NH, Correia-Neves M, Olsson IA.How“humane”is your endpoint?Refining the science-driven approach for termination of animal studies of chronic infection[J].PLoSPathog, 2012, 8 (1) :e1002399.
[20] Ni J, Chen L, Zhong S, et al.Influence of periodontitis and scaling and root planing on insulin resistance and hepatic CD36in obese rats[J].J Periodontol, 2018, 89 (4) :476-485.
[21] 余挺.肥胖状态下牙周感染对宿主免疫反应的影响及机制初探[D].南方医科大学, 2015.
慢性牙周炎(CP)是发生于牙周组织的炎症破坏性疾病,炎症始发于病原菌对牙周组织的破坏和宿主对病原菌的局部反应[1].近年来大量研究证实,牙周病与糖尿病之间存在密切的关系,牙周病是糖尿病血糖控制的危险因素之一[2],亦被称为糖尿病的第六并发症[3].但...
目前,牙周炎被定义为一种“复杂”或“多因素”的疾病,其病因涉及环境和遗传等多种因素的相互作用。复杂疾病往往具有多基因的特点,而各种基因的作用都是有限的,因此在这种疾病的疾病基因被认为是易感基因。...
引言牙周炎(pericoronitis)是牙科中常见的一种慢性感染性疾病,主要是由因素引起的牙周支持组织的慢性炎症,其发病群体主要是35岁以上的群体,该种疾病是一种破坏性疾病,如果牙龈炎未得到及时的治疗,炎症就会由牙龈向深层扩散,就会使得牙槽骨、牙...
牙周炎是导致成年人牙齿丧失的重要原因,尤其是慢性牙周炎。对于牙周炎,以往主要采用机械洁治与抗生素治疗,但疗效不甚理想。近年来,控释缓释药物发展快,派丽奥凭借其自身优势,也逐渐应用于牙科治疗中。我院对部分慢性牙周炎患者给予了超声洁治与派丽奥...
牙周炎是一类累及牙齿周围组织的感染性病变,其特点是炎症破坏牙周支持组织,导致牙周袋的形成及牙槽骨吸收最终造成失牙。研究发现许多免疫因子的基因多态性与侵袭性牙周炎、慢性牙周炎的易感性密切有关,如TNF、IL-6、IL-10等。CTLA-4作为免疫反...
1资料与方法1.1一般资料选择2013年1月-2014年12月前来我院进行治疗的160例重度慢性牙周炎患者作为研究对象,所有患者的具体情况如下:在研究组患者中,男性占28例,女性占12例,年龄在20岁到52岁之间,平均年龄为(40.57.5)岁;在对照...
前言纤粘连蛋白(fibronectin,FN)是一种重要的细胞外基质成分之一,为具有高度粘附活性的糖蛋白,广泛弥漫地表达于人和多种动物健康牙龈结缔组织基质内。随着个体年龄的增长,FN在结合上皮基底面下形成线形染色,此染色线随着结合上皮根向迁移的不断延伸而...
慢性牙周炎是由细菌侵袭引起的牙周组织慢性感染性病变,临床主要表现为牙周袋形成、牙槽骨吸收、牙齿松动等,是导致牙齿脱落的主要原因。...
重度牙周炎是一种常见且具有破坏性的口腔疾病,其病因分为局部因素和全身因素,前者包括菌斑、牙石、创伤性咬合等,后者包括内分泌失调,如性激素、肾上腺皮质激素、甲状腺素等的分泌量异常。该病的早期自觉症状不明显,随着炎症的进一步扩散,可出现...
慢性牙周炎是由局部因素造成的牙周支持组织慢性炎症,发生该病以后会对患者呼吸、消化、以及心血管等系统造成不良影响,加重慢性疾病进展,严重时还可危及患者生命安全,因此,需要引起患者关注与重视。...