【摘要】 目的 运用低强度脉冲场超声(LIPUS)刺激促进人脂肪间充质干细胞(hASCs)增殖,为临床干细胞体外高效增殖提供新方法。方法 通过LIPUS体外刺激hASCs细胞生长,采用Scepter 2.0手持细胞计数器进行细胞计数,运用荧光倒置显微镜观察细胞形态,运用流式细胞仪检测细胞表面标志物,并进行干细胞临床前质量检测。结果 刺激组50 mW/cm2和60 mW/cm2的LIPUS刺激强度均能促进细胞增殖,60 mW/cm2强度更显着,与对照组比较差异均具有统计学意义(P<0.05);细胞倍增时间比对照组缩短,差异具有统计学意义(P<0.05),刺激后刺激组细胞表面标志物无变化,增殖后干细胞质量检测符合标准要求。结论 LIPUS刺激可促进hASCs有效增殖,低强度脉冲场超声可作为干细胞体外扩增的新方法。
【关键词】 低强度脉冲场超声;人脂肪间充质干细胞;细胞增殖;质量检测。
低强度脉冲场超声(low-intensity pulsed ultra-sound,LIPUS)作为高频、小振幅和脉冲压力波传递机械刺激经皮进入生物组织的一种非侵入性的治疗方式[1]
,目前被广泛应用于临床治疗。有报道,LIPUS刺激既促进细胞DNA和蛋白质合成[2],又促进细胞对钙的吸收[3].LIPUS亦可提高细胞活性、细胞因子释放、基因表达、矿化率、Akt 信号、钾流动、血管生成、腺苷酸环化酶活性和TGF-β合成的影响等[4-6],对再生医学具有重要意义。
脂肪间充质干细胞(adipose tissue-derived mesen-chymal stem cells,ASCs)由于其来源广、且容易获得等特点,已经成为新一代组织工程种子细胞的来源之一。随着近年来干细胞研究领域的快速发展,人们对干细胞生物学的了解越来越深入。人脂肪间充质干细胞(hASCs)因具有低的免疫原性和强大的免疫调节特性,被用于同种异体的细胞移植等,治疗多种疾病和组织损伤[7-8],促进了干细胞移植和再生医学的发展。
LIPUS促进体内组织的修复,那么它应先促进体内细胞增殖然后再作用于损伤部位。然而,以往的研究者未见运用LIPUS对hASCs细胞增殖的研究,且促进细胞增殖机制未明确。本实验中,我们运用LIPUS刺激促进hASCs增殖,增殖后干细胞质量检验符合要求,实验结果为hASCs体外高效扩增和产业化提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞来源
人脂肪间充质干细胞购自广州赛业生物科技有限公司,按标准操作进行培养和传代[9-11].
1.1.2 仪器和试剂
人脂肪间充质干细胞完全培养基(广州赛业生物科技有限公司);0.25%胰酶消化液(Gibco 公司);流式抗体 CD105-PE、CD73-PE、CD34-PE、CD14-PE、CD45-PE、HLA-DR-PE和HLA-ABC-PE (广州BD 公司);支原体培养和鉴定药敏检测试剂盒(中山市天祥电子生物传感器有限公司);实时定量PCR法检试剂盒(中山达安基因检测有限公司);细菌内毒素检查试剂盒(厦门市鲎试剂实验厂有限公司);快速革兰氏染色试剂盒(珠海贝索生物技术有限公司);细胞培养皿、12孔板、50 mL离心管(Grenier公司);手持细胞计数仪(Merck Millipore 公司);细胞扩增仪 SonaCell(加拿大 Intelligent-Nano 公司);细胞培养箱(美国 Ther-mo);实时定量 PCR 仪(瑞士罗氏公司);荧光倒置显微镜(日本Olympus公司)。
1.2 方法
1.2.1 SonaCell
细胞扩增仪 LIPUS 刺激 Sona-Cell (Jie Chen 提供)超声设备是基于生物学和临床研究的基础上设置的:超声频率为1.5 MHz,脉冲重复频率为1 kHz,脉冲循环为20%.超声平均强度可调整在0~100 mW/cm2.仪器探头通过耦合剂紧贴培养皿底部进行辐照,本实验选用SonaCell细胞扩增仪40 mW/cm2、50 mW/cm2、60 mW/cm2强度的LIPUS刺激[12]为刺激组,0 mW/cm2强度为对照组。取hASCs第3代细胞2×104个的密度1 mL接种于12孔板相应的孔中,细胞培养24 h后换液,然后使用SonaCell设备的LIPUS刺激部件于细胞培养箱中刺激,5 min/d,连续刺激4d (即细胞培养24 h、48 h、72 h、96 h),第5天收集细胞并计数。细胞倍增时间(population doubling time,PDT)计算方法:t=T/3.32 (lgN2-lgN1),T为对数期的持续增长时间,N1和N2分别是对数增长开始和结束的细胞数量。做5组重复实验,对数据进行统计学分析。
1.2.2 细胞计数
运用 Scepter 2.0 手持细胞计数器进行细胞计数,用0.25%胰酶-EDTA消化液消化并收集细胞,用适量的D-PBS重悬细胞,取150 ?L细胞悬液至1.5 mL离心管中,使用Scepter 2.0计数器的60 ?L感应探头插入液面以下。根据制造商的说明书进行操作。使用Scepter Software Pro软件进行数据分析,准确测量细胞的直径和每毫升体积内细胞的数量。
1.2.3 细胞形态观察
由于细胞生长至第 5 天(120 h)后,显微镜下观察不好分辨细胞的数量。本实验选择第2次刺激后12 h (即细胞培养60 h),对数生长期初始阶段,将刺激组和对照组细胞置于倒置显微镜下观察,运用Image-Pro Plus软件拍照。
1.2.4 hASCs
免疫表型测定 通过流式细胞仪测定hASCs 刺激组与对照组表面标记物CD105、CD73、CD34、CD14、CD45、HLA-DR 和 HLA-ABC 的表达情况。取消化待测细胞,用D-PBS缓冲液清洗两次。调整细胞浓度为3×105个/mL,加入适量荧光标记的单克隆抗体,室温,避光孵育30 min.再清洗一次,重悬,上机检测,运用BD FACSDIVA软件进行分析。
1.2.5 取第 3 代刺激后 hASCs 进行无菌试验、支原体检测、内毒素检测、革兰氏染色、人源特定病毒检测
参照《干细胞制剂质量控制及临床前研究指导原则》和《中华人民共和国药典》2010 年版三部附录进行[13-14].
1.3 统计学方法
应用 SPSS20.0 统计学软件包进行数据分析,采用GraphPad Prism6 软件作图。首先对数据行正态性检验,若不符合正态分布,通过正态性转换后再下一步处理。组内比较采用One-wayANOVA 检验方法,组间比较采用独立样本 t 检验,以P<0.05为差异有统计学意义。
2 结 果
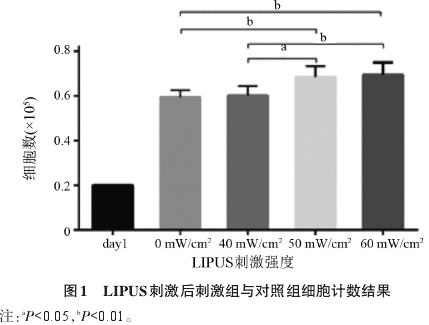
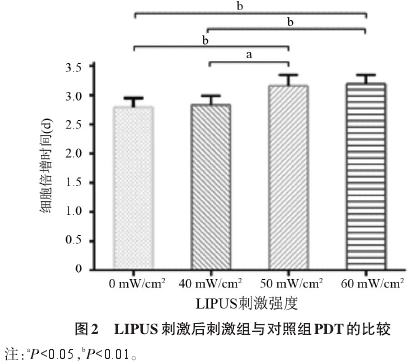
2.1 LIPUS 刺激促进 hASCs 体外增殖 LIPUS刺激 hASCs 体外增殖,第 5 天计数结果显示刺激组50 mW/cm2和60 mW/cm2强度都有促进细胞增殖的效果,其中60 mW/cm2刺激强度最明显,细胞倍增时间较对照组缩短,差异均有统计学意义(P<0.05),见图1和图2.
神经干细胞(NSCs)广泛存在于胚胎和成年哺乳动物中枢神经系统,是一类具有分裂潜能和自我更新能力的前体细胞,它可以通过对称分裂和不对称分裂方式进行自我更新并产生神经组织的各类细胞,包括神经元、星形胶质细胞和少突胶质细胞等[1].NSCs的发现为神经...
外排体(Exosome)是由多种细胞的胞内体衍生而来,通过出芽方式释放到细胞外的一种脂质双层膜性结构〔1〕,大小为40~100nm。由于其携带母细胞成分已逐渐被认为是细胞间进行信息交流,从而产生相互作用的新方式。树突状细胞(DC)作为一种体内分布广泛、最强的抗原提...
0引言吸烟与很多疾病的发生密切相关,烟草中的尼古丁类有害成分可致皮肤松弛。吸烟引起的皮肤松弛表现为毛孔突显、面部轮廓变模糊、皮肤松弛下垂等。尼古丁是烟草植物合成的杂环类水溶性生物碱,俗称烟碱,易透过生物膜和血脑屏障而使人成瘾。人体通过口...
糖尿病视网膜病变(diabeticretinopathy,DR)是糖尿病的最主要并发症之一,是严重致盲性眼病;视网膜Mller细胞是DR的主要参与细胞.而ApoAI是高密度脂蛋白(HDL)的主要载脂蛋白,其在胆固醇逆向转运、抑制低密度脂蛋白(LDL)的氧化修饰、前列环素的稳定...
肠神经嵴干细胞(entericneuralcreststemcells,ENCSCs)来源于迷走神经嵴(vagalcrest,VC)和骶神经嵴(sacralcrest,SC).VC来源的ENCSCs定植于整个消化道,构成肠神经系统的绝大部分肠神经节.该过程发生障碍,将造成肠道不同部位缺乏神经节细胞,局部肠管痉...
力生长因子是由胰岛素样生长因子基因编码的, 在组织或者细胞处于应激和损伤修复时, 通过对胰岛素样生长因子基因的mRNA进行剪接编码而翻译产生的选择性剪接变异体蛋白。...
骨骼肌是由高度分化的多核肌纤维构成的特殊组织类型,能够收缩产生力量和运动。成体骨骼肌细胞永久失去有丝分裂能力,因此临床常见的多种骨骼肌原发及继发性损伤多为不可逆性病变。特别是失神经支配后,肌肉会逐渐发生变性、萎缩、纤维化、失去收缩功能。即...
骨髓间充质干细胞具有自我更新、增殖潜能和分化成多种细胞类型的能力, 包括成骨细胞、脂肪细胞、软骨细胞、神经元等。骨髓间充质干细胞向脂肪细胞和成骨细胞的分化是竞争性调节的[4,5], 在骨微环境平衡中起着关键的作用。...