
肠神经嵴干细胞(enteric neural crest stem cells,ENCSCs)来源于迷走神经嵴(vagal crest,VC)和骶神经嵴(sacral crest,SC).VC 来源的 ENCSCs 定植于整个消化道,构成肠神经系统的绝大部分肠神经节.该过程发生障碍,将造成肠道不同部位缺乏神经节细胞,局部肠管痉挛和狭窄,近端肠管代偿扩大,从而导致先天性巨结肠的发生[1].先天性巨结肠的发病率高达1 /5 000 ~ 1 /2 000,是严重影响儿童健康的先天性疾病.神经嵴干细胞迁徙的启动需骨形态发生蛋白(bone morphogenetic proteins,BMPs)的参与[2].研究发现,胶质细胞源性神经营养因子 (glial cell line-derived neurotrophic factor,GDNF) 与受体 RET 结合可激活存活的信号通路,而 GDNF 缺失会诱导细胞凋亡[3].目前骨形态发生蛋白 2 (bone morphogeneticprotein 2,BMP2) 、GDNF 在 ENCSCs 增殖及迁移中的作用尚无定论.本研究采用机械分离法和酶消化法从胎鼠肠道组织获取 ENCSCs,使用免疫荧光技术对其干细胞特性和多向分化能力进行鉴定,探讨 BMP2 及GDNF 对体外培养 ENCSCs 增殖、迁移的影响,阐明BMP 信号通路在先天性巨结肠发生、发展过程中可能参与的分子机制,旨在为先天性巨结肠的病因诊断及治疗提供实验室依据.
1 材料与方法
1. 1 试验动物
孕13. 5 d 清洁级 SD 大鼠共20 只(体质量220 ~250 g),由重庆医科大学实验动物中心[许可证号:SCXK(渝) 2007-0001]提供.
1. 2 仪器与试剂
细胞培养主要仪器:ESPEC 恒温 CO2培养箱和 Olympus 倒置显微镜.DMEM/F12 完全培养基(Sigma 公司)组成:B27 添加剂、N2 添加剂、重组人碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF,Abcam 公司),青霉素和链霉素(华北制药).
促分化培养基组成:DMEM/F12 完全培养基添加 10% (体积比)胎牛血清.其他:胰蛋白酶、Ⅳ型胶原酶、左旋多聚赖氨酸(Sigma 公司) .一抗:兔抗鼠 NGFRp75、兔抗 Nestin 多克隆抗体、兔抗 GFAP、兔抗 SMAα、兔抗 TUJ1(Abcam 公司),FITC 标记抗鼠 CD49d、PE 标记抗鼠 P75(Biolegend 公司),细胞因子BMP2、GDNF( PeproTech 公司) .
1. 3 方法
1. 3. 1 细胞分离培养 取孕 13. 5 d SD 大鼠腹腔注射 10%水合氯醛 15 mL/kg,麻醉显效后常规消毒剖腹取胎鼠.解剖显微镜下取出胎鼠肠道组织,小心去掉肠管浆膜层及周围结缔组织,然后将剩余部分尽可能剪碎.0. 25%胰酶与 1. 0 mg/mL 胶原酶分别在37 ℃恒温摇床中消化10 min 和20 min,400 目筛网过滤,1 000 r/min 离心 5 min.取沉淀,DMEM/F12 重悬,制成单细胞悬液.1 000 r/min 离心 5 min,弃去上清.沉淀中加入ENCSCs 培养基重悬,吹打均匀,细胞计数并调整细胞密度(1 ~2) × 106/ mL 接种到纤维素(2μg/cm2)预包被的一次性培养瓶中,37 ℃,5% CO2孵箱培养.每隔 2 d 半量换液 1 次.细胞培养第 1 天开始,每天定时于光学显微镜下观察所培养细胞形态变化并拍照.
1. 3. 2 ENCSCs 鉴定 采用免疫荧光法对传代培养的干细胞进行 P75、Nestin、TUJ1、GFAP、α-SMA 标记染色,对所获得细胞的干性及多向分化能力进行鉴定.
1. 4 BMP2、GDNF 对原代培养 ENCSCs 的调控作用
1. 4. 1 BMP2 对 ENCSCs 增殖能力的影响 获得的 ENCSCs分散后调整细胞数为(1 ~ 2) × 106/ mL,分别接种于含不同浓度细胞因子 BMP2(10 ~ 120 ng/mL)培养基中,37 ℃,5% CO2孵箱中培养,每隔 1 d 半量换液 1 次,培养 1 周后,计数不同处理组细胞成球率[4],观察不同浓度 BMP2 对 ENCSCs 增殖能力的影响.
成球率 = (细胞球数/接种细胞数) ×100%1. 4. 2 GDNF 与 BMP2 对 ENCSCs 增殖能力的影响 获得的 ENCSCs 分散后调整细胞数为(1 ~2) ×106/ mL,根据是否加入细胞因子 BMP2 和/或 GDNF 分组:对照组(ENCSCs 单独培养组)、ENCSCs + GDNF 100 ng/mL 组、ENCSCs + BMP2 50 ng/mL组、ENCSCs +BMP2 50 ng/mL + GDNF 100 ng/mL 组.不同处理组细胞于 37 ℃,5% CO2孵箱中培养,每隔 1 d 半量换液 1 次,于培养第 2、4、6 天分别收集细胞,计数不同处理组干细胞成球率,观察不同处理组 ENCSCs 增殖能力的影响,每组重复 3 次.
1. 4. 3 GDNF 与 BMP2 对 ENCSCs 迁移能力的影响 根据Hotta 等[5]研究 ENCSCs 迁移的方法并进行改良.取交媾后13. 5 d 胎鼠中肠肠片 200 ~ 300 μm,包埋于含预先配置好的三维立体培养基的 24 孔板中(每孔含鼠尾胶 10 mg,0. 2%冰醋酸2. 5 mL,0. 8 mol/L 碳酸氢钠 100μL,200 mmol/L 氢氧化钠70 μL,DMEM/F12 7.3 mL).根据是否加入细胞因子 BMP2 或/和 GDNF 分组:对照组(肠片单独培养)、肠片 + GDNF 100 ng/mL组、肠片 + BMP2 50 ng/mL 组、肠片 + BMP2 50 ng/mL + GDNF100 ng / mL 组,不同处理组于 37 ℃ ,5% CO2孵箱内培养 72 h后,计数迁移的细胞数,研究 ENCSCs 的迁移能力.
1. 5 统计学分析
数据以x ± s 表示,采用 SPSS 11. 0 统计软件进行 t 检验.
2 结果
2. 1 原代培养 ENCSCs 形态学观察及鉴定2. 1. 1 原代培养 ENCSCs 形态学观察 原代培养 1 d 时,可见大小、形态不一的贴壁细胞及细胞碎片(图 1A).原代培养2 d 时,瓶底可见部分细胞互相聚集,形成类球状的细胞团块,并且有长的突起向周围延伸(图1B).原代培养3 d 时,细胞球样物体积逐步增大,而且遮光性增加,细胞球之间形成交互的联接(图 1C).第 4 ~ 5 天,贴壁细胞开始离开瓶底悬浮生长,形成神经球样体(图 1D).第 7 ~8 天,神经球形成,体积变大,悬浮生长(图 1E).继续培养可见神经球发出突起"锚"定在培养瓶底部,出现神经网络,与周围细胞形成交互的网络联接(图 1F).

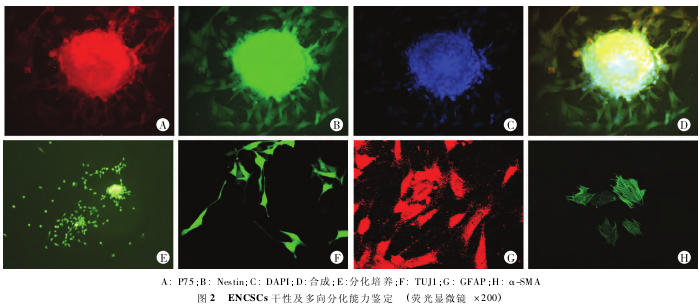
2. 1. 2 原代培养 ENCSCs 干性及多向分化能力鉴定 取传代培养后8 d 形成的神经球进行 P75 和 Nestin 免疫荧光双标染色.结果显示神经球整个球体均充满 P75 和 Nestin 的荧光共表达,提示所获得的神经球内含大量 ENCSCs.另取传代培养后 8 d 形成的神经球加入分化培养基中,分化培养 3 d,见神经球贴壁生长,神经球逐渐消失,大量细胞从神经球内迁出,免疫荧光对细胞进行染色(图 2),显示 ENCSCs 可以分化为神经元(TUJ1+)、神经胶质细胞(GFAP+)、平滑肌细胞(α-SMA+),提示原代培养的 ENCSCs 具有多向分化能力.
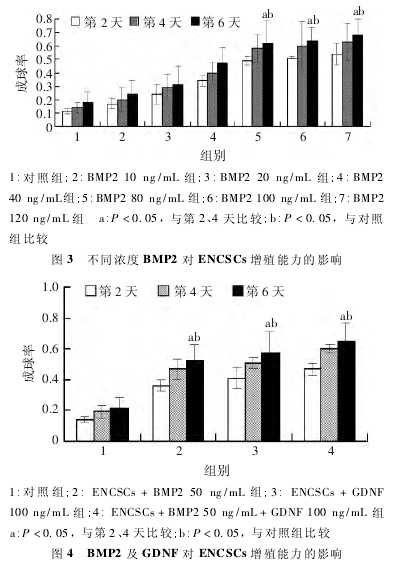
2. 2 BMP2 对原代培养 ENCSCs 生物学行为的影响2. 2. 1 BMP2 对 ENCSCs 成球率的影响 在 低浓度下,ENCSCs成球能力对 BMP2 具有浓度依赖性.随浓度增加(10 ~80 ng / mL),ENCSCs 成球能力逐步增强,但在高浓度 ( 80 ~120 ng / mL) 下,BMP2 不能无限促进 ENCSCs 成球能力( 图 3),表明 BMP2 对 ENCSCs 成球率影响在低浓度时具有浓度依赖性,高浓度时无明显差异.
2. 2. 2 BMP2 及 GDNF 对 ENCSCs 增殖能力的影响 正常培养情况下,ENCSCs 增殖缓慢,BMP2 或 GDNF 单独应用均能促进 ENCSCs 的增殖能力(P < 0. 05),两者联合应用时,对ENCSCs 的增殖能力有协调增强作用( P < 0. 05,图 4) .这提示BMP2 及 GDNF 均对 ENCSCs 的增殖具有正向调节能力,且两者有协同促进作用.
2. 2. 3 BMP2 及 GDNF 对 ENCSCs 迁移能力的影响 利用ENCSCs 向外迁移的特点,采用肠片三维立体培养法研究 BMP2在 ENCSCs 迁移中的作用,结果显示,与对照组[(31 ±5)个/高倍视野]相比,BMP2[(64 ±8)个/高倍视野]或 GDNF[(114 ±14)个/高倍视野]单独培养均能促进 ENCSCs 向外迁移(P <0. 05) ,两者共同作用时[(187 ± 21) 个 / 高倍视野]ENCSCs 迁移能力显着增加(P <0. 05,图 5).这提示 BMP2 对 ENCSCs 的迁移具有正向调节能力,且与 GDNF 有协同促进作用.

3 讨论
肠神经系统起源于 VC,在胚胎发育过程中,VC 的干细胞迁移到达肠道头端,沿头端向尾端移行,并定植分化为肠神经系统.迁移至肠道内的神经嵴干细胞称为 ENCSCs[1].为便于研究 ENCSCs 形成肠神经系统的生物学机制,国外一些实验室从胎鼠或成年鼠体内提取 ENCSCs 获得成功[6],国内亦有研究者从大鼠或小鼠肠道提取 ENCSCs[7].尽管如此,由于 ENCSCs 存在于肠壁肌间,除神经源性细胞外,还有大量的间充质细胞、表皮细胞等,因此 ENCSCs 获取比较困难,技术要求相对较高.
ENCSCs 具有所有干细胞的共性,如自我更新和多向分化能力.目前对干细胞鉴定主要是通过其生物学行为及相应标记物进行.本研究从大鼠胎肠获得的ENCSCs 经体外培养后形成神经球,并可多次传代培养,表明提取的细胞具有自我更新和增殖能力.
ENCSCs 可表达低亲和力神经营养因子受体 P75NTR而不能分化出少突胶质细胞,中枢神经系统干细胞恰好与之相反[8],因此可以作为 ENCSCs 的特异性标记物.
Nestin 是一种中间丝状蛋白---神经巢蛋白,是早期胚胎神经上皮干细胞和神经干细胞的特异性标记物.Holmin 等[9]采用免疫组织化学法证实,几乎所有的神经干细胞存在 Nestin 阳性表达.目前,大多数研究都是采用 Nestin 作为神经干细胞的标记物,随着神经干细胞不断分化成熟,Nestin 的表达量逐渐降低直至消失[6].本研究采用 P75 和 Nestin 免疫荧光双标记的方法,对获得的神经球进行干细胞鉴定获得成功.
ENCSCs 具多向分化能力,一定条件下可以分化为神经元、神经胶质细胞和平滑肌细胞.本研究对获取的神经球在含血清的培养基中分化培养 3 d 后,可见神经球贴壁,大量细胞从球体内迁出,采用免疫荧光技术对分化细胞进行多向分化潜能的鉴定.本研究发现所获得的干细胞可以分化为神经元(TUJ1+)、神经胶质细胞(GFAP+)和平滑肌(α-SMA+),证实所获得的 ENCSCs 具多向分化潜能.综上所述,我们采用机械分离和酶消化法从胎肠获取 ENCSCs,经反复传代提高其纯度,所得到的细胞表达干细胞特异性标记物,并具有自我更新和多向分化潜能,证实获取成功,旨在为进一步研究相关细胞因子在 ENCSCs 调控中的作用奠定基础.
在外周神经系统发育过程中,BMPs 对不同时期的 ENCSCs 有不同的作用.在胚胎发育早期,BMPs 直接参与了神经管背侧 ENCSCs 的形成,在 ENCSCs 的迁移过程中,促进干细胞向外周神经元分化[10].
BMPs 还可以调节体外培养的原代外周神经元及细胞系对营养因子的反应性[11 - 12].以上研究提示 BMPs 在促进 ENCSCs 的形成、迁移及分化方面具有多重作用.
肠神经系统发育方面,目前研究表明 BMPs 信号主要在肠神经系统前体发育过程中起重要作用[13].
BMP2 和 BMP4 属于同一种亚型,可以与相同的受体结合,在胚胎发育早期,BMP2 和 BMP4 协同促使ENCSCs 的发生.Goldstein 等[14]在鸡胚体内研究了BMPs 的具体定位,发现 BMPs 在鸟类消化道及内脏平滑肌神经系统均有表达,且具有时相性,如果阻断BMPs 表达,肠神经元数目减少且异位表达,表明BMPs 在鸟类肠神经系统的形成、发展、分化过程中均起到重要作用.在大鼠体内,BMP2 在胚胎 12 ~ 14 d时达 高 峰,且 BMP2 表 达 受 到 其 受 体 BMPR1A、BMPR1B、BMPR2 以及其拮抗剂 noggin 的影响[15].此外,BMP2 可以促进体外培养的 ENCSCs 克隆形成及向肠神经元分化[16].以上研究表明,BMPs 广泛参与了肠神经系统的各个过程,目前对其确切的作用机制,对 ENCSCs 迁移、增殖、分化等方面的作用尚无明确的论断.
本研究发现,不同浓度 BMP2 对 ENCSCs 成球率的影响具有正向调控作用,在低浓度时,具有浓度依赖性,说明 BMP2 在 ENCSCs 增殖过程起不可或缺的作用,但其确切作用机制尚需进一步证实.
GDNF 是 RET 编码蛋白的配体,GDNF 基因突变合并 RET 基因突变时常加重肠无神经节细胞症的临床症状.研究证实,GDNF 在肠神经系统发育中广泛参与肠神经元的形成、增殖和分化过程[17],是目前已知的对 ENCSCs 迁移具有正向调控作用的因子.本研究采用肠段三维立体培养技术探索 BMP2 对 ENCSCs的迁移作用,BMP2 单独应用即可促进 ENCSCs 向外迁移,在与 GDNF 合用时,促 ENCSCs 迁移的能力增强.
在相同的培养条件下发现 BMP2 和 GDNF 均能显着增强 ENCSCs 的增殖能力,两者合用时效果最为明显.
综上所述,BMP2 对 ENCSCs 的迁移、增殖均具有重要作用,GDNF 可以增强其正向调节作用,说明BMP2 对肠神经系统的发育具有重要作用,为我们更深入地了解肠神经系统的发育以及先天性巨结肠发生机制奠定了实验室基础.
参考文献:
[1] Sasselli V,Pachnis V,Burns A J. The enteric nervous system[J].Dev Biol,2012,366(1): 64 - 73.
[2] Faure C,Chalazonitis A,Rheaume C,et al. Gangliogenesis in the en-teric nervous system: roles of the polysialylation of the neural cell adhe-sion molecule and its regulation by bone morphogenetic protein-4[J].Dev Dyn,2007,236(1): 44 -59.
[3] Shepherd I T,Pietsch J,Elworthy S,et al. Roles for GFRalpha1 re-ceptors in zebrafish enteric nervous system development[J]. Develop-ment,2004,131(1): 241 -249.
[4] Misuno K,Liu X,Feng S,et al. Quantitative proteomic analysis ofsphere-forming stem-like oral cancer cells[J]. Stem Cell Res Ther,2013,4(6): 156.
[5] Hotta R,Pepdjonovic L,Anderson R B,et al. Small-molecule induc-tion of neural crest-like cells derived from human neural progenitors[J]. Stem Cells,2009,27(12): 2896 -2905.
[6] Suarez-Rodriguez R,Belkind-Gerson J. Cultured nestin-positive cellsfrom postnatal mouse small bowel differentiate ex vivo into neurons,glia,and smooth muscle[J]. Stem Cells,2004,22 ( 7 ): 1373 -1385.
[7] 朱利斌,刘征吉,王爱和,等. 大鼠肠神经干细胞体外培养和鉴定[J]. 中华实验外科杂志,2007,24(1): 122.
[8]Kim S U,Nakagawa E,Hatori K,et al. Production of immortalizedhuman neural crest stem cells[J]. Methods Mol Biol,2002,198:55 - 65.
[9]Holmin S,von-Gertten C,Sandberg-Nordqvist A C,et al. Induction ofastrocytic nestin expression by depolarization in rats[J]. NeurosciLett,2001,314(3):151 - 155.
[10]Eom D S,Amarnath S,Fogel J L,et al. Bone morphogenetic proteinsregulate neural tube closure by interacting with the apicobasal polaritypathway[J]. Development,2011,138(15):3179 - 3188.
[11]Hegarty S V,O'Keeffe G W,Sullivan A M. BMP-Smad 1 /5 /8 sig-nalling in the development of the nervous system[J]. Prog Neurobiol,2013,109:28 - 41.
[12]Yumoto K,Thomas P S,Lane J,et al. TGF-β-activated kinase 1(Tak1)mediates agonist-induced Smad activation and linker regionphosphorylation in embryonic craniofacial neural crest-derived cells[J]. J Biol Chem,2013,288(19):13467 - 13480.
[13]Chalazonitis A,Kessler J A. Pleiotropic effects of the bone morphoge-netic proteins on development of the enteric nervous system[J]. DevNeurobiol,2012,72(6):843 - 856.
[14]Goldstein A M,Brewer K C,Doyle A M,et al. BMP signaling isnecessary for neural crest cell migration and ganglion formation in theenteric nervous system[J]. Mech Dev,2005,122(6):821 - 833.
[15]Chalazonitis A,Tang A A,Shang Y,et al. Homeodomain interactingprotein kinase 2 regulates postnatal development of enteric dopaminer-gic neurons and glia via BMP signaling[J]. J Neurosci,2011,31(39):13746 - 13757.
[16] Anitha M,Shahnavaz N,Qayed E,et al. BMP2 promotes differentia-tion of nitrergic and catecholaminergic enteric neurons through aSmad1-dependent pathway[J]. Am J Physiol Gastrointest Liver Phys-iol,2010,298(3): G375 - G383.
[17] Uesaka T,Nagashimada M,Enomoto H. GDNF signaling levels con-trol migration and neuronal differentiation of enteric ganglion precur-sors[J]. J Neurosci,2013,33(41): 16372 -16382.
卵母细胞体外成熟(IVM)是指将不成熟的卵母细胞,在体外模拟体内成熟的微环境,培养至成熟卵子(MⅡ)的过程。此项技术开始于动物实验,早在1935年Pincus发现兔子的不成熟卵可以在体外成熟,并且这个成熟过程是自发的。30年后,Edwars提出人类的不成熟卵母...
体外动物细胞培养已广泛应用于现代医学、生物学和分子遗传学等多个领域,是从事细胞水平及分子水平研究所采用的基本方法。在高原环境下心肌细胞的体外培养尚未见报道。本文拟通过心肌细胞系的体外培养,观察其生长和增殖状况,并通过绘制生长曲线,初步探讨...
藏獒(TibetanMastiff)属食肉目(Carnivora)犬科(Canidae),是原产于青藏高原地区的古老犬种,也是中国唯一的一个大型犬种,属于国家二级保护动物。由于近几十年来藏獒被大量贩运到内地省份,甚至国外,加上当地生存环境...
引言Introduction功能矫形治疗是口腔正畸学中矫治患者下颌发育不足、后缩畸形的主要方法。颞下颌关节是人体关节中能保持终生改建的惟一关节,而髁状突软骨作为下颌骨的主要生长中心,对矫形力的反应直接而又敏感,是临床功能矫形治疗的主要功能区域,同时...
目前,国内外研究多集中于干细胞向神经细胞分化的研究,而对体细胞的研究相对较少。干细胞存在伦理学、免疫排斥以及潜在的致瘤性等问题限制了其在临床上的应用,而具有部分胚胎干细胞特性的人羊膜上皮细胞(humanamnioticepithelialcells,HAEC)不存在上述...
对男性、女性的外周血淋巴细胞进行染色体核型分析发现,在“男1”、“女2”视野中均可找到分散较好、形态较清晰且数量为46条的淋巴母细胞染色体。介...
血管平滑肌细胞(vascularsmoothmusclecells,VSMCs)是动脉发生钙化的主要细胞,最近研究发现血管钙化类似于骨的形成,它是由细胞介导的主动调节过程,同时存在平滑肌细胞表型转变,并与多个成骨相关类因子相关[1].以往体外研究动脉病变的平滑肌细胞...
间充质干细胞(mesenchymalstemcells,MSCs)具有高度增殖和多谱系分化能力,与各种组织的功能维持与修复再生有着密切的联系。但MSC可在体内外环境的影响下,出现增殖能力下降,甚至发生凋亡等现象。在这些影响因素中,活性羰基类物质(reactivecarbonyl...
癌症由于其快速增长的发病率及高死亡率,已经成为人类生命健康的重大威胁,在世界上引起了广泛的关注和重视。在人类日常接触的约6万种化学和生物性因子中,除了已被国际癌症研究署(IARC)确定的Ⅰ和Ⅱ类致癌物外,还有很多是可疑或未知的人类或动物肿瘤启动...
引言.雄性生殖干细胞具有自我复制和分化成精子的能力,是动物体内唯一能进行遗传信息传递的干细胞。雄性生殖干细胞技术的发展和应用,将为克隆动物、濒危动物保种、转基因动物的生产、治疗雄性不育及一些人类遗传疾病的基因治疗提供新的机遇与途径。研究表明,...