
小肠黏膜下层(small intestinal submucosa,SIS)作为一种天然的细胞外基质,无抗原性,作为一种细胞支架成功地应用于骨髓基质干细胞、脂肪基质干细胞及肌细胞等多种细胞的实验研究和临床实践,取得了较好的效果,验证了SIS具有较好的安全性和疗效,但小肠黏膜下层能否应用于人牙本质再生与修复的研究,至今国内外罕见报告,我们拟在体外培养人牙髓干细胞(hDPSCs),采用四唑盐比色法(MTS)、茜素红染色法、碱性磷酸酶(ALP)和逆转录聚合酶链式反应(RT-PCR)方法观察牙髓干细胞在猪小肠黏膜下层的生长情况及测定细胞的牙向分化能力,研究SIS对DPSCs的生物相容性及促进牙向分化能力的影响。
材料和方法。
1.主要试剂和仪器。低糖型DMEM培养基、胎牛血清、胰蛋白酶、I型胶原酶(Gibco公司,美国);β-磷酸甘油钠、维生素C、茜素红S(Sigma公司,美国);二甲基亚砜(DMSO)(Nunc公司,美国);MTS试剂盒(Promega公司,美国);碱性磷酸酶(ALP)试剂盒(中生北控生物科技股份有限公司);TRIzol(Invitrogen,美国);RNA抽提试剂盒、逆转录聚合酶链反应(RT-PCR)试剂盒(Fer-mentas公司,美国);牙本质基质蛋白(DMP-1)、牙本质涎磷蛋白(DSPP)及内参β-action引物(上海生物工程有限公司);倒置相差显微镜及照相系统(Olympus公司,日本);平底96孔培养板、24孔培养板、70μm细胞筛网(Falcon公司,美国);酶联免疫检测仪(BIO-TEK公司,美国);离心机、二氧化碳恒温孵箱(Forma,美国);YJ一875型超净工作台(郑州净化设备厂)。
2.DPSCs的培养和鉴定
2.1DPSCs的原代培养 收集正畸治疗拔除的新鲜年轻恒牙,表面灭菌处理后,无菌条件下取出牙髓,切除根尖约2mm的牙髓,0.01mol/L灭菌PBS冲洗后剪成约lmm×1mm×1mm大小组织块,0.3%的I型胶原酶37℃消化40min,1000r/min离心5min,弃上清,加入少量培养液,轻轻吹打离散细胞团块,将形成的单细胞悬液通过孔径为70μm的细胞筛网,1000r/min离心5min,用含10%胎牛血清的DMEM(含有0.292mg/mL谷氨酰胺、100U/mL青霉素/链霉素)培养液重悬细胞,按1×105个/mL的密度接种于培养瓶。置于37℃、5%CO2培养箱内静置培养,每3d换液1次,待细胞生长汇合达80%时,0.25%胰酶消化传代。
2.2DPSCs的克隆化培养和鉴定将对数生长期的第三代DPSCs以胰酶消化,反复吹打细胞制成细胞悬液。将细胞悬液调整密度为1×105个/mL,乙醇固定30min,PBS洗涤后,加入FITC标记的鼠抗人STRO-1单克隆一抗,于室温孵育1h;PBS再次洗涤后加入羊抗鼠Ig-FITC;流式细胞仪检测细胞表面STRO-1的表达水平。
3.SIS制备 取健康成年猪近端空肠约15cm,清水冲洗干净后浸于无菌生理盐水中,刮除浆膜层和肌层,获得SIS。生理盐水反复冲洗后,按文献Abraham方法脱细胞处理,冻干,剪成与96孔板和12孔板的孔大小的材料。环氧乙烷消毒24h备用。
4.SIS对DPSCs增殖的影响 将SIS置于96孔板中并加入含10%胎牛血清的DMEM150μL,培养24h,弃去原培养液,将DPSCs的单细胞悬液以2×104个/孔接种于96孔板材料上,加入DMEM培养,每隔3d换液1次。另设无材料的空白对照组,相同条件培养。
分别于培养后1d,3d,5d和7d,取实验组与空白对照组各5个复孔,弃去原培养液,每孔中加入100μL无血清培养液和20μLMTS,继续在37℃的孵箱中培养4h,将上清移入另外一个96孔板,空白管调零,在酶联免疫检测仪上以490nm波长测定各孔OD值,求均值,绘制细胞生长曲线。
5.SIS对DPSCs矿化功能的影响 取体积约2cm3的SIS置于无菌培养瓶内,加入DMEM培养基10mL,于37℃、5%CO2培养箱内浸泡24h,提取上清液,制备成材料浸出液。加入10%胎牛血清,4℃保存备用。将DPSCs的单细胞悬液以2×104个/孔接种于12孔板中,加入含10%胎牛血清的DMEM培养液培养,待细胞汇合后,随机分为实验组和对照组,每组5复孔,实验组加入SIS浸提液,对照组用含有10%胎牛血清的DMEM培养液继续培养。每3d换液1次,连续培养3周。进行茜素红染色,倒置显微镜下观察钙化结节形成情况。
6.SIS对DPSCsALP的影响 将DPSCs的单细胞悬液以2×104个/孔接种于96孔板材料上和无材料的空白孔,加入DMEM培养,每隔3d换液1次。
分别于培养后1d,3d,5d和7d,取实验组与空白对照组各5个复孔,弃去原培养液,PBS洗涤细胞3次,吸干,每孔加入50μL的0.2%的TritonX-100,37℃孵育40min后,按ALP试剂盒操作加入ALP底物,将上清移入另外一个96孔板,空白管调零,在酶联免疫检测仪上以520nm波长测定各孔OD值,求均值,绘制细胞生长曲线。
7.RT-PCR检测基因表达 将DPSCs的单细胞悬液以2×104个/孔接种于12孔板材料上和无材料的空白孔,加入DMEM培养,每隔3d换液1次。在培养7d时,弃去原培养液,PBS洗3遍,胰酶消化细胞,实验组过筛70μm,收集细胞,参照RT-PCR试剂盒说明书,进行RT-PCR。
具体步骤:提取细胞总RNA,将5μg总RNA逆转录为cD-NA后行PCR。引物序列:DSPP-正义:5′-TAA GGA CAA GGACGA ATC-3′;DSPP-反义:5′-ACT GCT GTC ACT GCT TTC-3′;DMP-1-正义:5′-CGG CTG GTG GTC TCT CTAAG-3′; DMP-1-反义:5′-GTC CCT CTG GGC TAT CTTCC-3′。β-actin-正义:5′-GAG ACC TTC AAC ACC CCA GCC-3′;β-actin-反义:5′-CAT AGC ACA GCT TCT CTT;TAA-3′作为内参。预期产物分别为:472bp(DSPP)、705bp(DMP-1)、283bp(β-actin)。反应条件为:94℃5min,(94℃变性30s,56℃退火30s,72℃延伸30s)30个循环,72℃延长1min。取10μLPCR扩增产物点样于1%琼脂糖凝胶,80V恒压1h,凝胶成像系统分析产物。
8.统计学处理 实验结果用SPSS12.0统计软件处理,各组之间采用独立样本t检验进行显著性分析,P<0.05为有统计学差异。
结果
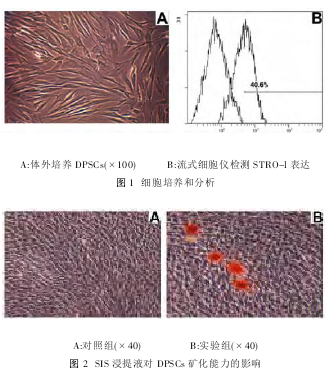
1.体外原代培养的DPSCs接种12h后开始贴壁伸展,到7d左右达80%汇合。96孔板有限稀释法克隆化培养14d,细胞克隆形成。纯化的DPSCs,细胞繁殖能力强,3~4d可再次传代。倒置显微镜下观察,多数为长梭形的成纤维细胞样细胞,少数为多角形及不规则形(图1A)。流式细胞检测的结果表明,克隆培养的DPSCsSTRO-1(40.6%)表达阳性(图1B)。阳性STRO-1为早期间充质干细胞的标记物。
2.SIS对DPSCs增殖活性的影响连续培养7d,两组细胞均保持持续增殖,对比实验组和对照组细胞生长曲线,培养3d,5d和7d,SIS组的细胞增殖能力比对照组明显增强(P<0.05),SIS对DPSCs的增殖有着显著的促进作用(图3)。

3.SIS对DPSCs矿化功能的影响SIS浸提液诱导DPSCs3周后的茜素红染色,光学显微镜下可见有红色矿化结节形成。对照组未见矿化结节形成(图2)。
4.SIS对DPSCsALP活性的影响接种在SIS材料上的DPSCs连续培养过程中,发现随培养时间的延长,两组细胞ALP活性均保持持续增高,对比实验组和对照组细胞生长曲线,培养3d,5d和7d,SIS组细胞的ALP活性比对照组明显增高(P<0.05),SIS对DPSCs的ALP活性具有显著促进作用(图4)。
5.SIS诱导DPSCs中DSPP和DMP-1基因表达接种在SIS材料上的DPSCs培养1周后,RT-PCR产物经琼脂糖凝胶电泳分析后,实验组可见472bp(DSPP)和705bp(DMP-1)大小的特异性扩增产物条带,对照组未出现特异性扩增条带(图5)。表明SIS诱导了DPSCs表达成牙本质细胞的特异性标志DSPP和DMP-1。

讨论
组织工程牙齿研究中,种子细胞和支架材料直接关系到组织再生成功与失败。2000年,Gronthos等从牙髓组织中分离出具有干细胞特性的细胞,并进一步研究表明该细胞不仅在体外经诱导后可分化为成牙本质样细胞,而且在体内能形成牙本质-牙髓复合体样结构,从而首次提出了牙髓干细胞的概念,为实现天然牙齿的构建提供了可喜的前景。牙本质-牙髓复合体的形成是牙本质再生的必要条件。因此,DPSCs已被认为是牙齿组织再生与修复的首选种子细胞。
本实验通过研究SIS对DPSCs的体外增殖及分化的影响实验,探索SIS能否成为牙齿组织工程的优良支架材料。
牙齿组织工程中,良好支架除了能够为种子细胞提供载体,更重要的是具有与周围组织相一致的化学稳定性和物理特性,提供良好的生物相容性,利于细胞的贴附、增殖和牙向分化,SIS是从猪空肠黏膜下层分离出的无细胞胶原层,无免疫特性,内部含有丰富的有助于细胞生长的蛋白和细胞因子,包括胶原,糖蛋白,蛋白聚糖,血管内皮生长因子,成纤维细胞生长因子和转化生长因子,能够为细胞生长提供良好的生理微环境。本实验发现DPSCs在SIS材料上及其浸提液中能够正常贴附、生长、繁殖,证明了该生物材料有良好的细胞相容性。MTS检测结果显示经SIS诱导后的DPSCs增殖的OD值明显大于对照组,进一步证明该生物材料对DPSCs有着良好的生物相容性,能促进细胞增殖。
本实验中,我们通过检测ALP活性,茜素红染色及RT-PCR分析了SIS对DPSCs的牙向分化能力的影响。发现经SIS诱导后DPSCs的ALP活性较对照组明显增强,其浸提液诱导后的DPSCs形成大量矿化结节。
此外,我们还发现经SIS浸提液诱导后的DPSCs可以形成矿化结节,证明SIS促进了DPSCs分化。此外,RT-PCR研究进一步发现,经SIS诱导后DPSCs在mRNA水平表达DSPP和DMP-1。ALP的活性和矿化结节的形成是牙源性细胞向矿化表型分化的早期标志,是成牙本质的基础,其形成能力是评价DPSCs功能的重要指标。DSPP和DMP一1基因是成牙本质过程中,牙本质细胞分化和基质矿化的相关基因,调控着牙本质的矿化。SIS包含有超过90%的I型和Ⅲ型胶原,以及纤维粘连蛋白(FN)。I型胶原是骨有机质组成的主要成分,在体内为钙盐的沉积提供支架,体外实验研究中,I型胶原促进DPSCs向成牙本质细胞诱导分化。
因此,以上特异性的牙本质矿化标志物在诱导后DPSCs中的阳性表达可充分说明SIS中生物活性因子促进了DPSCs的牙向分化,形成大量细胞外基质。
本实验结果显示,体外细胞培养中,SIS促进了DPSCs的增殖、诱导了DPSCs向牙本质样细胞分化,有良好的生物相容性,为DPSCs提供一个良好的牙向分化的微环境,是一种良好的牙本质组织工程生物材料;但是,脱矿牙本质基质诱导干细胞牙向分化过程中的分子调控机制尚不清楚,仍需进一步的研究。
慢性阻塞性肺疾病(COPD)是目前惟一一种发病率和病死率均持续增高的疾病,严重影响人类健康。近年来对COPD发病机制、流行病学、诊断等多方面的研究已取得了实质性进步,但COPD依然是困惑人类和医学界的世界性难题。目前普遍认为,有害物质或感染引发肺内炎症导致...
C1qTNF相关蛋白(C1qTNF-relatedprotein,CTRP)隶属脂肪细胞因子家族,现已确定这个家族有15个成员。其中的脂联素已经具有将近20年的研究历史,在肥胖、II型糖尿病发生、胰岛素抑制,以及在由肥胖引起的慢性炎症发生过程中具有重要的作用,目前研究发现,在代...
近年来,随着基因敲除及转基因技术的兴起及发展,小鼠作为实验动物在心血管疾病的研究中发挥越来越重要的作用.主动脉弓缩窄术(transverseaorticconstriction,TAC)是目前常用的研究压力过负荷型心肌肥大及心力衰竭的模型[1].TAC所致的病理性心肌肥大不是一...
多氯联苯(polychorinatedbiphenyls,PCBs)是一种全球性环境污染物,对生物体可产生严重的毒害作用,尤其是对发育过程中的胎儿更为敏感,可导致运动失调、脑损伤、发育迟缓、智商降低等神经毒性.PCBs的神经毒性机制尚不清楚,可能通过调节基因表达而产...
在人体生理调节过程中,淋巴管具有调节组织液平衡、输送免疫细胞参与免疫应答、吸收膳食脂肪等的功能[1].淋巴管功能减弱时,会导致淋巴管水肿。而淋巴管生长异常时,与肥胖、高血压和炎症性疾病有关。在癌症发展过程中,肿瘤细胞能利用新生成的淋巴管把自身...
全球有3.5亿人感染乙肝病毒(hepatitisBvirus,HBV),感染HBV是肝脏疾病的主要原因,HBV是肝细胞癌(hepatocellularcarcinoma,HCC)的致病因子已得到公认。肿瘤的扩散、转移是恶性肿瘤的主要特征,肝癌细胞的连续增殖和不断分化是肝癌转移浸润的...
1、概述1.1CaN发现钙调神经磷酸酶(CalcinurinCaN)也称依赖钙调蛋白的磷酸酯酶、神经贮钙蛋白、蛋白磷酸酶2B(PP2B),首次由张槐耀教授、王学荆教授在猪脑中提纯成功,后由Klee将其命名为Calcinurin,汉译为钙调神经磷酸酶,是目前所发现的唯一受Ca2+和钙调...
病理诊断是通过观察器官大体改变、镜下观察组织结果和细胞病变特征作出的疾病诊断, 较之根据病史、症状、体征作出的分析性诊断和利用影像设备所作的诊断更具科学性和准确性, 可作为疾病诊断的金标准。...
表浅淋巴结是淋巴细胞聚集并且进行适应性免疫应答主要场所,它与多种疾病发生有着密不可分的关系。转移瘤组织学类型、表浅淋巴结侧位、其原发瘤部位与组织学类型相关性的研究一直是研究热点。腋窝淋巴结是乳腺癌转移的主要途径之一,临床常通过腋窝淋巴结转移...
胰岛素样生长因子(IGFs)作为一类多功能细胞增殖调控因子,是一种在分子结构上与胰岛素类似的多肽蛋白物质,又称类胰岛素生长因子。其由两类物质组成,即IGF-Ⅰ和IGF-Ⅱ。在人体内,IGF-Ⅰ是胰岛素样生长因子的主要组成部分,除肝细胞是主要的分泌细胞外,肾细胞、...