
肾素-血管紧张素系统( renin-angiotensin sys-tem,RAS) 的激活引起高血压,血管紧张素Ⅱ( an-giotensin Ⅱ,AngⅡ) 作为该系统的最终效应分子,可上调人脐动脉平滑肌细胞( human umbilical arterysmooth muscle cells,HUASMC) 缺氧诱导因子 1( hy-poxia-inducible factor-1,HIF-1α) 的表达,增加其下游血管内皮生长因子 ( vascular endothelial growthfactor,VEGF) 表达,具有促 HUASMC 增殖[1]的作用,是导致高血压血管阻力增加的原因之一.HIF-1α 是缺氧调节中的重要因子,其表达主要受氧浓度影响,低氧可在转录和翻译水平激活 HIF-1α 的表达,对其下游基因进行调节,产生一系列代偿或病理反应,在氧稳态调节、低氧适应等方面发挥重要作用.此外,AngⅡ、凝血酶等非缺氧刺激也能上调HIF-1α 的表达[2].AngⅡ可通过不同机制在转录或翻译水平影响 HIF-1α 的表达[3],也可在翻译后水平影响细胞 HIF-1α 的稳态,如: 在翻译后水平影响HIF-1α 的羟化.脯氨酸羟化酶( prolyl hydroxylases,PHD) 和缺氧诱导因子 1 抑制因子( factor inhibitinghypoxia-inducible factor-1,FIH-1) 是羟化 HIF-1α 的关键酶.哺乳动物有 3 种 PHD: 即 PHD1、PHD2 和PHD3,其相对活性大小为 PHD2 > PHD3 > PHD1,PHD2 对 HIF-1α 的调节呈氧依赖性,是常氧状态下维持 HIF-1α 稳态水平的关键限制酶[4].常氧时PHD2 与 FIH-1 羟化 HIF-1α,使之迅速降解; 缺氧时,PHD2 失去活性、FIH-1 酶活性受抑制,HIF-1α降解受阻,在胞内积聚并转位入核,促进其下游低氧反应基因的转录,引起细胞对低氧的一系列反应.Pagé 等[5]研究表明,在 HUASMC 中,AngⅡ通过调节细胞内抗坏血酸浓度改变 PHD2 的活性,在翻译后水平改变 HIF-1α 的羟化,影响胞内 HIF-1α的稳定性,PHD2 基因与蛋白的表达不受 AngⅡ的影响.AngⅡ对 HUASMC 中 FIH-1 的影响及其具体机制如何尚未见报道.本研究拟通过观察 AngⅡ对HUASMC 中 HIF-1α、VEGF 以及 PHD2、FIH-1 和 p-ERK 表达的影响,探讨 PHD2、FIH-1、p-ERK 在 AngⅡ影响 HIF-1α 表达中的作用; 并用 ERK 信号通路抑制剂 PD98059 阻断 ERK 信号通路激活,探讨ERK 通路在 Ang Ⅱ作用下介导 FIH-1 影响 HIF-1α的可能机制.
1 材料和方法
1. 1 主要材料
HUASMC 购于美国 Scien Cell 公司; AngⅡ购于美国 Sigma 公司; 细胞培养基、胎牛血清、胰蛋白消化酶、RIPA 裂解液购于瑞典 Gibco 公司; 青霉素和链霉素购于美国 Sigma 公司; 兔抗 HIF-1α、兔抗PHD2 购于瑞典 Novus Bioscience 公司; 兔抗 VEGF、兔抗 FIH-1 购于英国 Abingdon 公司; HRP 标记的二抗购于瑞典 Amersham Biosciences 公司; PVDF 膜购于美国 Millipore 公司; ECL 显色试剂盒购于 GEHealthcare 公司.
1. 2 HUASMC 的复苏、传代培养及分组
将细胞冻存管从液氮中取出,迅速复温到 37℃,将细胞悬液吸入 15 mL 离心管,1000 r/min 离心 5min,弃上清,以含 20% 胎牛血清的细胞培养基 15 mL吹打,制成细胞悬液,用5 mL 移液器转移细胞悬液至一次性细胞培养瓶中,放入 37℃、5% 的 CO2培养箱中培养.待细胞生长融合 80% 时,吸出培养液,PBS轻轻洗荡 3 次,加入胰蛋白消化酶 l mL 消化 2 ~ 3min 弃胰酶,加入含 10% 胎牛血清的细胞培养基终止消化,用5 mL 移液器吹打,使细胞完全脱落,并吹打混匀.取0.1 mL 消化液,倒置显微镜下观察计数,调整细胞数为5 ×10^8/ L,将细胞悬液接种于新的培养瓶中,每24 h 换液一次.细胞分为 3 组: ( 1) 对照组: 正常培养基培养细胞6 h; ( 2) AngⅡ组:含 AngⅡ的培养基( 终浓度为 10^- 6mol / L) 培养细胞 6 h; ( 3) AngⅡ +PD98059 组: 含 PD98059 的培养基 ( 终浓度为 10^- 5mol / L) 预处理细胞 1 h 后,加入含 AngⅡ的培养基( 终浓度为10^- 6mol / L) 培养细胞 6 h.
1. 3 Real Time PCR 检测 HIF-1α、VEGF、PHD2 和FIH-1 基因表达Trizol 法提取细胞 RNA,逆转录成 cDNA,以 β-actin 为内参行 Real Time PCR,记录 Ct 值,分别检测HIF-1α、VEGF 以及 PHD2、FIH-1 的基因表达.HIF-1α 上、下游引物分别为 5'-TGC TTG GTG CTG ATTTGT GA-3'和 5'-GGT CAG ATG ATC AGA GTC CA-3',产物长度 209 bp.VEGF 上、下游引物分别为 5'-CCT CCG AAA CCA TGA ACT TT-3'和 5'-AGA GATCTG GTT CCC GAA AC-3',产物长度 637 bp.PHD2上、下游引物分别为 5'-CTC ACT GAC CTA CGCCGT GT-3' 和 5'-CGC ATC TTC CAT CTC CAT TT-3'.FIH-1 上、下游引物分别为 5'-ACA GTG CCAGCA CCC ACA AC-3'和 5'-GCC CAC AGT GTC ATTGAG CG-3'.PCR 条件为: 95℃ 变性 5 min,94℃ 20s,72℃ 20 s,72℃ 5 min,55℃ 10 s,40 个循环.内参β-actin 上、下游引物分别为 5'-GTG GGG CGC CCCAGG CAC CA-3'和 5'-CTT CCT TAA TGT CAC CCACGA TTT C-3',产物长度 540 bp,其 PCR 条件为:94℃ 变性 5 min,94℃ 30 s,66℃ 45 s,72℃ 45 s,72℃ 10 min,40 个循环.
1. 4 Western blot 检测 HIF-1α、VEGF、PHD2、FIH-1、ERK 和 p-ERK 的蛋白表达.分组处理细胞后,弃培养基,PBS 洗2 次,加 RIPA裂解液,冰孵30 min,4℃ 12000 r/min 离心20 min,收取上清液分装于 -80℃备用.取总蛋白 60 μg,100℃煮沸 5 min,10%SDS-聚丙烯酰胺凝胶电泳分离蛋白,转印到 PVDF 膜,5%脱脂牛奶封闭60 min,加一抗( 稀释度1∶1000) ,4℃过夜,HRP 标记的二抗孵育1 h,TBS-T漂洗5 次( 每次5 min) .ECL 试剂盒显影,X 线片扫描后,Image J 图像分析软件分析.
1. 5 统计学分析
数据用x ±s 表示,SPSS 17.0 软件进行统计分析.多组间比较用 ANOVA 方差分析,组间比较用独立样本 t 检验; 双侧 P <0.05 表示差异有统计学意义.
2 结 果
2. 1 HIF-1α、VEGF、PHD2 和 FIH-1 基因的表达
与对照组比较,AngⅡ组 HIF-1α、VEGF 基因表达显着增加,FIH-1 基因表达降低( P 均 < 0. 05) ,PHD2 基因表达无显着变化.与 AngⅡ组比较,AngⅡ + PD98059 组 HIF-1α、VEGF 基因表达显着降低,FIH-1 基因表达增加( P 均 < 0. 05 ) ,同样 PHD2 基因表达无明显改变( 图 1) .
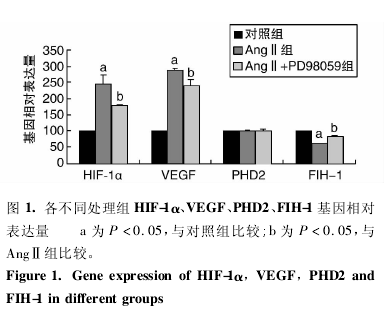
2. 2 HIF-1α、VEGF、PHD2、FIH-1 及 ERK、p-ERK 蛋白的表达
与对照组比较,AngⅡ组 HIF-1ɑ、VEGF 蛋白表达显着增加,FIH-1 蛋白表达显着降低( P 均 <0. 05) ,而 PHD2 蛋白和 ERK 蛋白表达无显着变化,但磷酸化 ERK ( p-ERK) 蛋白表达显着增加( P <0. 05) .与AngⅡ组比较,AngⅡ+ PD98059 组 HIF-1ɑ、VEGF 蛋白表达显着降低,FIH-1 蛋白表达显着增加( P 均 <0. 05) ,而 PHD2 蛋白和 ERK 蛋白表达无明显改变,p-ERK 蛋白表达显着降低( P < 0. 05; 图 2) .
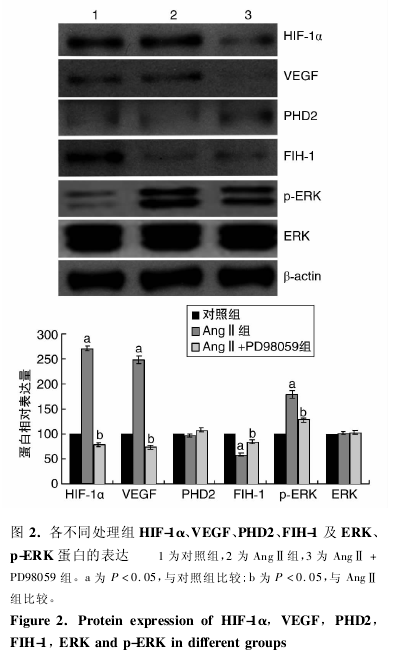
3 讨 论
高血压时 AngⅡ与其受体 AT1R 结合后通过多条信号通路促进平滑肌细胞增殖、向内膜迁移,是导致血管阻力增大的原因之一.AngⅡ上调 HIF-1α的表达后促进 HIF-1α 下游靶基因 VEGF 的表达,在平滑肌细胞增殖中起重要作用.与以往研究一致[1,6],我们的结果显示,AngⅡ处理的 HUASMC 中HIF-1α 和 VEGF 的表达均显着增加,说明 AngⅡ上调 HIF-1α 表达,具有促 VEGF 表达的作用.
HIF-1α 是细胞缺氧时被诱导产生的关键因子,通过激活其下游近 100 多种与缺氧相关基因的转录,在缺氧适应性反应和损伤中起重要作用.HIF-1α 翻译后水平的调节受氧浓度影响: 常氧时,HIF-1α 被氧依赖性与氧非依赖性通路所激活的酶降解,几乎无活性; 细胞缺氧时,堆积在胞浆的 HIF-1α 入核,与靶基因 DNA 结合,发挥其转录激活功能.
PHD2 是翻译后水平调节 HIF-1α 的限速酶,通过羟化 HIF-1α 促进其降解[7].我们发现,AngⅡ组HIF-1α 表达虽增加,但 PHD2 基因和蛋白表达无显着变化.根据 Pagé 等[5]研究结果,需考虑 AngⅡ不影响 PHD2 基因和蛋白表达,但不排除其它因素参与 AngⅡ对 HIF-1α 的调节作用.
FIH-1 是另一种在翻译后水平通过羟化 HIF-1α而影响其稳态的关键酶.FIH-1 的蛋白表达在组织细胞中比较稳定[8],对低氧的耐受性比 PHD2 强,0. 2% 的低氧处理可使 PHD2 的羟化作用失活,但FIH-1 的羟化作用仍存在[9],缺氧不改变 FIH-1 蛋白的表达[10].有研究表明 FIH-1 的转录活性受PKC 信号通路的影响,活化的 PKC 通过与 FIH-1 基因 DNA 的 CDP/Cut 相结合,可抑制 FIH-1 的转录活性[11].结果显示,AngⅡ显着降低 HUASMC 中 FIH-1 基因和蛋白表达的同时,显着激活 ERK 信号通路,增加 p-ERK 蛋白表达; 用 ERK 抑制剂 PD98059阻断 ERK 信号通路的活化后,p-ERK 蛋白表达显着降低,FIH-1 表达上调,HIF-1α、VEGF 表达均下降.
提示 ERK 通路对 FIH-1 的影响趋势与 PKC 通路的影响趋势类似: ERK 信号通路激活后磷酸化的 ERK介导 AngⅡ下调 FIH-1 的表达,使 HIF-1α 的降解减少,增加细胞内 HIF-1α 蛋白表达以及 VEGF 基因和蛋白表达,这可能是 AngⅡ上调 HIF-1α 蛋白表达的机制; 然而 ERK 信号通路介导 AngⅡ下调 FIH-1 表达的具体作用机制有待进一步研究.同时,HUA-SMC 中 HIF-1α 基因表达上调并不能单一地归于FIH-1 表达下降所致,可能 AngⅡ本身从转录水平上调了 HIF-1α 的基因表达[3].
综上所述,我们发现磷酸化 ERK 信号通路介导AngⅡ下调 HUASMC 中 FIH-1 基因和蛋白表达,该表达的下调可能是 AngⅡ上调 HIF-1α 蛋白表达的机制之一; ERK 抑制剂削弱了 AngⅡ对 HUASMC 中 HIF-1α、VEGF 表达的诱导作用.这些结果为防治高血压AngⅡ促血管平滑肌细胞增殖提供了新思路.
[参考文献]
[1]Richard DE,Berra E,Pouyssegur J. Nonhypoxic pathway mediatesthe induction of hypoxia-inducible factor 1alpha in vascular smoothmuscle cells[J]. J Biol Chem,2000,275 ( 35) : 26 765-771.
[2]Grlach A,Diebold I,Schini-Kerth VB,et al. Thrombin activatesthe hypoxia-inducible factor-1 signaling pathway in vascular smoothmuscle cells: role of the p22 ( phox) -containing NADPH oxidase[J]. Circ Res,2001,89 ( 1) : 47-54.
[3]Pagé EL,Robitaille GA,Pouysségur J,et al. Induction of hypoxia-inducible factor-1 by transcriptional and translational mechanisms[J]. J Biol Chem,2002,277 ( 50) : 48 403-409.
[4]Su Y,Loos M,Giese N,et al. Prolylhydroxylase-2 ( PHD2) exertstumor-suppressive activity in pancreatic cancer[J]. Cancer,2012,118 ( 4) : 960-972.
[5]Pagé EL,Chan DA,Giaccia AJ,et al. Hypoxia-inducible factor-1alpha stabilization in nonhypoxic conditions: role of oxidation andintracellular ascorbate depletion[J]. Mol Biol Cell,2008,19 ( 1) :86-94.
[6]Lauzier MC,Pagé EL,Michaud MD,et al. Differential regulationof hypoxia-inducible factor-1 through receptor tyrosine kinase trans-activation in vascular smooth muscle cells [J]. Endocrinology,2007,148 ( 8) : 4 023-031.
[7]McMahon S,Charbonneau M,Grandmont S,et al. Transforminggrowth factor beta1 induces hypoxia-inducible factor-1 stabilizationthrough selective inhibition of PHD2 expression[J]. J Biol Chem,2006,281 ( 34) : 24 171-181.
[8]Bracken CP,Fedele AO,Linke S,et al. Cell-specific regulation ofhypoxia-inducible factor ( HIF) -1alpha and HIF-2alpha stabilizationand transactivation in a graded oxygen environment[J]. J BiolChem,2006,281 ( 32) : 22 575-585.
[9]Stolze IP,Tian YM,Appelhoff RJ,et al. Genetic analysis of therole of the asparaginyl hydroxylase factor inhibiting hypoxia-induc-ible factor ( HIF) in regulating HIF transcriptional target genes[J].J Biol Chem,2004,279( 41) : 42 719-725.
[10]Fukuba H,Yamashita H,Nagano Y,et al. Siah-1 facilitates ubiq-uitination and degradation of factor inhibiting HIF-1alpha ( FIH )[J]. Biochem Biophys Res Commun,2007,353( 2) : 324-329.
[11]Li J,Wang E,Dutta S,et al. Protein kinase C-mediated modula-tion of FIH-1 expression by the homeodomain protein CDP / Cut /Cux[J]. Mol Cell Biol,2007,27 ( 20) : 7 345-353.
抵抗素样分子(RELM),是一个与炎症相关的缺氧诱导有丝分裂因子,具有促增殖、血管收缩、血管新生和类趋化因子的作用[1-4].RELM具有分布特异性,在脂肪的间质血管及慢性缺氧和辅助性Th2细胞介导的炎性反应的肺组织中表达升高[5].在血管平滑肌细胞、血管内皮...
随着疾病谱的变化,慢性病已引起人们的关注。慢性疾病,其特点是进展缓慢,病程长,死亡率高,占全世界死亡原因的60%以上。心脑血管病、糖尿病是常见的慢性病,严重影响人们的身体健康。...
微波辐射能使液体中极性分子高频振动,增加液体分子间的碰撞,从而使液体内部迅速产热和某些化学反应加快。许多作者利用此原理进行了微波辐射固定组织、微波辐射结合固定液固定组织[1-2]等,均取得良好的效果,但还没发现用微波辐射结合固定液固定心肌或用微...
特发性肺纤维化(idiopathicpulmonaryfibrosis,IPF)病因未明、好发于成人、局限于肺部、进行性进展,以寻常型间质性肺炎为病理特征的一种间质性肺疾...
多氯联苯(polychorinatedbiphenyls,PCBs)是一种全球性环境污染物,对生物体可产生严重的毒害作用,尤其是对发育过程中的胎儿更为敏感,可导致运动失调、脑损伤、发育迟缓、智商降低等神经毒性.PCBs的神经毒性机制尚不清楚,可能通过调节基因表达而产...
动脉粥样硬化(AS)是一种累及全身血管的慢性病变。AS不仅仅是脂质代谢紊乱,同时也是一种慢性炎症性疾病,多种免疫细胞及细胞因子参与了其发生与进展。单核细胞迁移到内皮下转化为具有吞噬作用的巨噬细胞,通过清道夫受体(scav-engerre...
肺动脉高压(pulmonary、artery、hypertension,PAH)是一类严重的进展性疾病,其主要特征是肺血管阻力进行性升高,持续发展可导致患者右心衰竭而死亡[1]。肺血管重构是肺血管阻力进行性升高的重要病理生理基础,肺动脉平滑肌细胞(pulmonaryarterialsmooth...
生肌白玉膏为甘肃中医学院附属医院院内制剂,主要作用是化腐生...
间充质干细胞(mesenchymal stem cells,MSCs)是一种多能干细胞,具有自我更新和多向分化潜能。1970年,AJ Friedenstein等首次发现了作为成骨前体细胞的骨髓MSCs,而直至2006年国际细胞治疗学会MSCs委员会才提出了界定MSCs的最低标准。...
神经肽FF(neuropeptideFF,NPFF)属于哺乳动物类酰胺化神经肽,最初从牛脑中分离出来,并且表现出高度保守性[1].NPFF主要分布于中枢以及外周神经系统,下丘脑部位含量最高。2000年,Bonini等[2]首次分离出NPFF最重要的2个受体基因,NPFF1受体和NPF...