摘 要: 中枢神经系统由数量庞大、类型多样的神经细胞和神经胶质细胞组成,它调节生物体各种生理活动以及学习、记忆和思维等认知功能。神经细胞和神经胶质细胞由神经干细胞产生,所以对神经干细胞的研究有十分重要的意义。果蝇作为一种经典模式生物,长期被用于神经干细胞增殖、分化、凋亡等方面的研究。本文阐述了果蝇神经干细胞的最新研究进展,包括神经干细胞的类型和起源,参与神经干细胞不对称分裂的关键蛋白质,神经干细胞的静息、激活和最终的分化或凋亡,以及神经元多样性产生的机制,希望对神经生物学的基础研究有所帮助。
关键词: 果蝇; 中枢神经系统(CNS); 神经干细胞; 不对称细胞分裂; 神经元的多样性;
Abstract: The central nervous system(CNS) is composed of an enormous number of neurons and glial cells.It regulates many important physiological activities as well as higher cognitive functions such as learning,memory, and thinking. Because neurons and glial cells are generated by neural stem cells, the research of neural stem cells is of great importance. Drosophila melanogaster, as a classic model organism, has long been used in the study of proliferation, differentiation and apoptosis of neural stem cells, and has made significant contributions in these areas. Herein, the latest research progress in neural stem cells of Drosophila was summarized. It included the origins and types of neural stem cells, the key proteins of asymmetric stem cell division, the quiescence, reactivation and terminal differentiation or death of neural stem cells, and the generation of neuronal diversity. This work may be helpful to the fundamental research on neurobiology.
Keyword: Drosophila; central nervous system(CNS); neural stem cells; asymmetric cell division; neuronal diversity;
神经干细胞是一类存在于神经系统中的具有自我更新能力和多分化潜能的细胞,其分裂必须维持一种精确的平衡。神经干细胞分裂不足会导致神经系统发育缺陷,而神经干细胞的过度增殖则可能导致肿瘤的发生。因此,对神经干细胞维持、增殖和分化的研究,有着极其重要的意义。目前,学界对神经干细胞的深入研究有望被用来治疗多种神经系统疾病,如帕金森病、阿尔茨海默病、亨廷顿病等[1,2,3]。因为哺乳动物神经系统极为复杂且存在伦理限制,所以哺乳动物神经干细胞的研究面临极大困难。与哺乳动物相比,果蝇中枢神经系统结构较为简单,是研究神经干细胞的良好模型。
果蝇中枢神经系统由视叶、中脑和腹神经索组成。视叶位于脑半球的侧面,由神经板、脑髓神经节和视觉小叶复合体组成,处理从眼睛获得的视觉信号。中脑位于脑半球中间部分,其中包含学习与记忆的中心———蘑菇体。腹神经索位于脑后方,包含胸部和腹部两个部分,能传导信息,是大脑和周围神经系统的桥梁。视叶、中脑和腹神经索都由不同类型和数量的神经干细胞增殖、分化而来,本文总结和归纳最新的研究进展,对这些区域的神经干细胞进行一一阐述。
1、 神经干细胞的起源
果蝇中枢神经系统的干细胞也称之为成神经细胞(neuroblast,NB),由神经外胚层的上皮细胞转化而来。其中,腹神经索神经干细胞起源于腹部神经外胚层,中脑和视叶神经干细胞起源于头部神经外胚层。
腹神经索神经干细胞产生于胚胎时期,由原神经基因的表达和侧向抑制共同作用产生[4,5]。原神经基因achaete(ac)、scute(sc)和lethal of scute(l’sc)组成achaete-scute complex(as-c),表达在腹部神经外胚层的由5~6个细胞组成的细胞簇中,其中一个细胞由于高水平表达原神经基因,故会从细胞簇离层,转化为神经干细胞,其他细胞则通过侧向抑制作用而分化为表皮细胞。在侧向抑制过程中,AS-C促进Delta表达,Delta激活相邻细胞的Notch受体,促进Notch通路靶基因E(spl)表达,E(spl)蛋白作为转录因子能抑制AS-C的表达,从而抑制相邻细胞向神经干细胞的转化。
中脑神经干细胞在胚胎期形成的机制尚不清楚。尽管原神经基因ac、sc和l’sc也表达于头部神经外胚层,但它们极少共表达在同一区域,且在表达时间上也存在差异。研究发现,在头部神经外胚层中,相邻的神经上皮细胞可同时转化为神经干细胞,这一现象提示侧向抑制可能并不参与中脑神经干细胞的转化过程[6]。因为侧向抑制作用依赖于Notch信号,所以Kunz等[7]利用温度敏感型Notchts1突变体在果蝇胚胎发育早期阻断Notch信号,结果显示中脑蘑菇体神经干细胞的数量、大小和位置都没有改变,这表明侧向抑制可能确实不参与蘑菇体神经干细胞的转化过程。

视叶神经干细胞起源于胚胎期的神经上皮细胞。在胚胎发育第11期,头部外胚层背侧区域的30~40个神经上皮细胞内陷,紧贴于中脑,形成视叶原基[8]。其中,少量神经上皮细胞经过一次分裂后转化为神经干细胞,这些神经干细胞可通过不对称分裂产生少量的视叶神经元[9]。随后,这些神经干细胞和视叶神经上皮细胞进入静息状态,直到一龄幼虫期才重新进入细胞周期。此时,视叶神经上皮细胞开始进行对称细胞分裂,以扩增神经上皮细胞群体,最终分离为外部增殖中心(outer proliferation center,OPC)和内部增殖中心(inner proliferation center,IPC)。在二龄幼虫晚期,原神经基因l’sc在OPC区域瞬时表达,形成原神经波(proneural wave)。原神经波从OPC中间向侧面移动,使得神经上皮细胞逐渐转化为脑髓神经节神经干细胞[10,11]。OPC神经上皮细胞向神经干细胞转化受到许多信号通路的调控,如JAK/STAT、Notch、EGFR、Fat/Hippo以及Wingless/Wnt信号通路[12]。与OPC类似,IPC在幼虫发育早期通过对称分裂扩增神经上皮细胞群体,到三龄幼虫早期开始转化为神经干细胞,其转化机制与OPC神经干细胞的转化机制不同。IPC可分为3个区域,即近端-IPC、表面-IPC和远端-IPC。研究发现,近端-IPC的神经上皮细胞首先转化为迁移性的前体细胞,它不表达神经干细胞的标记蛋白质,迁移后形成远端-IPC。随后,远端-IPC细胞转化为神经干细胞,产生远端细胞(distal cells)和视小叶板的神经元[13]。表面-IPC神经上皮细胞不迁移,直接转化为神经干细胞,产生视小叶神经元。
2 、神经干细胞的类型与分布
根据分裂方式的不同,果蝇神经干细胞可分为Ⅰ型、Ⅱ型和0型。
Ⅰ型神经干细胞是果蝇中最普遍的干细胞类型,大多数神经干细胞属于这种类型,包括腹神经索神经干细胞、大部分中脑神经干细胞、视叶的脑髓神经节干细胞(图1A)[14]。Ⅰ型神经干细胞每次不对称分裂产生1个神经干细胞和1个小的神经节母细胞(ganglion mother cell,GMC)。GMC通常分裂一次产生两个神经元或胶质细胞(图1B)。
2008年,一种新型的神经干细胞被发现,称为Ⅱ型神经干细胞[15,16,17]。Ⅱ型神经干细胞不表达Ase(Asense),其通过不对称分裂产生1个神经干细胞和1个小的中间神经前体细胞(intermediate neural progenitor,INP)。每个INP可进行4~6次不对称分裂,每次产生1个GMC,这样一共产生4~6个GMC细胞和8~12个神经细胞或胶质细胞(图1B)。Ⅱ型神经干细胞产生的家系是Ⅰ型神经干细胞家系的3~5倍(370~580个细胞)。Ⅱ型神经干细胞在胚胎期形成,每个大脑半球共有8个,其中6个在中脑的背中部,2个在中脑的背侧部[17](图1A)。目前,Ⅱ型神经干细胞的来源尚不清楚,可能由神经外胚层转化而来,也有可能由Ⅰ型神经干细胞转化而来[18]。
0型神经干细胞经过一次分裂,产生1个自我更新的神经干细胞和1个神经元(图1B)。0型神经干细胞可由Ⅰ型神经干细胞转化而来,也能由神经上皮细胞转化而来,是一类广泛存在的细胞类型。例如:胸部的腹神经索干细胞表达时序转录因子Cas(Castor)、Grh(grainy head)以及Hox蛋白Atpn(Antennapedia),它们可共同激活Dacapo蛋白的表达,从而抑制周期蛋白Cyc E和E2f的活性,使Ⅰ型神经干细胞转变为0型神经干细胞[19]。腹部的腹神经索干细胞NB7-3可分裂3次,在第3次分裂时Ⅰ型神经干细胞转变为0型神经干细胞,产生的GMC不经过分裂而是直接分化为神经元,随后神经干细胞凋亡[20]。在视叶外部增殖中心的尾端(tOPC),神经上皮细胞首先转化为0型神经干细胞,分裂一次后又转变成Ⅰ型神经干细胞[21]。
3、 参与神经干细胞不对称分裂的关键蛋白质
尽管神经干细胞有几种不同类型,但是参与不对称分裂的关键蛋白质是保守的[22]。神经干细胞不对称分裂的过程主要受顶端蛋白复合体、细胞命运决定因子和细胞周期因子的调节(表1)。
神经干细胞分裂时具有不对称性,其主要表现为子细胞大小不对称、纺锤体不对称、细胞命运决定因子在子细胞中的分布不对称,而这些都与顶端蛋白复合体息息相关。顶端蛋白复合体包括Bazooka/aPKC(atypical protein kinase C)/Par6复合体和Gαi/Pins/Mud复合体,它们之间通过Insc(In-scuteable)蛋白相连[23]。在有丝分裂间期,Bazooka/aPKC/Par6复合体在中心体附近聚集,形成神经干细胞的顶端,建立神经干细胞极性,使得神经干细胞在分裂时产生两个大小不对称的子细胞[24]。Gαi/Pins/Mud复合体中的Mud蛋白可与星体微管相连,被Bazooka/aPKC/Par6复合体中aPKC磷酸化的Dlg(discs large)可与微管连接蛋白结合,故这两个复合体都能调控纺锤体的方向,使得神经干细胞在分裂时产生不对称的纺锤体[25]。此外,aPKC还能够直接磷酸化Numb、Miranda等细胞命运决定因子[26],造成神经干细胞在分裂时出现细胞命运决定因子在子细胞中的分布不对称[27,28]。
图1 果蝇神经干细胞的分类和分布
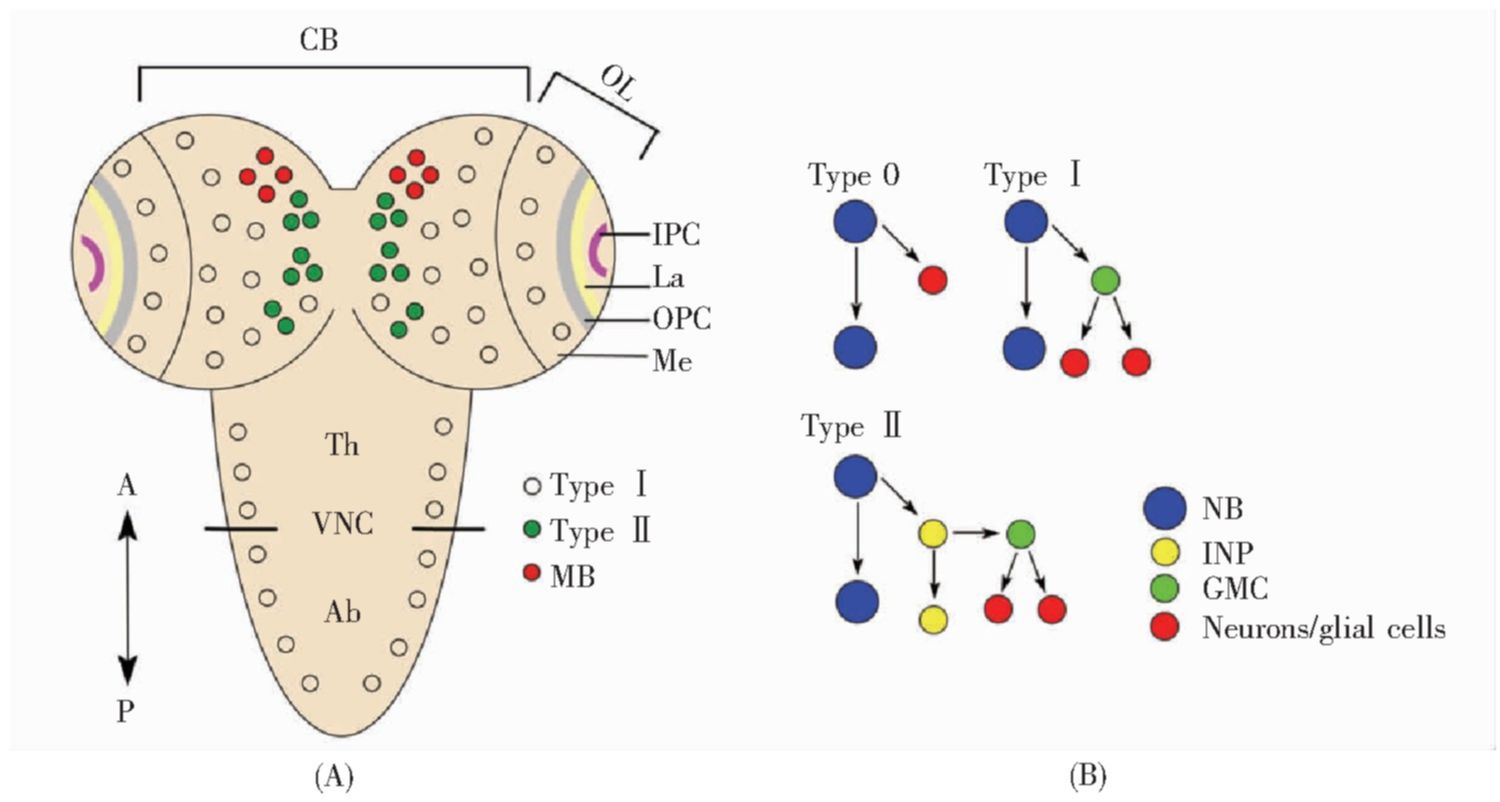
Fig.1 Types and distributions of neuroblasts in Drosophilia
(A)果蝇三龄幼虫中枢神经系统背面观。Ⅰ型NB分布于腹神经索、中脑和脑髓神经节区域,其中包括位于中脑的8个蘑菇体神经干细胞(红色);Ⅱ型NB位于中脑,共16个(绿色);(B)果蝇中枢神经系统的神经干细胞按照增殖方式可分为0型、Ⅰ型、Ⅱ型。0型NB不对称分裂产生1个自我更新的干细胞和1个神经元;Ⅰ型NB不对称分裂产生1个自我更新的干细胞和1个GMC,GMC分裂一次产生两个神经元或胶质细胞;Ⅱ型NB不对称分裂产生1个自我更新的干细胞和1个INP,INP不对称分裂产生1个新的INP和1个GMC,GMC分裂一次产生两个神经元或胶质细胞。CB:中脑;OL:视叶;OPC:外部增殖中心;IPC:内部增殖中心;VNC:腹神经索;La:神经板;Me:脑髓神经节;Th:胸部;Ab:腹部;A:前面;P:后面;NB:神经干细胞(也称为成神经细胞);INP:中间神经前体细胞;GMC:神经节母细胞;MB:蘑菇体神经干细胞。
(A)Dorsal view of the CNS of Drosophila third instar larvae.TypeⅠNBs are distributed in the VNC,CB and Me regions,including eight mushroom body NBs(red circles)in the central brain;sixteen typeⅡNBs(green circles)also reside in the central brain;(B)Neuroblasts(NBs)of the CNS can be divided into type 0,typeⅠand typeⅡaccording to their proliferation modes.Type0 NBs divide asymmetrically to produce a self-renewing NB and a neuron.TypeⅠNBs divide asymmetrically to produce a self-renewing NB and a GMC,and then the GMC divides once to produce two neurons or glial cells.TypeⅡNBs divide asymmetrically to produce a self-renewing NB and an INP,and then the INP divides asymmetrically to produce another INP and a GMC,which subsequently divides once to produce two neurons or glial cells.CB:Central brain;OL:Optic lobe;OPC:Outer proliferation center;IPC:Inner proliferation center;VNC:Ventral nerve cord;La:Lamina;Me:Medulla;Th:Thorax;Ab:Abdomen;A:Anterior;P:Posterior;NB:Neuroblast;INP:Intermediate neural progenitor;GMC:Ganglion mother cell;MB:Mushroom body neuroblast.
细胞命运决定因子Prospero和Brat(brain tu mor)都与Miranda结合,而Numb蛋白与Pon(partner of Numb)结合。Prospero是一种转录因子,在不对称分裂后随着Miranda的降解被释放进入细胞核,抑制细胞周期蛋白cyclin A、cyclin E和Cdc25的表达,激活分化基因fasciclinⅡ和netrin B的表达[29]。Brat是一个含有NHL结构域的翻译调节子,能在转录后水平抑制Myc和核糖体蛋白质的生物合成,促进分化。Numb含有PTB结构域,在神经节母细胞中抑制Notch的活性,抑制细胞增殖,促进分化[14]。由此可知,这些细胞命运决定因子都具有促进细胞分化的作用,它们的正确定位对神经干细胞不对称分裂具有重要作用。
细胞周期调控因子Cdc2/Cdk1、Aurora A、Polo激酶、APC/C复合体以及cyclin E也可调节不对称分裂[30]。Cdc2与周期蛋白结合成有活性的Cdk1蛋白激酶,促进有丝分裂的进行。果蝇神经干细胞NB4-2第一次分裂会产生1个GMC4-2a细胞,该细胞不对称分裂产生两种不同类型的子细胞,而在Cdc2E51Q突变体中,GMC4-2a对称分裂产生同一种神经元,这一结果证明Cdc2对神经干细胞不对称分裂具有调控作用[31]。Aurora A和Polo都是高度保守的丝氨酸/苏氨酸蛋白激酶,与中心体的成熟有关。这两种激酶一旦在神经干细胞中缺失,Numb的定位就会被打乱,从而使神经干细胞分裂为两个能自我更新的子细胞[32,33]。后期促进复合物/细胞周期体(anaphase-promoting complex/cyclosome,APC/C)是一种泛素连接酶,至少包含11个亚基,参与调节多种细胞周期因子的泛素化。在APC/C的突变体中,Miranda堆积在中心体周围区域,导致Prospero、Brat定位错误,影响细胞不对称分裂[34]。Cyclin E是细胞从G1期进入S期必需的周期蛋白,在cyclin E突变体中,Prospero定位被打乱,细胞由不对称分裂转变成对称分裂[35]。
此外,还有其他因子调节果蝇神经干细胞的不对称分裂。例如:kinesin heavy chain(Khc-73)定位于星体微管正极,其通过Dlg与顶端极性复合物相连,参与细胞不对称分裂[36];在myosinⅡ(Zipper)和Ⅵ(Jaguar)突变体中,Miranda定位紊乱,细胞命运决定因子定位出现异常[30]。
4 、神经元多样性产生的机制
为了满足中枢神经系统功能的复杂性,神经干细胞必须分化产生多种不同类型的子代细胞。研究发现有3种机制可产生神经元的多样性,即空间位置、时序转录因子(temporal transcription factors,TTFs)表达和神经节母细胞不对称分裂。
不同的空间位置有不同类型的神经干细胞。在早期胚胎发育中,体节极性基因(segment-polarity genes)的表达建立前后体轴,柱状基因(columnar genes)的表达建立背腹体轴,前后体轴和背腹体轴垂直相交建立一个迪卡尔式的分子坐标图。每个体节的神经外胚层细胞在这个坐标图中都有自己独特的坐标,表达不同的基因组合,形成特异的神经干细胞,从而产生不同类型的神经元。
时序转录因子表达增加了神经元产生的多样性。在胚胎期,Ⅰ型神经干细胞有序表达Hb(Hunchback)→Kr(Krüppel)→Pdm(Pdm1/Pdm2)→Cas 4种转录因子[22]。这些时序转录因子会保留到子代细胞中,产生不同类型的神经元。体内实验表明,Hb→Kr→Pdm→Cas转录因子有序表达是通过细胞内部正反馈和负反馈两种机制共同作用完成的,Hb会诱导Kr的表达,而Kr在诱导Pdm表达的同时会抑制Hb的表达,同样,Pdm诱导Cas表达的同时抑制Kr的表达[37]。除了这4种时序转录因子外,Svp(seven up)也参与了神经元多样性的产生。Svp在Hb+神经干细胞中表达,参与关闭Hb的表达并促进Kr的表达[38]。在胚胎期,Ⅱ型神经干细胞不表达Hb和Kr,Pdm在早期形成的Ⅱ型神经干细胞中短暂表达,Cas和Grh在所有的Ⅱ型神经干细胞中表达。此外,胚胎期Ⅱ型神经干细胞产生的子细胞INP表达的时序转录因子与Ⅱ型神经干细胞完全不同,其表达顺序为D(Dichaete)→Grh→Ey(Eyeless)[18,39]。在幼虫期,不同区域的神经干细胞也会表达不同的时序转录因子。OPC的神经干细胞有序表达Hth(Homothorax)→Klu(Klumpfuss)→Ey→Slp1 and Slp2(sloppy paired 1 and 2)→D→Tll(Tailless),而OPC尾部(tOPC)神经干细胞遵循Dll(Distalless)→Ey→Slp→D的顺序[21]。在幼虫期的中脑和腹神经索中,Ⅰ型神经干细胞表达Cas和Svp,Ⅱ型神经干细胞表达D→Cas→Svp[25],INP有序表达D→Grh→Ey。这些时序转录因子的存在,使神经干细胞产生了不同类型的子代细胞。
神经节母细胞不对称分裂可产生两种不同类型的子细胞[20,40]。在神经节母细胞分裂过程中,Numb不对称分裂到其中一个子细胞,该子细胞的Notch信号被抑制,成为Notchoff细胞,另外的子细胞中Notch处于激活状态,变成Notchon细胞。Notchon和Notchoff不仅可以决定子细胞的类型,也能决定子细胞的死亡与存活。例如:在果蝇触角叶前背部神经节母细胞分裂时,Notchon子细胞发生凋亡,Notchoff细胞发育为投射神经元;在果蝇触角叶腹部神经节母细胞分裂时,Notchon细胞发育为投射神经元,Notchoff子细胞发生凋亡[40]。
5、 神经干细胞的静息与激活
在果蝇胚胎期,神经干细胞的体积会随着分裂次数的增加逐渐减小。当细胞大小减小到4~5μm时,中脑和腹神经索中的大部分神经干细胞会进入静息状态。静息的神经干细胞在幼虫期被激活,重新进入细胞周期。
神经干细胞的静息不仅受到细胞大小的调控,也受到细胞内部因素的调控(表1)。Hox蛋白Antp和AbdA(abdominal-A)分别表达于胸部和腹部的腹神经索,研究报道在Antp和AbdA的突变体中,神经干细胞推迟进入静息,从而使其产生子细胞的数量增加[41]。在时序转录因子Pdm的突变体中,神经干细胞静息提前,而在Cas的突变体中神经干细胞静息推迟。果蝇神经干细胞的细胞核中缺失Prospero会促进神经干细胞的自我更新,过表达Prospero会促进神经干细胞的终末分化[42]。此外,细胞核中Prospero的低水平表达还与静息相关,在Pdm和Cas的突变体中,细胞核中出现低水平Prospero的时间分别提前和延迟;在幼虫期诱导细胞核Prospero低水平表达,大量神经干细胞会进入静息状态[42]。Nab、Squeeze蛋白是被Pdm负调控的下游因子,其突变会推迟神经干细胞的静息状态[41]。Trbl(Tribbles)是一类缺少激酶活性的假激酶,具有诱导和维持神经干细胞进入静息状态的作用。在G2期的神经干细胞中,Trbl能促进Cdc25(String)蛋白的降解,诱导神经干细胞进入静息状态。当神经干细胞进入静息后,Trbl还能抑制Akt的活性,维持静息状态[43]。
在幼虫期,静息神经干细胞的激活需要一个细胞生长的过程,该过程主要依赖于InR(insulinlike receptor)/PI3K/TOR(target of rapamycin)信号通路[44]。幼虫摄入食物后,足量的氨基酸信号被脂肪体细胞膜上的阳离子转运蛋白SLIF(Slinfast9)感知,激活细胞内的TOR信号通路并产生脂肪体信号分子(fat body derived signal,FDS),分泌的FDS再激活胶质细胞中的PI3K/TOR通路,诱导胶质细胞释放类胰岛素多肽分子(insulin-like peptides,ILPs),ILPs与神经干细胞上的受体InR结合,激活神经干细胞中的InR/PI3K/TOR信号通路,促进神经干细胞生长。Chro(Chromator)是一种纺锤体基质蛋白质,对中脑的神经干细胞激活是必需的,在Chro的突变体中,神经干细胞无法退出静息[45]。遗传互作分析表明Chro在Insulin/PI3K信号通路下游起作用,Chro可促进Grh的表达并抑制Prospero在细胞核中的表达,降低静息的神经干细胞中Prospero的含量,导致细胞核中Prospero蛋白缺失,从而促进神经干细胞激活和增殖[45]。此外,SHW(Salvador/Hippo/Warts)信号通路对神经干细胞的静息和生长也具有调节作用,敲低Hippo或Warts的活性,中脑神经干细胞提早生长,退出静息状态[46]。其具体作用机制如下:Hippo激酶可激活Warts激酶的活性,一旦Hippo或Warts激酶失活,Yorkie蛋白就不会被磷酸化,未被磷酸化的Yorkie可进入细胞核并调控转录因子如Scalloped的表达,促进中脑神经干细胞生长与增殖。Crumb和Echinoid蛋白是SHW信号通路的上游调节因子,它们失活也会导致SHW信号通路受阻,从而促进中脑神经干细胞生长与增殖[46]。
6、 神经干细胞的凋亡与终末分化
在果蝇成虫形成前,大脑的神经干细胞会有一个大规模消除的过程[47]。
腹部的腹神经索神经干细胞存在两次凋亡。第一次凋亡发生在胚胎15/16期,每半个体节中的30个神经干细胞有27个凋亡。神经干细胞的Notch受体被相邻的子细胞产生的Delta激活,促使AbdA在腹部神经干细胞高水平表达[48],足量的AbdA激活细胞凋亡基因reaper和grim之间的enh1(enhancer 1),使促凋亡基因RGH(reaper/grim/hid)表达上调,从而促进神经干细胞的凋亡。第二次凋亡发生在中三龄幼虫期,每半个体节剩余的3个神经干细胞凋亡。此时的凋亡仍受到AbdA调控,但单独表达AbdA并不使神经干细胞凋亡,只有满足D-Grh+Cas-AbdA+的组合条件,才能启动凋亡[49](表1)。
蘑菇体神经干细胞在化蛹96 h后才全部消失,该类细胞的消除不仅仅依靠细胞凋亡的方式,还依靠细胞自噬,两种机制协调运行,最终确保蘑菇体神经干细胞被消除[50]。在化蛹90 h后,蘑菇体神经干细胞的caspase被激活,DNA断裂,推测蘑菇体神经干细胞的消失依赖于caspase的凋亡形式。促凋亡基因RHG可调控caspase蛋白的表达,当RHG失活,依赖于caspase的细胞凋亡会受到抑制。在缺失RHG的果蝇突变体中,蘑菇体神经干细胞还能在成虫果蝇中存活并分裂,这一观察结果支持蘑菇体干细胞可通过凋亡的方式被消除。另外,在蛹期,蘑菇体神经干细胞中的Insulin/PI3K信号下调,下游蛋白Foxo进入细胞核,引起蘑菇体神经干细胞自噬。新近的研究表明转录因子E93能下调Insulin/PI3K信号,以激活细胞自噬的方式消除蘑菇体神经干细胞[51]。
中脑和胸部腹神经索的大部分Ⅰ型、Ⅱ型神经干细胞以及INP,在化蛹后20 h会停止分裂,开始终末分化。Prospero在细胞核内聚集能诱导神经干细胞终末分化,其过程受到时序因子的调控。在一龄幼虫向二龄幼虫转变的时期,Cas在神经干细胞中表达,激活Hh(Hedgehog)信号,Hh会随着时间的进程逐步升高,以致在蛹期Hh抑制Grh的表达,促进Prospero入核,促使终末分化[52]。RanGAP是RanGTPase的激活蛋白,能调控Prospero的核质运输。一旦RanGAP缺失,Prospero就会滞留在神经干细胞核内,使神经干细胞终末分化提前,产生的子细胞数目减少[53]。另外,蜕皮激素(ecdysone)和Mediator复合体也可调控神经干细胞的终末分化。Mediator复合体与蜕皮激素受体EcR结合,在蜕皮激素的激活下,中脑神经干细胞氧化磷酸化的水平上调,耗氧速率增加,细胞生长被抑制,导致中脑神经干细胞终末分化,退出细胞周期[54]。
表1 果蝇神经干细胞分裂与分化的调控因子
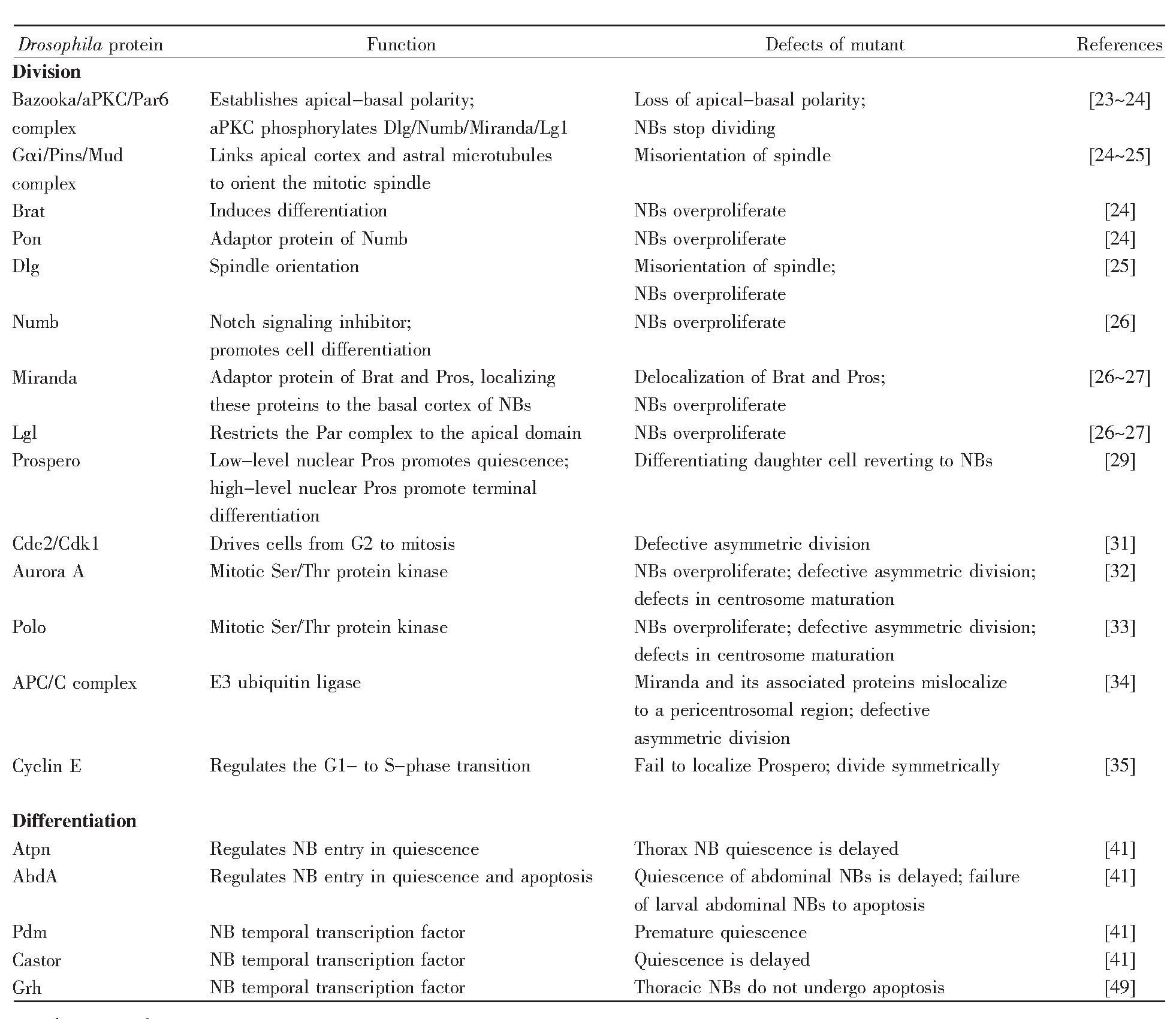
注:表格改编自文献[24]。
Note:The table is adapted from the reference[24].
视叶神经干细胞的消除机制目前还不太清楚。相关研究报道,OPC的Tll+神经干细胞中会聚集Prospero,这可能是OPC神经干细胞消除的原因[55]。
7、 展望
在过去十多年中,果蝇作为一种经典的模式生物,在神经干细胞生物学研究方面取得重要进展。从细胞水平上看,科学家们发现了3种不同分裂方式的神经干细胞,这3种神经干细胞在哺乳动物中均存在。其中,果蝇中新发现的Ⅱ型神经干细胞通过分裂大大增加了神经细胞的数量,这一分裂方式与哺乳动物大脑基底放射胶质细胞(basal radial glia,bRG)扩增神经元的方式相似。从分子水平上看,科学家们已经发现了一些可调控神经干细胞不对称分裂、神经元多样性、神经干细胞静息与激活、凋亡与终末分化的信号通路与调控因子,而参与这些生命活动的许多因子都是高度保守的,这提示哺乳动物神经干细胞可能存在同样的调控机制。尽管神经干细胞生物学研究进展迅速,但还有一些问题尚未解决,比如:果蝇Ⅱ型神经干细胞是怎样产生的?神经干细胞是如何进入静息的,它们又怎样被激活?时序转录因子怎样调控神经干细胞的凋亡?这些方面的深入了解对神经再生和修复具有重大意义。
参考文献
[1] REIDLING J C, RELANO-GINES A, HOLLEY S M, et al. Human neural stem cell transplantation rescues functional deficits in R6/2 and Q140 Huntington’s disease mice[J]. Stem Cell Reports, 2018, 10(1):58-72.
[2] ZHANG Q, CHEN W, TAN S, et al. Stem cell for modeling and therapy of Parkinson’s disease[J]. Human Gene Therapy, 2017,28(1):85-89.
[3] YANG J, LI S, HE X B, et al. Induced pluripotent stem cells in Alzheimer’s disease:applications for disease modeling and cell-replacement therapy[J]. Molecular Neurodegeneration, 2016,11:39.
[4] HARTENSTEIN V, WODARZ A. Initial neurogenesis in Drosophila[J]. Wiley Interdisciplinary Reviews:Development Biology, 2013, 2(5):701-721.
[5] EGGER B, CHELL J M, BRAND A H. Insights into neural stem cell biology from flies[J]. Philosophical Transacitions of the Royal Society B:Biological Sciences, 2008, 363(1489):39-56.
[6] URBACH R, SCHNABEL R, TECHNAU G M. The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila[J]. Development, 2003, 130(16):3589-3606.
[7] KUNZ T, KRAFT K F, TECHNAU G M, et al. Origin of Drosophila mushroom body neuroblasts and generation of divergent embryonic lineages[J]. Development, 2012, 139(14):2510-2522.
[8] GREEN P, HARTENSTEIN A Y, HARTENSTEIN V. The embryonic development of the Drosophila visual system[J]. Cell and Tissue Research, 1993, 273(3):583-598.
[9] HAKES A E, OTSUKI L, BRAND A H. A newly discovered neural stem cell population is generated by the optic lobe neuroepithelium during embryogenesis in Drosophila melanogaster[J]. Development, 2018, 145(18):dev166207.
[10] YASUGI T, UMETSU D, MURAKAMI S, et al. Drosophila optic lobe neuroblasts triggered by a wave of proneural gene expression that is negatively regulated by JAK/STAT[J]. Development, 2008, 135(8):1471-1480.
[11] EGGER B, BOONE J Q, STEVENS N R, et al. Regulation of spindle orientation and neural stem cell fate in the Drosophila optic lobe[J]. Neural Development, 2007, 2:1.
[12] APITZ H, SALECKER I. A challenge of numbers and diversity:neurogenesis in the Drosophila optic lobe[J]. Journal of Neurogenetics, 2014, 28(3-4):233-249.
[13] APITZ H, SALECKER I. A region-specific neurogenesis mode requires migratory progenitors in the Drosophila visual system[J].Nature Neuroscience, 2015, 18(1):46-55.
[14] KANG K H, REICHERT H. Control of neural stem cell selfrenewal and differentiation in Drosophila[J]. Cell and Tissue Research, 2015, 359(1):33-45.
[15] BOONE J Q, DOE C Q. Identification of Drosophila typeⅡneuroblast lineages containing transit amplifying ganglion mother cells[J]. Developmental Neurobiology, 2008, 68(9):1185-1195.
[16] BOWMAN S K, ROLLAND V, BETSCHINGER J, et al. The tumor suppressors Brat and Numb regulate transit-amplifying neuroblast lineages in Drosophila[J]. Developmental Cell, 2008,14(4):535-546.
[17] BELLO B C, IZERGINA N, CAUSSINUS E, et al. Amplification of neural stem cell proliferation by intermediate progenitor cells in Drosophila brain development[J]. Neural Development,2008, 3:5.
[18] WALSH K T, DOE C Q. Drosophila embryonic typeⅡneuroblasts:origin, temporal patterning, and contribution to the adult central complex[J]. Development, 2017, 144(24):4552-4562.
[19] BAUMGARDT M, KARLSSON D, SALMANI B Y, et al. Global programmed switch in neural daughter cell proliferation mode triggered by a temporal gene cascade[J]. Developmental Cell,2014, 30(2):192-208.
[20] KARCAVICH R, DOE C Q. Drosophila neuroblast 7-3 cell lineage:a model system for studying programmed cell death,Notch/Numb signaling, and sequential specification of ganglion mother cell identity[J]. Journal of Comparative Neurology, 2005,481(3):240-251
[21] BERTET C, LI X, ERCLIK T, et al. Temporal patterning of neuroblasts controls Notch-mediated cell survival through regulation of Hid or Reaper[J]. Cell, 2014, 158(5):1173-1186.
[22] YASUGI T, NISHIMURA T. Temporal regulation of the generation of neuronal diversity in Drosophila[J]. Development Growth and Differentiation, 2016, 58(1):73-87.
[23] KELSOM C, LU W. Uncovering the link between malfunctions in Drosophila neuroblast asymmetric cell division and tumorigenesis[J]. Cell&Bioscience, 2012, 2:38.
[24] HOMEM C C, KNOBLICH J A. Drosophila neuroblasts:a model for stem cell biology[J]. Development, 2012, 139(23):4297-4310.
[25] GOLUB O, WEE B, NEWMAN R A, et al. Activation of Discs large by aPKC aligns the mitotic spindle to the polarity axis during asymmetric cell division[J]. eLife, 2017, 6:e32137.
[26] HONG Y. aPKC:the kinase that phosphorylates cell polarity[J].F1000Research, 2018, 7:903.
[27] ATWOOD S X, PREHODA K E. Phosphorylation-mediated cortical displacement of fate determinants by aPKC during neuroblast asymmetric cell division[J]. Current Biology, 2009, 19(9):723-729.
[28] SMITH C A, LAU K M, RAHMANI Z, et al. aPKC-mediated phosphorylation regulates asymmetric membrane localization of the cell fate determinant Numb[J]. The EMBO Journal, 2007, 26(2):468-480.
[29] CHOKSI S P, SOUTHALL T D, BOSSING T, et al. Prospero acts as a binary switch between self-renewal and differentiation in Drosophila neural stem cells[J]. Developmental Cell, 2006,11(6):775-789.
[30] CHIA W, SOMERS W G, WANG H. Drosophila neuroblast asymmetric divisions:cell cycle regulators, asymmetric protein localization, and tumorigenesis[J]. Journal of Cell Biology, 2008,180(2):267-272.
[31] TIO M, UDOLPH G, YANG X, et al. cdc2 links the Drosophila cell cycle and asymmetric division machineries[J]. Nature,2001, 409(6823):1063-1067
[32] LEE C Y, ANDERSEN R O, CABERNARD C, et al. Drosophila Aurora-A kinase inhibits neuroblast self-renewal by regulating aPKC/Numb cortical polaity and spindle orientation[J].Genes and Development, 2006, 20(24):3464-3474.
[33] WANG H, OUYANG Y, SOMERS W G, et al. Polo inhibits progenitor self-renewal and regulates Numb asymmetry by phosphorylating Pon[J]. Nature, 2007, 449(7158):96-100.
[34] SLACK C, OVERTON P M, TUXWORTH R I, et al. Asymmetric localisation of Miranda and its cargo proteins during neuroblast division requires the anaphase-promoting complex/cyclosome[J]. Development, 2007, 134(21):3781-3787.
[35] BERGER C, KANNAN R, MYNENI S, et al. Cell cycle independent role of cyclin E during neural cell fate specification in Drosophila is mediated by its regulation of Prospero function[J]. Developmental Biology, 2010, 337(2):415-424.
[36] SIEGRIST S E, DOE C Q. Microtubule-induced Pins/Galphai cortical polarity in Drosophila neuroblasts[J]. Cell, 2005, 123(7):1323-1335.
[37] GROSSKORTENHAUS R, PEARSON B J, MARUSICH A, et al.Regulation of temporal identity transitions in Drosophila neuroblasts[J]. Developmental Cell, 2005, 8(2):193-202.
[38] KANAI M I, OKABE M, HIROMI Y. Seven-up controls switching of transcription factors that specify temporal identities of Drosophila neuroblasts[J]. Developmental Cell, 2005, 8(2):203-213.
[39] ALVAREZ J A, DIAZ-BENJUMEA F J. Origin and specification of typeⅡneuroblasts in the Drosophila embryo[J]. Development, 2018, 145(7):dev158394.
[40] LIN S, LEE T. Generating neuronal diversity in the Drosophila central nervous system[J]. Developmental Dynamics, 2012, 241(1):57-68.
[41] TSUJI T, HASEGAWA E, ISSHIKI T. Neuroblast entry into quiescence is regulated intrinsically by the combined action of spatial Hox proteins and temporal identity factors[J]. Development, 2008, 135(23):3859-3869.
[42] LAI S L, DOE C Q. Transient nuclear Prospero induces neural progenitor quiescence[J]. eLife, 2014, 3:e03363.
[43] OTSUKI L, BRAND A H. Cell cycle heterogeneity directs the timing of neural stem cell activation from quiescence[J]. Science,2018, 360(6384):99-102.
[44] SOUSA-NUNES R, YEE L L, GOULD A P. Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila[J]. Nature, 2011, 471(7339):508-512.
[45] LI S, KOE C T, TAY S T, et al. An intrinsic mechanism controls reactivation of neural stem cells by spindle matrix proteins[J]. Nature Communications, 2017, 8:122.
[46] DING R, WEYNANS K, BOSSING T, et al. The Hippo signalling pathway maintains quiescence in Drosophila neural stem cells[J]. Nature Communications, 2016, 7:10510.
[47] HARDING K, WHITE K. Drosophila as a model for developmental biology:stem cell-fate decisions in the developing nervous system[J]. Journal of Developmental Biology, 2018, 6(4):2-22.
[48] ARYA R, SARKISSIAN T, TAN Y, et al. Neural stem cell progeny regulate stem cell death in a Notch and Hox dependent manner[J]. Cell Death and Differentiation, 2015, 22(8):1378-1387.
[49] MAURANGE C, CHENG L, GOULD A P. Temporal transcription factors and their targets schedule the end of neural proliferation in Drosophila[J]. Cell, 2008, 133(5):891-902.
[50] SIEGRIST S E, HAQUE N S, CHEN C H, et al. Inactivation of both Foxo and reaper promotes long-term adult neurogenesis in Drosophila[J]. Current Biology, 2010, 20(7):643-648.
[51] PAHL M C, DOYLE S E, SIEGRIST S E. E93 integrates neuroblast intrinsic state with developmental time to terminate MB neurogenesis via autophagy[J]. Current Biology, 2019, 29(5):750-762.
[52] CHAI P C, LIU Z, CHIA W, et al. Hedgehog signaling acts with the temporal cascade to promote neuroblast cell cycle exit[J].PLoS Biology, 2013, 11(2):e1001494.
[53] WU D, WU L, AN H, et al. RanGAP-mediated nucleocytoplasmic transport of Prospero regulates neural stem cell lifespan in Drosophila larval central brain[J]. Aging Cell, 2019, 18(1):e12854.
[54] HOMEM C C F, STEINMANN V, BURKARD T R, et al. Ecdysone and mediator change energy metabolism to terminate proliferation in Drosophila neural stem cells[J]. Cell, 2014, 158(4):874-888.
[55] LI X, ERCLIK T, BERTET C, et al. Temporal patterning of Drosophila medulla neuroblasts controls neural fates[J]. Nature,2013, 498(7455):456-462.
1992年Reynolds等[1]首次从成年鼠的纹状体和海马中分离出能够自我更新的多潜能细胞群落,首此提出神经干细胞(Neuralstemcells,NSCs)的概念。由于神经干细胞具备自我更新能力和多分化潜能的生物学特性,为中枢神经系统疾病的治愈带来了新的希望。随着神经...
自噬(autophagy)作为细胞内物质代谢的重要方式,是亚细胞膜内的结构发生动态变化,也是溶酶体介导细胞内蛋白质和细胞器降解的正常新陈代谢过程。细胞死亡包括坏死、凋亡和自噬三种形式。在细胞平衡合成和分解代谢过程中,通过自噬保持细胞内环境的稳定,...
位于肠道的肠神经系统(entericneuralsys-tem,ENS)是独立于交感、副交感神经的外周自主神经系统。国外研究[1]发现肠道也存在神经干细胞,即肠神经干细胞(entericneuralstemcells,ENSCs)。在国内,本课题组率先成功提...
神经干细胞是存在于神经系统内的一群具有多向分化潜能和自我更新能力的细胞,可以分化形成神经元、星形胶质细胞和少突胶质细胞[1,2].近年来,神经干细胞的研究成为神经科学领域的热点之一。神经干细胞移植被认为是治疗神经系统损伤后修复和其他神经系统疾病...
1992年,Reynolds等[1]从成年小鼠脑纹状体中分离出了能够在体外不断进行分裂增殖并且具有多种分化潜能的一类细胞群,神经干细胞(Neuralstemcells,NSCs)的概念由此被正式提出。近年来,羊驼毛囊干细胞分离、培养与鉴定方面的研究已见报道[2].本试验从...
今后研究的重点是进一步优化神经干细胞旁分泌的神经保护作用, 包括使用缺氧或辐射等理化手段刺激产生数量更多的旁分泌产物以及使用基因转染技术产生更多具有治疗潜力的因子或mRNA、miRNA等。神经干细胞的旁观者效应是神经损伤修复的重要机制, 其旁分泌产物对...