
肿瘤干细胞(cancer stem cells,CSCs)是肿瘤组织中具有自我更新、多向分化及较强增殖能力的少量干细胞样癌细胞亚群,是肿瘤起源、生长、转移与复发的根源所在。近年来,寻找靶向杀死肿瘤干细胞的抗癌策略已成为研究的热点。其中,选择何种细胞表面标志物来证实舌癌中肿瘤干细胞的存在并完成对肿瘤干细胞的提取和鉴别是首要亟待解决的问题。研究发现p75神经营养蛋白受体(p75 neu-rotrophin receptor,p75NTR)的表达与多种肿瘤的发生和发展相关,并已证实其在全身多种肿瘤中可以作为一种肿瘤干细胞的表面标志物。本实验采用p75NTR对舌鳞状细胞癌细胞系Tca-8113及Cal-27进行标记、检测、分选,并对分选后的p75NTR阳性细胞进行生物学特性研究,探讨p75NTR作为肿瘤干细胞标志物和预测口腔鳞状细胞癌愈后指标的可能性,为深入研究舌鳞状细胞癌的发病机理和寻找新的治疗靶点提供线索。
1、 材料和方法
1.1 材料
Tca-8113、Cal-27细胞株来源于口腔舌鳞状细胞癌,由上海交通大学附属第九人民医院口腔颌面外科肿瘤生物实验室惠赠。Tca-8113细胞株用含10%FBS(杭州四季青生物工程材料研究所)的RPMI1640培养液培养。Cal-27细胞株用含10%FBS(GIBCO公司,美国)的高糖DMEM培养液培养。
PE标记的鼠抗人p75NTR抗体及PE标记的小鼠骨髓瘤蛋白IgG1,κ抗体均购自美国BD公司。
1.2 流式细胞仪检测p75NTR阳性细胞的表达。将生长状况良好并处于对数生长期的Tca-8113细胞制备成单细胞悬液,并且调整细胞密度为1.0×106个·mL-1。实验分为2组,实验组加入100 μL PE标记小鼠抗人p75NTR抗体,对照组加入等量的PE标记小鼠骨髓瘤蛋白IgG1,κ。放入冰里置于震荡箱中蔽光孵育半小时,1 000 r·min-1离心5 min,吸弃上清后Buffer I l mL冲洗吹打(反复冲洗、离心2次),重悬于400 μL PBS中。将加入等量PE标记小鼠骨髓瘤蛋白IgG1,κ的对照组先上机调节机器参数,然后取实验组上机检测细胞荧光值,分析p75NTR阳性细胞的百分含量,重复3次取平均值。同法处理Cal-27细胞。
1.3 p75NTR阳性细胞生物学特性检测1.3.1 以p75NTR为标记分选阳性细胞作为实验组 将生长状况良好并处于对数生长期的较大数量的2种舌鳞状细胞癌细胞(约1.0×108个·mL-1)如上法处理后上机进行高速分选,获得p75NTR阳性细胞,作为实验组。为了保证分选后富集的p75NTR阳性细胞的纯度,分选时选取强阳性区域。重复上机一次,以避免标记物丢失造成的阳性率偏低。并取适量分选后的细胞上机检测p75NTR阳性细胞的纯度。
1.3.2 对照组处理 将同等条件培养的2种舌鳞状细胞癌细胞系细胞制备成单细胞悬液,加入PE标记小鼠抗人p75NTR抗体,放入冰里置于震荡箱中蔽光孵育半小时,再放入离心机离心5 min(1 000 r·min-1),弃上清后Buffer I l mL冲洗吹打(反复冲洗、离心2次),作为对照组备用。
1.3.3 单克隆培养 取对数生长期的2组细胞于超净台中常规消化制成单细胞悬液后,用有限稀释法接种于96孔板中。5%CO2、37 ℃饱和温度环境培养观察细胞贴壁情况,记录仅有一个细胞的孔,并做标记。2周后统计单克隆形成率。收集p75NTR阳性细胞形成的单克隆细胞,培养于培养瓶中,再培养2周后进行p75NTR的流式细胞检测。
1.3.4 四甲基偶氮唑盐比色法[(3-(4,5)-demethylthiazo(z-y1)-3,5-diphenytetrazoliumromide,MTT]实验 收集2组细胞,分别接种于96孔细胞培养板中(每孔约4×103个细胞)(周边空不加),再各加入200 μL培养液(周边空不加,B3孔只加入PBS作为对照)。
培养24 h后,换液,B3孔换200 μL PBS。每孔加入20 μL MTT溶液,培养4 h后吸出上清液,加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),置于摇床上低速震荡10 min。以B3孔为调零孔,上酶联免疫检测仪,以490 nm吸光度值量化活细胞数,每次检测一竖列的6个平行孔,每组所得数据取平均值,连续检测7 d。以生长时间为横坐标,以光密度(op-tical density,OD)值为纵坐标,绘制细胞的生长曲线。
1.3.5 划痕实验 将2组细胞以每孔1×105个的密度接种于六孔板中,待细胞生长到80%~90%时,无菌条件下更换为无血清的培养基,继续培养12 h后,于超净台中用200 μL枪头在每个孔的中间划一条竖直的线,PBS冲洗3遍。每孔加入2 mL完全培养液,倒置显微镜下观察并拍照记录。之后每天换液,拍照,连续8 d。
1.4 统计学分析
采用SPSS 13.0软件进行统计学分析。各组间的比较采用χ2检验进行分析,P<0.05为差异有统计学意义。
2、 结果
2.1 流式细胞仪检测p75NTR
阳性细胞的表达舌鳞状细胞癌细胞株Tca-8113、Cal-27细胞中,p75NTR阳性细胞的比例分别为3.1%和1.9%。
2.2 流式细胞分选及纯度检测
分选后p75NTR阳性细胞的比例分别为98.1%(Tca-8113)和97.4%(Cal-27)。这表明目的细胞阳性率比较高。
2.3 单克隆培养
2组单克隆形成能力的比较见表1。从表1可见,只有小部分细胞能持续分裂增殖。实验组的单克隆形成能力高于对照组(Tca-8113细胞,P=0.024;Cal-27细胞,P=0.009)。这表明p75NTR阳性细胞具有自我更新和分化能力。单克隆细胞再培养2周后,Tca-8113的p75NTR阳性细胞率降为14.5%,Cal-27的p75NTR阳性细胞率降为5.8%。
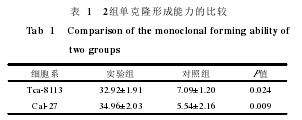
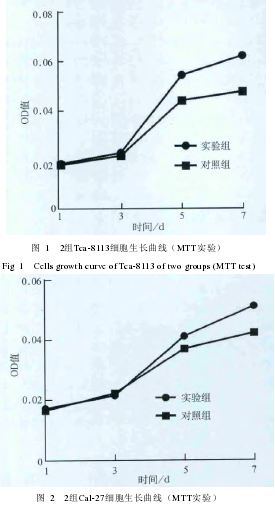
2.4 MTT实验
细胞生长曲线(图12)表明:2组细胞第1天生长情况无明显差异,从第3天之后实验组细胞较之对照组细胞体外增殖能力明显增强,第5天及第7天时更加显著(P<0.05)。
2.5 划痕实验
划痕后7 d,实验组较对照组具有明显的愈合能力(图34)。Tca-8113实验组到第8天已经基本被细胞长满,而对照组却仍有空白区域(图5),Cal-27实验组到第5天已经基本长满划痕区域,完全长满需要7 d(图6)。这说明实验组具有明显的侵袭迁移能力。

3、 讨论
肿瘤干细胞是肿瘤起源、生长、转移与复发的根源所在。近年来,通过对其生物学特性的研究,寻找靶向杀死肿瘤干细胞的抗癌策略成为研究的热点。p75NTR是一种神经营养因子的低亲和力受体,可通过不同的信号传导通路诱导细胞发生增殖、分化、迁移、凋亡等生物学行为。近年来,研究发现p75NTR的表达与胃癌、视网膜成神经细胞瘤、前列腺癌、胰腺癌、黑色素瘤等多种肿瘤的发生和发展相关,并已证实其在全身多种肿瘤中可作为一种肿瘤干细胞的表面标志物。本实验检测发现p75NTR在舌鳞状细胞癌细胞系Tca-8113及Cal-27中都有阳性表达,且其阳性率分别为3.1%和1.9%。这与以往报道中肿瘤干细胞数量相当。
肿瘤细胞的克隆形成能力与其致瘤能力呈正相关,并且只有肿瘤干细胞具有单克隆形成能力和强致瘤性。本研究单克隆培养实验发现两个细胞株的p75NTR阳性细胞的体外单克隆形成能力相对于未分选的细胞均显著增强,符合其是具有自我更新能力的肿瘤干细胞的理论。同时,本实验利用流式细胞仪检测发现单克隆4周后的p75NTR阳性细胞的p75NTR阳性率明显下降,其分化产生了大量p75NTR阴性细胞,该结果说明p75NTR阳性细胞具有较强的克隆形成能力并具有一定的分化潜能。

本研究用MTT法对舌鳞状细胞癌细胞株Tca-8113和Cal-27中的p75NTR阳性细胞及未分选细胞的体外增殖能力进行测定,发现p75NTR阳性细胞的生长速度明显快于未分选的细胞,这也表明p75NTR阳性细胞具有较强的增殖能力,符合其作为肿瘤干细胞的特性。侵袭转移是恶性肿瘤最重要的生物学行为,是导致手术、放疗、化疗失败和患者死亡的主要原因。划痕实验证明p75NTR阳性细胞具有更强的迁移能力。
由于2种细胞的生长速度差别较大,所以在划痕实验中没有做同期的横向比较。
综上,笔者认为p75NTR可作为舌鳞状细胞癌干细胞的一种表面标志物。由于本课题组前期实验发现p75NTR在正常舌组织中是阴性表达的,那么针对p75NTR这个新的靶点对肿瘤进行的治疗就不会对正常舌干细胞构成伤害。当然,针对临床应用还需要更深入的研究,但是相信随着研究的不断进展,其将有望为舌癌的临床预防和诊治开辟新的思路和策略。
参考文献:
[1] 郑家伟, 李金忠, 钟来平, 等. 口腔鳞状细胞癌临床流行病学研究现状[J]. 中国口腔颌面外科杂志, 2007, 5(2):83-91.
[2] Jin H, Pan Y, Zhao L, et al. p75 neurotrophin receptor sup-presses the proliferation of human gastric cancer cells[J].Neoplasia, 2007, 9(6):471-478.
[3] Dimaras H, Gallie BL. The p75NTRneurotrophin receptor isa tumor suppressor in human and murine retinoblastomadevelopment[J]. Int J Cancer, 2008, 122(9):2023-2029.
[4] Khwaja F, Tabassum A, Allen J, et al. The p75NTRtumor sup-pressor induces cell cycle arrest facilitating caspase mediatedapoptosis in prostate tumor cells[J]. Biochem Biophys ResCommun, 2006, 341(4):1184-1192.
[5] Dang C, Zhang Y, Ma Q, et al. Expression of nerve growthfactor receptors is correlated with progression and prognosisof human pancreatic cancer[J]. J Gastroenterol Hepatol, 2006,21(5):850-858.
[6] Marchetti D, Aucoin R, Blust J, et al. p75 neurotrophin re-ceptor functions as a survival receptor in brain-metastaticmelanoma cells[J]. J Cell Biochem, 2004, 91(1):206-215.
[7] Eramo A, Lotti F, Sette G, et al. Identification and expan-sion of the tumorigenic lung cancer stem cell population[J]. Cell Death Differ, 2008, 15(3):504-514.
[8] Collins AT, Berry PA, Hyde C, et al. Prospective identifica-tion of tumorigenic prostate cancer stem cells[J]. CancerRes, 2005, 65(23):10946-10951.
[9] Holyoake T, Jiang X, Eaves C, et al. Isolation of a highlyquiescent subpopulation of primitive leukemic cells in chro-nic myeloid leukemia[J]. Blood, 1999, 94(6):2056-2064.
[10] Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer,and cancer stem cells[J]. Nature, 2001, 414(6859):105-111.
[11] Derkinderen DJ, Boxma OJ, Koten JW, et al. Stochastictheory of oncogenesis[J]. Anticancer Res, 1990, 10(2B):497-504.
[12] 吴修胤, 佟冬冬, 张风河. P75神经营养因子受体在口腔鳞状细胞癌中的表达及意义[J]. 上海口腔医学, 2011, 20(4):405-408.
卵泡是卵巢内的基本功能单位,包含一个卵母细胞、颗粒细胞及膜细胞〔1〕。卵泡膜间质细胞(theca-interstitialcells,TIC)是卵巢中除卵泡外具有分泌雄激素功能的间质细胞,它在卵泡的生长发育、闭锁过程中发挥着多种重要作用〔2-4〕,同时作为卵巢微...
体外动物细胞培养已广泛应用于现代医学、生物学和分子遗传学等多个领域,是从事细胞水平及分子水平研究所采用的基本方法。在高原环境下心肌细胞的体外培养尚未见报道。本文拟通过心肌细胞系的体外培养,观察其生长和增殖状况,并通过绘制生长曲线,初步探讨...
利用昆虫细胞表达特殊蛋白复合体或具有细胞毒性蛋白时,常规表达调控方法并不适合。因此,需要在时间、空间和表达强度方面具有更灵活精确的基因表达调控方法。...
血管平滑肌细胞(vascularsmoothmusclecells,VSMC)对维持动脉壁结构和功能的完整性起到了重要作用。OPG作为肿瘤坏死因子受体超家族成员及细胞核因子-B受体活化因子配体的诱导受体,不仅参与了骨的代谢过程,也参与了血管壁的钙化。目前已经有大量研究证实O...
我们已报导了培养的哺乳动物细胞及其核在X线照射后电泳移动度(EPM)降低.EPM随着时间而降低,以照后4小时降低最为明显.小剂量照射,在照后保温24小时,有些细胞的EPM即恢复到正常.EPM的改变能完全被低浓度的疏基阻断剂、植物血凝素或刀豆素A所阻断.本研究应用...
一、引言近年研究表明,表皮与真皮的相互作用,特别是角质形成细胞(humankeratinocytes,HKC)与成纤维细胞(humanfibroblasts,HFB)的相互作用,在促进组织生长、维持组织内环境稳态、创伤愈合及瘢痕形成等方面具有极其重要的作用[1~4].随着研究的深入,人们...
内皮细胞衰老引起的内皮细胞功能减退是心脑血管疾病随年龄增加的主要因素之一[1-2].氧化应激是导致细胞衰老的主要原因之一。随着年龄的增加,内皮细胞活性氧(reactiveoxygenspecies,ROS)的产生增多、清除减少,导致其在内皮细胞内积聚,并最终导致内皮...
目前,国内外研究多集中于干细胞向神经细胞分化的研究,而对体细胞的研究相对较少。干细胞存在伦理学、免疫排斥以及潜在的致瘤性等问题限制了其在临床上的应用,而具有部分胚胎干细胞特性的人羊膜上皮细胞(humanamnioticepithelialcells,HAEC)不存在上述...
再生医学作为组织工程及分子生物学研究的一个分支,参与人细胞、组织或器官的重建、移植及替代过程,从而达到恢复或形成正常功能的效果。这个领域通过促进自体修复机制来功能性的修复并治愈难以恢复的器官及组织。再生医学也包括通过实验室中培养的组织及器...
间充质干细胞(mesenchymalstemcells,MSCs)来源于发育早期的中胚层和外胚层,属于多能干细胞,不仅有较强的增殖潜能,还能分化成不同来源的细胞,如神经细胞、脂肪细胞、成骨细胞、软骨细胞、肝细胞及胰岛样细胞等,可作为理想的种子细胞,用于衰老和病...