
目前,国内外研究多集中于干细胞向神经细胞分化的研究,而对体细胞的研究相对较少。干细胞存在伦理学、免疫排斥以及潜在的致瘤性等问题限制了其在临床上的应用,而具有部分胚胎干细胞特性的人羊膜上皮细胞(human amniotic epithelial cells,HAEC)不存在上述问题,从而为细胞治疗提供了新的选择。
HAEC是一种来源于人胎盘羊膜组织的上皮层体细胞。研究显示HAEC具有部分胚胎干细胞特性,即在体外培养下具有向3个胚层分化的潜能:内胚层(胰腺细胞、肝细胞)、中胚层(心肌细胞)和外胚层(神经细胞、肌细胞、心肌细胞,骨细胞,脂肪细胞,胰腺细胞,肝细胞)。细胞生活的微环境在分子水平决定了细胞的分化方向,因此在维甲酸诱导体外培养的HAEC向神经样细胞分化的过程中,选择最佳维甲酸干预浓度是决定成功与否的关键。本实验通过细胞形态学分析和检测细胞内巢蛋白(nestin)、微管相关蛋白2(MAP-2)、胶质纤维酸性蛋白(GFAP)和转录因子Oct-4表达,探讨维甲酸诱导HAEC在体外分化为神经样细胞的最适浓度,为HAEC在细胞移植中的应用奠定基础。
材料与方法
材料与试剂 羊膜标本由复旦大学附属中山医院妇产科提供,本研究经产妇本人签署知情同意书,并经中山医院伦理委员会同意。DMEM/F12、特级胎牛血清、PBS缓冲液、青霉素-链霉素双抗溶液、0.25%胰蛋白酶+0.02EDTA (GibcoLtd,美国)。Ⅱ型胶原酶、Dnase 酶(Sigma Ltd,美国)。鼠抗人vimentin 单克隆抗体(SR0746,EpitomicsInc,美国)。鼠抗人CK-19抗体(BM0033)、兔抗人Nestin多抗(BA1289)、鼠抗人MAP-2多抗(BM1243)、兔抗人GFAP多抗(BA0056)(武汉博士德生物工程有限公司,中国)。兔抗人Oct-4多抗(MAB4305) (Millipore Ltd,美国)。100、200、300、400筛网(上海瑞谷生物科技有限公司,中国)。
羊膜组织提取和处理HIV、梅毒、乙肝等血清学反应阴性的足月剖宫产后胎盘,胎盘娩出后,无菌条件下2~4 h将羊膜与绒毛膜分离,并将羊膜置于DMEM/F12 培养液内保存。羊膜上皮细胞的原代培养应在羊膜取得后6 h内进行。
原代HAECs 培养将5 cm×5 cm大小的羊膜置于含有双抗(100 U·mL-1青霉素、100 U·mL-1链霉素)的PBS 中反复冲洗 3次。然后放入不加血清的DMEM/F12培养基中漂洗3次。将漂冼后的羊膜用眼科剪剪成数小块;再将组织块反复剪成1 mm×1 mm大小。取10 mL羊膜组织悬液,按1∶4比例加入0.25%的Ⅱ型胶原酶,并置于37℃恒温振荡孵箱内消化2 h后,1 000 r·min-1离心5 min,吸出上清液(含胶原酶消化液)。再加入等体积0.25%胰蛋白酶-0.02%EDTA室温下消化15 min,用含10%胎牛血清的DMEM/F12培养基终止消化。1 000r·min-1离心5 min,去上清,用含10%胎牛血清的DMEM/F12培养基清洗后,将细胞悬液依次通过100、200、300、400 目筛网过滤,细胞计数,然后将细胞以 1 × 107个/mL 密度的 HAECs 悬液 2 mL 接种于 25 mL 培养瓶中,置5%CO2、37℃培养箱内培养。倒置显微镜动态观察细胞形态变化及生长增殖情况。3 d后首次换液,以后根据细胞生长情况,隔天换液,每次换液时去除非贴壁细胞。待3~4 d 后细胞融合长满时,用0.25% 胰蛋白酶消化,按1∶2 或1∶3 比例进行传代,倒置显微镜观察,待细胞铺满瓶底时,重复上述操作。
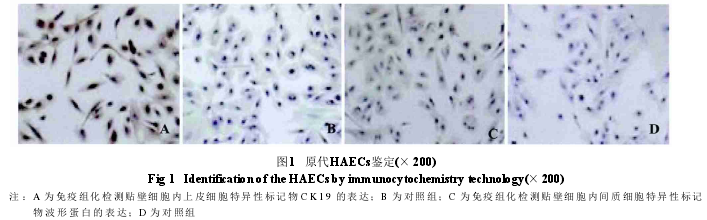
原代HAECs的鉴定取第3代HAECs制作细胞爬片。常温下将细胞爬片用PBS漂洗3 min,×3次;4%多聚甲醛固定10 min,PBS漂洗3 min,×3次;0.2%TritonX-100 破膜 20 min,PBS 漂洗 3 min,× 3 次;加入正常的山羊血清室温下封闭30 min,PBS漂洗3 min,×3次;加入鼠抗人CK19(1∶100)抗体和鼠抗人vimentin(1∶100)抗体,37℃孵育2 h,PBS漂洗3 min,×3次;加入辣根过氧化酶标记的二抗,37℃孵育30min,PBS洗3min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察并摄像。对照组用PBS代替一抗。
不同浓度维甲酸诱导HAECs向神经样细胞分化 消化收集第3 代HAECs 制成细胞爬片,待细胞生长至60%~70% 融合时(对照组用含 10% 胎牛血清的 DMEM/F12 培养基培养),各维甲酸组去除培养基,加入含不同浓度维甲酸的DMEM/F12诱导液(内含10%胎牛血清)。
实验分组 共分为5组:①对照组,含10%胎牛血清的DMEM/F12培养基处理,不含维甲酸;②1×10-8mol·L-1维甲酸组[含1×10-8mol·L-1维甲酸DMEM/F12培养基(含10%胎牛血清)];③1×10-7mol·L-1维甲酸组[含1 × 10-7mol·L-1维甲酸DMEM/F12培养基(含10%胎牛血清)];④1×10-6mol·L-1维甲酸组[含1×10-6mol·L-1维甲酸的DMEM/F12培养基(含10% 胎牛血清)];⑤1 ×10-5mol·L-1维甲酸组[含1×10-5mol·L-1维甲酸的DMEM/F12 培养基(含 10% 胎牛血清)]。每天换液,换液时去除非贴壁细胞,共诱导7 d。
不同浓度维甲酸诱导HAECs分化后Nestin免疫组化染色
取出细胞爬片。常温下,将细胞爬片PBS漂洗3 min,×3次;4%多聚甲醛固定10 min,PBS漂洗3 min,× 3 次;0.2%TritonX-100 破膜 20 min,PBS 漂洗3 min,×3 次;加入正常的山羊血清,室温下封闭30 min,PBS 漂洗 3 min,× 3 次;加入兔抗人 Nestin 抗体(1∶100),37℃孵育2 h,PBS 漂洗3 min,×3 次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS漂洗3 min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,Nestin标记的神经样阳性细胞呈棕褐色。
不同浓度维甲酸诱导HAECs分化后MAP-2免疫组化染色
取出细胞爬片。常温下,将细胞爬片PBS漂洗3 min,×3次;4%多聚甲醛固定10 min,PBS漂洗3 min,× 3 次;0.2%TritonX-100 破膜 20 min,PBS漂洗3 min,×3次;加入正常的山羊血清室温下封闭30 min,PBS 漂洗 3 min,× 3 次;加入兔抗人 MAP-2抗体(1∶100),37℃孵育2 h,PBS漂洗3 min,×3次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS漂洗3 min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,MAP-2标记的神经样阳性细胞呈棕褐色。
不同浓度维甲酸诱导HAECs分化后GFAP免疫组化染色
取出细胞爬片。常温下,将细胞爬片PBS漂洗3 min,× 3 次;4% 多聚甲醛固定 10 min,PBS 漂洗 3min,× 3 次;0.2%TritonX-100 破膜 20 min,PBS 漂洗3 min,×3次;加入正常的山羊血清室温下封闭30 min,PBS漂洗3 min,×3次;加入兔抗人GFAP抗体(1∶100),37℃孵育 2 h,PBS 漂洗 3 min,× 3 次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS漂洗3 min,×3 次;DAB 暗环境下显色;自来水冲洗,苏木精复染 2min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,GFAP标记的神经样阳性细胞呈棕褐色。
不同浓度维甲酸诱导HAECs分化过程中Oct-4免疫组化染色取出细胞爬片。常温下将细胞爬片PBS洗3min,×3次;4% 多聚甲醛固定10 min,PBS洗 3 min,×3 次;0.2%TritonX-100 破膜 20 min,PBS 洗 3 min,×3 次;加入正常的山羊血清室温下封闭 30 min,PBS 洗3 min,× 3 次;加入兔抗人 Oct-4 抗体(1∶100),37℃孵育2h,PBS洗3 min,×3 次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS 洗3 min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,Oct-4标记的神经样阳性细胞呈棕褐色。
图像分析 随机取10 个不同视野(×100),以每个视野内阳性细胞数为量化指标,每组视野阳性细胞数量作为该组HAECs 诱导分化为神经样阳性细胞密度代表值,以阳性细胞数/100倍视野表示。
统计学方法 采用SPSS17.0 统计软件进行统计学分析。各组计量资料以 ±s表示。各组间比较采用单因素方差分析,以α=0.05为检验水准,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
结 果
体外培养 HAECs 细胞的生长特性 倒置显微镜下观察细胞在贴壁前轮廓清晰、体积较小、圆形、透亮、折光性较强、富有立体感。接种2~3 d后贴壁,细胞逐渐变大,折光性降低,整个细胞轮廓变暗,完全伸展的细胞形态多样,呈梭形、多角形、眼睛样等,轮廓清晰,胞质丰富,胞核居中,可见1~2个核仁,呈圆形、卵圆形。
接种3 d后,人羊膜上皮细胞进入指数生长期,细胞数量明显增多,呈不规则多角形。接种5~7 d时90%细胞融合成片,形成单层放射状或漩涡状生长,开始进行传代。传代6 h 后即可贴壁,细胞3~4 d融合长满,形成单层放射状或漩涡状单层细胞。传至2~5代,细胞形态、大小、活性均匀一致。传至6代以后少数细胞形态发生变化,呈不规则形,细胞增殖减慢。传至第8代细胞胞质内出现空泡和黑色颗粒,细胞增殖能力减弱,逐渐停滞生长,凋亡并从瓶壁脱落。第3代细胞融合后数量恒定,符合实验要求,取第3代细胞作为实验对象。
体外培养细胞的来源鉴定 上皮细胞标记物CK19标记的贴壁细胞胞质内有大量棕褐色物质,胞核呈蓝紫色(图 1A);间质细胞标记物波形蛋白(vimentin)标记的贴壁细胞胞质内仅有少量棕褐色物质,胞核呈蓝紫色(图1C)。
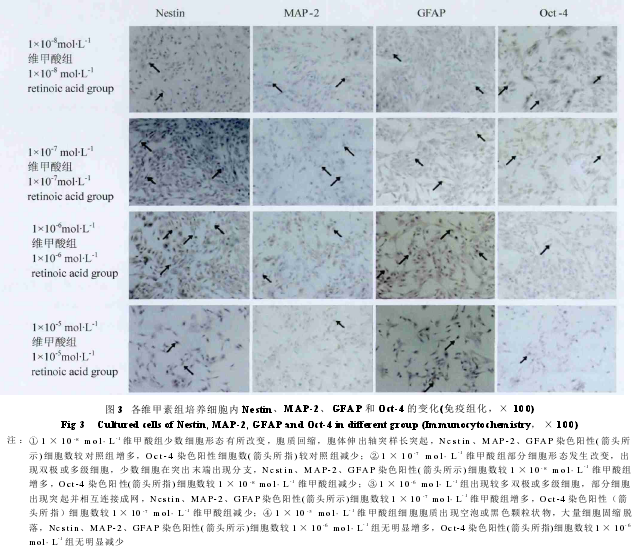
不同浓度维甲酸对HAECs分化作用的影响
1.不同浓度维甲酸组HAECs分化的形态学变化:对照组细胞形态未发生改变;1×10-8mol·L-1维甲酸组少数细胞形态有所改变,胞质回缩,胞体伸出轴突样长突起;1 × 10-7mol·L-1维甲酸组部分细胞形态发生改变,出现双极或多级细胞,少数细胞在突出末端出现分支;1×10-6mol·L-1维甲酸组出现较多双极或多级细胞,部分细胞出现突起并相互连接成网;1×10-5mol·L-1维甲酸组细胞胞质出现空泡或黑色颗粒状物,大量细胞固缩脱落。
2. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的Nestin 阳性细胞(图2,3)表达率:对照组为(12.12±0.37)%,1×10-8mol·L-1维甲酸组为(15.13±0.28)%,1 × 10-7mol·L-1维甲酸组为(17.56±1.15)%,1 ×10-6mol·L-1维甲酸组为(20.98±0.95)%,1×10-5mol·L-1维甲酸组为(19.20±3.12)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.15),其他组均差异有显著统计学意义(P<0.01)。
3. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的MAP-2 表达率(图2,3):对照组为(14.12 ±1.04)%,1× 10-8mol·L-1维甲酸组为(22.81±1.32)%,1×10-7mol·L-1维甲酸组为(24.21±1.65)%,1×10-6mol·L-1维甲酸组为(29.56 ±1.35)%,1×10-5mol·L-1维甲酸组为(24.34±3.85)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.23),其他组均差异有显著统计学意义(P<0.01)。
4. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的 GFAP 表达率(图2,3):对照组为(11.23 ±0.26)%,1 × 10-8mol·L-1维甲酸组为(13.21±0.60)%,1×10-7mol·L-1维甲酸组为(15.63±1.18)%,1×10-6mol·L-1维甲酸组为(22.69±1.62)%,1×10-5mol·L-1维甲酸组为(15.79 ±3.31)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.27),其他组均差异有显著统计学意义(P<0.01)。

5. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的 Oct-4 表达率(图 2,3):对照组为(25.23 ±3.12)%,1× 10-8mol·L-1维甲酸组为(18.12±1.23)%,1×10-7mol·L-1维甲酸组为(12.65±0.52)%,1×10-6mol·L-1维甲酸组为(10.02±0.28)%,1×10-5mol·L-1维甲酸组为(9.65±2.03)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.19),其他组均差异有显著统计学意义(P<0.01)。
讨 论
HAECs为人体正常细胞,其能够在体外大量培养且被诱导分化为不同类型的细胞[5],且HAECs还具有低免疫原性、不具致瘤性及无伦理法律问题等优点[4],为治疗神经系统退行性疾病和外伤性神经损伤带来新的契机。但目前维甲酸诱导HAECs 分化的研究仍不十分完善,本研究拟探索不同浓度维甲酸对HAECs的诱导分化作用,从而确定其最适浓度,为HAECs在临床治疗神经系统疾病提供理论基础。
Takashima 等研究发现:新鲜分离的HAECs能够表达α抗胰蛋白酶、CPS-I、CYP2D6、CYP3A4等肝细胞功能基因及 HNF-3γ、HNF-4、C/EBP-α、HNF-1等转录因子,在加入1×10-7mol·L-1地塞米松和0.1 ?mol·L-1胰岛素诱导1周后,上述功能基因随诱导天数增加表达也逐渐增强。此外,还发现诱导后的HAECs能够合成并分泌白蛋白、储备糖原的功能,这正是肝细胞所具有的典型功能。
Miki等研究发现:HAECs加入10 mmol·L-1尼克酰胺悬浮培养14 d后,可检测到胰岛发育、胰岛功能基因,如胰腺十二指肠同源盒(PDX1)、神经源素3(Ngn3)、同源异形盒转录因子6(PDX6)、胰岛素、胰高血糖素的表达,且随着培养基中葡萄糖浓度的升高,胰岛素分泌也增加,证实HAECs可向胰腺样细胞分化。
Miki 等还发现:HAECs在加入1 mmol·L-1抗坏血酸磷酸盐培养14 d 后,可以检测到心肌特异性基因表达,如转录因子Nkx2.5和GATA-4及房、室肌球蛋白轻链2(MLC-2A,MLC-2V)。此外免疫组织化学染色检测到α-辅肌动蛋白和特异性结蛋白等肌系细胞标志物,证实HAECs体外诱导下也可表现出心肌细胞的特性。
多项研究发现[13~16],HAECs表达神经元特异性标记物MAP-2、神经胶质标记物GFAP和神经干细胞标志物Nestin,在碱性成纤维生长因子、神经生长因子、表皮生长因子等多种生长因子和(或)维甲酸诱导下,能够上调Nestin、MAP-2和GFAP表达,具合成释放乙酰胆碱、儿茶酚胺、多巴胺及去甲肾上腺素等多种神经递质的功能,且能合成释放神经营养因子3、神经生长因子、脑源性神经营养因子等多种因子,证实人羊膜上皮细胞可向神经样细胞分化。
本研究采用免疫组化技术证实HAECs在维甲酸诱导下可导致Nestin、MAP-2、GFAP阳性细胞增多,Oct-4阳性细胞表达减少,促使HAECs 向神经样细胞分化;并将HAECs暴露于不同的维甲酸浓度下,根据神经样细胞的阳性比例寻求出维甲酸体外诱导HAECs向神经样细胞分化的最适浓度,结果表明维甲酸最适浓度为1 ×10-6mol·L-1。值得注意的是,在HAECs原代培养中,加入了1×10-5mol·L-1维甲酸诱导后细胞胞质内出现空泡样改变,大量细胞固缩脱落,并可见部分细胞碎片,提示维甲酸具有一定毒性,过高浓度的维甲酸可导致HAECs凋亡。
体外培养HAECs内上皮细胞特异性标记物CK19表达强阳性,证实培养细胞为上皮细胞,但部分细胞仍低表达vimentin,表明经过体外培养可能引起HAECs的去分化,也可能是羊膜组织上发生了上皮-间质转分化。总之,本研究显示HAECs可在维甲酸诱导下转化为神经样细胞,1×10-6mol·L-1维甲酸为最适诱导浓度,证实HAECs具有分化为神经细胞的潜能。本研究为临床上应用细胞治疗神经系统疾病提供新思路。
诱导性多能干细胞(inducedpluripotentstemcells,iPSC)是利用基因工程技术将动物或人的体细胞重编程而得到的一种类似胚胎干细胞(embryonicstemcells,ESC)的多能干细胞类型[1].本研究小组前期研究发现,维甲酸能诱导iPSC分化成神经细胞,并且能形...
本文将对线粒体在脓毒症心肌细胞凋亡中的作用机制做一综述,以期为后续更深入的研究提供一定的理论依据。...
卵泡是卵巢内的基本功能单位,包含一个卵母细胞、颗粒细胞及膜细胞〔1〕。卵泡膜间质细胞(theca-interstitialcells,TIC)是卵巢中除卵泡外具有分泌雄激素功能的间质细胞,它在卵泡的生长发育、闭锁过程中发挥着多种重要作用〔2-4〕,同时作为卵巢微...
将已分化的体细胞重编程为类胚胎干细胞样细胞的技术完成于2006年.Takahashi等[1]通过外源表达一组选择性的转录因子导入成体小鼠成纤维细胞,最终确定最少有4种转录基因组合---Oct4(也称Pou5f1、Oct3/4)、Sox2、Klf4和c-Myc可将成纤维细胞重编程...
体外动物细胞培养已广泛应用于现代医学、生物学和分子遗传学等多个领域,是从事细胞水平及分子水平研究所采用的基本方法。在高原环境下心肌细胞的体外培养尚未见报道。本文拟通过心肌细胞系的体外培养,观察其生长和增殖状况,并通过绘制生长曲线,初步探讨...
利用昆虫细胞表达特殊蛋白复合体或具有细胞毒性蛋白时,常规表达调控方法并不适合。因此,需要在时间、空间和表达强度方面具有更灵活精确的基因表达调控方法。...
血管平滑肌细胞(vascularsmoothmusclecells,VSMC)对维持动脉壁结构和功能的完整性起到了重要作用。OPG作为肿瘤坏死因子受体超家族成员及细胞核因子-B受体活化因子配体的诱导受体,不仅参与了骨的代谢过程,也参与了血管壁的钙化。目前已经有大量研究证实O...
细胞凋亡是一种生理性和主动性的细胞死亡,主要包括外源性的死亡受体途径、内源性的线粒体损伤途径和近期发现的内质网应激途径。细胞凋亡时,内质网(endoplasmicreticulum,ER)发生扩张,与细胞膜融合。内质网是细胞内重要的细胞器,分为粗面内质网和...
肿瘤干细胞(cancerstemcells,CSCs)是肿瘤组织中具有自我更新、多向分化及较强增殖能力的少量干细胞样癌细胞亚群,是肿瘤起源、生长、转移与复发的根源所在。近年来,寻找靶向杀死肿瘤干细胞的抗癌策略已成为研究的热点。其中,选择何种细胞表面标志物来...
骨髓基质细胞(BMSCs)是干细胞及处于不同分化阶段的前体细胞的混合物,具有自我更新能力及多向分化潜能。由于取材方便、创伤小,用于细胞移植和基因治疗有许多优势,具有很好的临床应用前景。由于骨髓中细胞成分比较混杂,BMSCs在骨髓中含量极少,仅占骨髓中...