
人体感染乙型肝炎病毒(HBV)后产生乙型肝炎病毒核心抗体(HBcAb),HBcAb阳性表明机体曾经或正感染HBV,因此HBcAb成为实验室诊断HBV感染,以及流行病学调查中最常使用的血清标志物之一。然而,在实际工作中HBcAb阳性率远远高于其他HBV标志物,其是否由机体感染HBV产生至今尚不确切。Zaatari等[1]报道在HBcAb单独阳性者中真阳性率仅5.4%,Dhawan等[2]报道仅1.0%,而Yotsuyanagi等[3]则报道真阳性率为38.0%.卫生部临床检验中心HBcAb室间质评从2007年已取消HBcAb的流行病学及临床意义,表明其对既往或正在感染HBV的判别缺乏足够的证据。可见HBcAb假阳性的存在及其所带来的困惑。近年来,随着化学发光微粒子免疫分析法检测技术的广泛推广,国内越来越多的实验室将其用以HBcAb检测。雅培公司ARCHITECT i2000HBcAb检测试剂盒使用重组乙型肝炎病毒核心抗原(rHB-cAg)与HBcAb直接结合技术,能有效地减少酶联免疫吸附试验(ELISA)竞争法的检测干扰等负面影响,是国外流行的技术。本课题研究微粒子发光检测HBcAb阳性的临床意义,现报道如下。
1资料与方法
1.1一般资料
2012年1月至2014年11月在本院体检、门诊、住院的乙型肝炎两对半发光结果中HBcAb阳性者16 830例,标本检测时均无溶血、脂血及黄疸。根据目测HBcAb发光结果cut off指数(COI值)将其分为3组:1.0~ <9.0组(11 545例)、9.0~<11.0组(1 944例)、≥11.0组(3 341例)。
1.2仪器与试剂
ARCHITECT i2000SR全自动化学发光免疫分析系统(以下简称i2000SR)及配套试剂、校准品及质控品,均由 雅 培 公 司 提 供。实 时 荧 光 定 量 扩 增 仪 (型 号DA-7600)、HBV核酸定量检测试剂盒均购自中山大学达安基因股份有限公司。
1.3方法
1.3.1 i2000SR检测
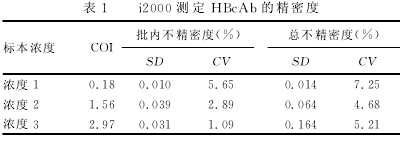
HBcAb的精密度与准确度验证参照美国临床实验室标准化协会(CLSI)EPl5-A2文件[4]对精密度的验证要求,并根据仪器说明书,选定接近说明书中厂商对分析物的评价浓度为实验浓度,即浓度1~3分别为0.18、1.56、2.97IU/mL,各浓度标本均为高值检测标本采用低值血清进行配制,于-70℃冰箱保存。配制标本的理论值均由连续检测3次以后计算其均值获得。然后将以上每个浓度标本分为20份,每天检测4份,连续检测5d,记录并分析数据。厂商声明的HBcAb批 内 不 精 密 度 [以 变 异 系 数 (CV)表 示]为1.09%~5.65%,总CV为4.68%~7.25%.同时对2个水平不同批号的定值校准品进行重复检测,取均值与校准品标识值进行比较,计算相对偏差,以相对偏差小于或等于10%判断准确度性能的可接受性。
1.3.2 HBV DNA的检测
乙型肝炎表面抗原(HBsAg)与乙型肝炎表面抗体(HBsAb)均阴性且HBcAb的COI值大于或等于11.0的标本进行HBV DNA检测。采用聚合酶链反应(PCR)-荧光探针法检测HBV DNA病毒载量,线性范围:1.0×103~1.0×109IU/mL.最低检出水平:1.0×103IU/mL,HBV DNA≥100为阳性。
1.4统计学处理采用SPSS18.0统计软件进行数据处理与统计分析,计数资料以百分率表示,组间比较采用X²检验,P<0.05为差异有统计学意义。
2结果
2.1精密度与准确度验证 i2000SR测定不同浓度HBcAb的不精密度CV见表1,结果显示本试验CV均小于厂商声明结果。并且HBcAb相对定值标准品偏差为(6.30±1.38)%,偏差均小于10%,符合试验要求。
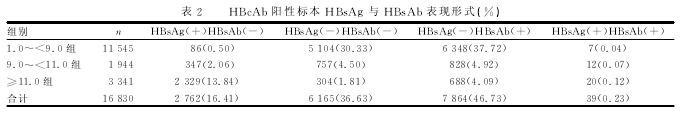
2.2 HBcAb阳性标本HBsAg与HBsAb表现形式COI≥11.0组HBsAg(+)HBsAb(-)检出率(13.84%)高于其他3种表现形式(X²=13.28,P<0.05)。COI值9.0~<11.0组,各HBsAg、HBsAb表现形式检出率比较差异无统计学意义(X²=1.29,P>0.05);COI值1.0~<9.0组,HBsAg(+)HB-sAb(-)检出率(0.5%)低于其他2组(X²=44.05,P<0.05);HBsAg(-)HBsAb(-)与HBsAg(-)HBsAb(+)总检出率比较差异无统计学意义(X²=2.09,P>0.05)。各组HBsAg、HBsAb表现形式见表2.HBsAg(-)HBsAb(-)且HBcAb的COI≥11.0的标本共304份,均进行HBV DNA检测,阳性率为21.0%(64/304)。HBsAg(+)HBeAg(+)标本与HB-sAg(+)HBeAg(-)标本HBcAb的COI指数分布差异无统计学意义(X²=17.16,P>0.05)。
3讨论
本研究参照美国CLSI发布的仪器性能评价标准文件,对HBcAb检测仪器i2000SR的检测精密度和准确度进行评价,证实其分析性能符合本试验要求。与ELISA法相比,化学发光微粒子免疫分析法检测乙型肝炎两对半的优势在于自动、灵敏、特异,其结果的稳定性与可靠性已得到同行的认可,是国外流行的主要方法。i2000SR销售数据显示国内越来越多的实验室已经购买应用。本研究可为HBcAb阳性结果的分析提供参考。达安基因HBV核酸定量检测试剂是获国家食品药品监督管理局(SFDA)认证的产品,PCR-荧光探针法具有PCR的灵敏度与荧光探针杂交的特异度,不但可以定量检测HBVDNA,还可减少漏检率,提高特异度。
乙型肝炎病毒核心抗原(HBcAg)被专家学者用来生产乙型肝炎疫苗,该疫苗对使用HBsAg疫苗呈低或无应答的人群大有益处[5],从中说明HBcAg具有高度免疫原性,感染的个体几乎可以产生大量的抗体。这可解释笔者观察到的HBcAb的COI≥11.0组 中HBsAg(+)HBsAb(-)的 检 出 率(13.84%)明 显 高于其他3种表现形式 (P<0.05),COI为1.0~<9.0组中HBsAg(+)HBsAb(-)检出率(0.5%)明显低于其他2组(P<0.05),据此采用HBcAb的COI≥11作为判断HBV现症感染的参考指标。然而,本研究也发现HBcAb的COI≥11的标本中有304份HBsAg(-)HBsAb(-),虽然其HBV DNA阳性率为21.0%,存在一定的隐匿性HBV感染,但对于HBV DNA阴性者应不存在HBcAg,从而不能产生HBcAb.分析原因:虽然HBV DNA结果阴性可能低于检测限,但实际上这些患者机体内HBV并未真正被清除,可能是因为所用试剂对突变的HBV片段检测效率低或存在检测盲区,但并没有足够的证据证明。当然离开了HBcAg的高度免疫原性,HBcAb浓度会下降,所以HBcAb的COI为1.0~<9.0组中HBsAg(-)HBsAb(-)和HBsAg(-)HBsAb(+)的总检出率高于HBsAg(+)HBsAb(-)检出率,据此认为HBcAb的COI为1.0~<9.0可作为HBV既往感染的参考指标。又由于人体的免疫系统具有记忆功能,对一些曾经感染过HBV且恢复的个体其HBcAb会存在数年,并且常与HB-sAb和(或)抗HBeAb同时存在,这可能是由于与HBsAg(-)HBsAb(-)和HBsAg(-)HBsAb(+)相 比,其HBcAb的COI值无明显差异。
另外,笔者还统计了2014年4~9月HBcAb阳性率高达57.7%,远高于HBsAg的8.7%,与Qiao等[6]报道的HBcAb为人群中检出率最高的HBV标志物相一致。可见HBcAb存在一定的假阳性,目前HBcAb假阳性的机制仍然不明确。部分学者认为HBcAb的产生可能是由于前母B淋巴细胞的激活是非特异性的,导致机体未感染HBV也可产生相关的分子参与检测[7];也 有 学者 认为这与 目 前 检 测 所 用 的 重 组 抗 原HBcAg为大肠杆菌细胞内表达的基因工程抗原,而人体内存在大肠杆菌抗体,在HBc酶标志物检测体系中的这些抗体均能与大肠杆菌表达的重组抗原HBcAg混杂的菌体蛋白结合而出现假阳性相关[8].因此,将竞争ELISA法改为双抗原夹心,检测更为直接;或利用杆状病毒表达载体系统来生产重组核心抗体,或采用酵母、质粒、其他亚型的大肠杆菌等载体来表达核心抗原,减少非特异性反应。总之,检测HBcAb的技术仍有待提高。
HBcAb阳性结果尤其是单独弱阳性标本在不同的医院可能有不同的应对措施,从本研究结果得出如下措施可供参考:微粒子发光检测乙型肝炎两对半结果中的HBcAb阳性,HB-cAb的COI值大于或等于11.0可作为判断HBV现症感染的参考指标;其COI为1.0~<9.0可作为判断HBV既往感染的参考指标;其COI为1.0~<9.0时为灰区,临床意义不肯定。总之在临床应用时,应将HBV各种标志物综合分析才能提高HBcAb的实验室诊断性能。
参考文献
[1]Zaatari M,Kazma H,Majzoub M,et al.Hepatitis B virus DNA inserum of anti-HBc only-positive healthy Lebanese blood donors:significance and possible implications[J].Hospit Infect,2007,(66):278-282.
[2]Dhawan HK,Marwaha N,Sharma R,et al.Anti-HBc screening inIndian blood donors:still an unresolved issue[J].World J Gasatro-enterol,2008,14(34):5327-5330.
[3]Yotsuyanagi H,Yasuda K,Moriya K,et al.Frequent presence ofHBV in the sera of HBsAg-negative,anti-HBc-positive blood do-nors[J].Transfusion,2001,41(9):1093-1099.
氨基酸脱氨基作用产生氨,氨在肝脏经鸟氨酸循环合成尿素,尿素通过血液运输到肾脏,由尿液排出体外[i7血清尿素氮的含量可以很好地反映人体内的肾代谢情况,因此临床中测定血清尿素氮含量的临床意义非常重人。为进一步提高肾脏疾病的临床诊断速度和急救效果...
肺炎是儿科常见感染性疾病,而细菌感染则是其发生发展的主要病因。因为婴幼儿具有的特殊性,且婴幼儿细菌感染性肺炎的早期临床症状常不典型,进展较快,因此寻找早期肺炎标志物就显得尤为重要。当然血培养作为经典的儿科感染性疾病的常规检查项目在临床诊断...
随着国家《实验室质量和能力认可准则》(ISO15189实验室认证)在国内大中型医院的开展,使得化学发光等检验项目的方法学性能评价己提到日程上来[00。参照美国临床实验室标准化协会(CLSI)有关文件要求和国家ISO5189认证的规定,凡参加医学实验室认证的实验室,...
据相关数据统计,在临床上,血液标本的临床检验的不合格率高达9.4%,而80%不合格原因是因为血液标本的质量不合格因素造成的,其中,更是以护士采集标本因素为主,占了65%,已经成为了临床护理实践中一个不可忽视的重大问题[1].因此,文章抽取我院在2012年5月至...
人类基因组计划完成以及后基因组时代的功能基因组研究,不但发现了疾病的发生发展与特定基因的存在(易感基因)、状态(表观遗传学)及表达(mRNA及蛋白)有关,而且编码药物代谢酶的基因的多态性还与患者的疾病治疗特定用药密切相关[1],基因检测在临床上...
儿童梅毒主要是由于在宫内感染引起的先天性梅毒,少数可通过哺乳、输血等接触而传染。梅毒螺旋体易通过胎盘感染胎儿,导致先天性梅毒,对胎儿及新生儿造成不良影响,小儿梅毒严重影响小儿的身心健康与发育,是一种严重影响婴幼儿身心健康的疾...
流感病毒每年均反复引发人类呼吸道疾病,给社会经济和人类健康造成了沉重的负担。目前预防和控制流行性感冒最为有效的措施就是接种疫苗。...
幽门螺杆菌(Helicobacterpylori,简称Hp),首先由巴里马歇尔(BarryJ.Marshall)和罗宾沃伦(J.RobinWarren)二人发现,幽门螺杆菌感染是慢性胃炎的主要致病因素,还与消化性溃疡、胃癌的产生密切相关.Hp检测方法很多,主要分为介入性和非介入性...
本研究考察了3种在RPLC尿液代谢组学中常用的流动相改性剂,进行了3种流动相的总离子流色谱峰个数和检测到的离子数评价,碎片离子的响应强度评价,离子的MS/MS分辨率分析。结果表明,在正离子和负离子模式下分别使用甲酸和乙酸铵改性剂是实现尿液中...
不同检验系统的灵敏度、准确性等存在差异,导致不同检测系统测定结果间的可比性较差,患者在各个医院间经常需要重复检验,给患者、医院均造成了财力和物力的浪费。基于该现实情况,实现院间检验结果互认非常必要。常熟市医学检验所是国内首家采用区域内集约化管...