骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组常见的以无效造血合并一系或多系骨髓病态发育的恶性克隆性造血干细胞疾病,其临床表现复杂多样、亚型分型复杂。因此以骨髓细胞形态学为主的传统方法诊断 MDS 十分困难,且对其亚型的分型、预后评估也难以准确把握。近年来,随着 MDS在病理学、遗传学、生物学、细胞免疫学及临床研究等方面取得了长足的进展,MDS 的各种特征也日益受到关注。我们自 2010 年起建立起包括骨髓涂片、活检、染色体核型显带、荧光原位杂交(fluorescencein situ hybridization, FISH)及流式细胞学(flowcytometry,FCM)5 项诊断综合诊断技术,从细胞形态学、免疫学、细胞遗传学及分子生物学(morphologie,immunophenotypie,cytogenetic,molecular,MICM)五联综合诊断技术用于 MDS 的临床诊断、分型及预后评估。本研究回顾分析本院血液病中心 248 例经 MICM 五联综合诊断技术诊断为MDS 患者的五联检查结果,分析其骨髓细胞形态学单项与双联及多项联合综合诊断符合率及其对分型、预后评估的影响,探讨 MICM 五联综合诊断技术对MDS 诊断价值。
1 材料与方法
1.1 一般资料
同步收集2010年10月至2013年11月在我院经骨髓涂片、活检、染色体核型显带、FISH 及 FCM 五项联合检测,结合临床资料、临床随访结果综合诊断为 MDS 的患者共 248 例,其中男性 86 例,女性 162 例,年龄 3~83 岁,中位年龄 45 岁。MDS诊断标准参照 2008 版 WHO 造血组织和淋巴系统肿瘤分类的标准进行。
1.2 方法
1.2.1 骨髓涂片 采用髂后上棘骨髓穿刺术抽取不超过0.2mL 的骨髓液,按常规制成涂片,行 Wright 染色涂片两张,同步行外周血涂片 1 张,按诊断需要加做铁染色和 POX 染色等。细胞形态学检验按常规进行。
1.2.2 骨髓活检切片 同步采用髂后上棘不同穿刺点行骨髓活检术取长度不小于 0.3(0.3~1.0)cm 的骨髓组织样本。经 Bouin 液固定 2 h,使用乙醇梯度脱水,用 Hemapun865 普通塑料包埋, 按常规切片,3 μm 厚切片两张,行苏木精-吉姆萨-酸性品红染色(haematoxilin giemsa acid fuchsin,HGF)染色,5 μm 厚切片两张,行网硬蛋白纤维(Gomori)染色。按诊断需要加做 Masson 染色。骨髓切片病理学检验按常规进行。
1.2.3 染色体核型显带分析 同步抽取骨髓液 2~4 mL,采用骨髓细胞直接法和(或) 短期培养法,染色体制备与 R 显带按常规进行。每例样本分析要求不少于 25 个中期细胞, 核型异常按《人类细胞遗传学国际命名体制[ISCN(2005)]》进行描述,结果报告按常规进行。
1.2.4 间期 FISH 检测 同步抽取骨髓液 2~4 mL,骨髓细胞固定、低渗、滴片按常规进行。所用组合探针试剂盒购于北京金菩嘉医疗科技有限公司,本试剂盒主要包括以下 6 组探针:①探针 GLP CSF1R/GLP D5S23,D5S721,②探针 GLP EGR1/GLPD5S23,D5S721,③探针 GLP D7S486/CSP7,④探针 GLPD7S522/CSP7,⑤探针 GLP D20S108/CSP8,⑥探针 CSP X/CSP Y。FISH 所有实验条件及操作严格按照试剂说明书进行。结果分析:每例样本至少分析 1 000 个细胞, 应用荧光原位杂交自动分析系统(基因公司) 进行图像采集和分析。要求≥10%的细胞出现相同异常的杂交信号结果才能被判断为阳性结果。
1.2.5 流式细胞学检测 同步抽取骨髓液 2~4 mL,采用骨髓细胞直接免疫荧光标记,CD45/SSC 参数散点图设门方法。所用流式细胞仪 FACS CaliburTM及抗体均购于美国 BD(BectonDickinson)公司。主要包括以下抗体:CD3、CD4、CD8、CD2、CD5、CD7、CD10、CD19、CD20、CD33、CD13、CD117、CD15、CD11b、CD64、CD34、HLA-DR、CD14、CD56、CD16、CD38、CD45及同型对照。要求设门内细胞阳性表达大于 10%方能确定为该抗原呈阳性表达。
1.3 观察内容
1.3.1 诊断符合率 包括单项(骨髓涂片)、双联(骨髓涂片+活检)、三联(骨髓涂片+活检+染色体)、四联(骨髓涂片+活检+染色体+FISH)和五联(骨髓涂片+活检+染色体+FISH+FCM)诊断符合率比较。MDS 诊断标准参照 2008 版 WHO 造血组织和淋巴系统肿瘤分类标准,包括以下亚型:MDS-RCUD、MDS-RARS、MDS-RCMD、MDS-RAEB-1、MDS-RAEB-2、MDS-U、5q-综合征。
1.3.2 增生程度、病态造血及间质改变 比较骨髓涂片及切片增生程度、病态造血检出率及间质改变情况。判定标准按文献[4-6]进行。病态造血包括:红系病态造血、粒系病态造血、巨系病态造血等。间质改变包括:网硬蛋白纤维异常增生及胶原蛋白沉积现象等。网硬蛋白纤维增生程度分级积分标准按Manoharan 等改良法进行判定。
1.3.3 染色体核型显带分析及 FISH 检测 包括-5/5q-、-7/7q-、+8、20q-、-X、-Y 在内的染色体数目和结构的异常。
1.3.4 流式检测异常免疫表型 包括抗原跨系表达异常、抗原增强或缺失表达异常、抗原跨阶段表达异常、成熟粒细胞抗原分化异常、粒细胞的 CD45/SSC 异常等。
1.4 统计学方法采用 SPSS 13.0 统计软件行 χ2检验。
2 结果
2.1 诊断符合率
248 例患者中,双联、三联、四联及五联综合诊断符合率分别为 79.44%(197/248)、87.10% (216/248)、88.71% ( 220/248)及 93.15% ( 231/248),与骨髓涂片细胞形态学单项诊断符合率59.27%(147/248)比较,均有统计学差异(P<0.05)。
2.2 增生程度、病态造血及间质改变
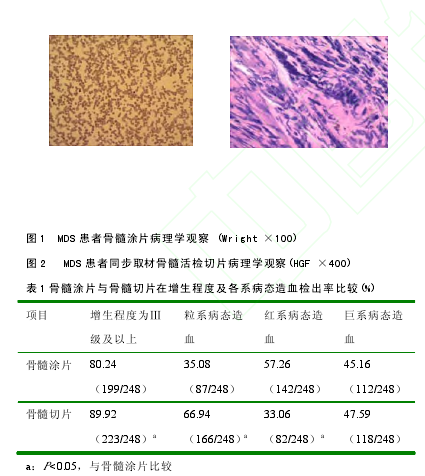
248 例患者的骨髓切片中,增生程度为Ⅲ级(含Ⅲ级)以上的,骨髓切片与骨髓涂片比较有统计学差异(P<0.05),说明对骨髓增生程度的判断骨髓活检切片优于涂片。就粒、红、巨三系骨髓细胞病态造血检出情况而言,骨髓涂片与切片病态造血检出率也有所差异,见表 1。在骨髓纤维组织的有无及增生程度判定方面,骨髓活检有独到的价值。某患者骨髓涂片(图1)提示有核细胞增生极度低下,但无法明确诊断,而该患者同步取材骨髓活检(图 2)则提示骨髓纤维化。骨髓切片经Gomori 染色示轻度至中度(+~++)网硬蛋白纤维组织增生以上的 171 例(68.95%),另有 12 例并有显着纤维化(++++,4.84%)。
2.3 染色体核型显带分析及 FISH 检测结果
248 例 MDS 患者染色体分析检查中,131 例检出染色体异常核型,异常核型检出率为 52.82%(131/248);FISH 异常核型检出率为 56.05%(139/248),其中,染色体分析检查显示存在有异常的,FISH 检测均得到证实;有 8 例染色体分析检查未检出克隆性异常,而 FISH 检测提示有 2 例存在-5/5q-,1 例存在-7/7q-,4 例存在 20q-,1 例存在+8。采用 FISH 技术,MDS患者异常核型检出率略高于染色体分析,但差异无统计学意义(P>0.05)。
2.4 流式细胞检测结果
248 例 MDS 患者流式细胞检测结果中,211 例 MDS 患者检测到存在抗原异常表达,异常检出率为 85.08%。发现最常见的骨髓病态发育为粒细胞 CD13/CD16 分化异常及幼稚细胞CD45 表达异常,见表 2。其中存在 2 项及以上异常的抗原异常表达的检出率为 74.60%(185/248),存在 3 项及以上异常的抗原异常表达的检出率为 55.65%(138/248)。
3 讨论
MDS 是一组起源于多能造血干细胞的恶性克隆性疾病,主要特征有:①血细胞发育异常,表现为骨髓无效和病态造血;②恶性克隆保留一定程度的分化潜力,且增生比较缓慢;③部分最终转化为急性白血病。大部分 MDS 患者的病态发育骨髓涂片形态特征缺乏特异性,且临床表现及其分类复杂多样,单纯的依靠骨髓细胞形态学检查来诊断 MDS 十分困难,且对其亚型分型、预后评估也不可能做到十分准确。虽然近年来 MDS 在病理学、遗传学、生物学、细胞免疫学及临床研究诸方面均已取得了长足的进展,但不论是骨髓涂片、骨髓活检,还是染色体核型显带分析、FISH 检测及 FCM 等检测指标中都未发现诊断 MDS的金标准,因而建立一套完整的 MDS 综合诊断技术体系则显得尤为重要。
骨髓涂片检查因其简便、快捷、经济,被国内各级医院广泛使用。但由于受骨髓穿刺技术、骨髓网硬蛋白纤维组织增生程度、骨髓细胞增殖程度等因素的影响,骨髓涂片不能准确地反映患者的骨髓造血情况。本研究中,骨髓涂片的诊断符合率仅为 59.27%,骨髓涂片与切片双联的诊断符合率 79.44%,明显优于骨髓涂片单项,与文献[7]报道一致。在骨髓增生程度判断方面,骨髓切片也优于骨髓涂片。就各系病态造血检出率方面,由于幼稚前体细胞异常定位(abnormallocalized immature myeloid precursors,ALIP)结构只能在骨髓切片上检出,故骨髓活检粒系病态造血检出率(66.94%)要优于骨髓涂片(35.08%);由于骨髓涂片对单一细胞形态的识别优于切片,故骨髓涂片红系病态造血检出率(57.26%)明显优于骨髓活检(33.06%),故二者联合,可以互补。本研究还显示,存在网硬蛋白纤维组织轻度增生及以上的患者占 68.95%,另有4.84%伴有显着纤维化,和文献[8]报道大致相当。这提示多数 MDS 患者骨髓可伴有轻度及以上的纤维组织增生甚至骨髓纤维化,会导致骨髓涂片结果不准确。由于骨髓纤维组织只能通过骨髓活检检出,故二者联合,不仅能判断骨髓纤维组织增生情况,还能使结果的准确性得到提高。对于低增生性 MDS 和 MDS伴有骨髓纤维化的患者就只能通过骨髓活检切片,才能诊断。在预后评估方面,骨髓纤维组织的有无及增生程度与 MDS 的克隆增生性相关,是独立的不良预后因素。
细胞遗传学分析对于 MDS 的诊断及预后有着重要的价值,在现行的 WHO 的诊断及预后评分系统中(如 IPSS、WPSS、IPSS-R)都占有重要地位,染色体异常克隆的检出被作为确诊 MDS 的重要条件之一。目前,基于染色体核型显带及 FISH 技术的 MDS细胞遗传学异常率在 50%左右,已很难再有进一步的提高。对于伴有“正常核型”的 MDS 在诊断及预后评估方面仍然显得十分困难。本研究结果显示,联合了染色体核型显带及FISH技术的三联和四联MDS诊断符合率分别为 87.10%、88.71%,能明显提高 MDS诊断率。在本研究中,MDS 患者的异常核型检出率为 52.82%,且 MDS-RAEB 的患者高于非 RAEB 的患者,与国内外相关研究报道较一致。本研究中MDS 患者异常核型发生率依次为+8、20q-、-7/7q-、-5/5q-、-Y 、1q+、12p-,和西方国家报道的异常核型发生率依次为-5/5q-、-7 /7q-、+ 8、-20/20q-不一致,和国内周庆兵等报道较一致,分析原因可能是人种和地域的差异导致了亚洲人与西方 MDS 患者具有不同的遗传学特征。当染色体分析时存在中期细胞分裂相过少甚至缺如致使细胞遗传学检查无法进行时,FISH 技术作为细胞遗传学的重要补充方法,能为 MDS 的诊断、治疗和预后判断提供新的实验手段。本研究显示 FISH 技术异常核型检出率为 56.05%,略高于染色体核型显带分析(52.82%)。其中,染色体核型显带检查显示存在有异常的,FISH 均得到证实;有 8 例染色体核型显带检查为未检出异常的,而FISH 检测提示 2 例存在-5/5q-,1 例-7/7q-,4 例 20q-,1 例+8。采用 FISH 技术对染色体核型分析失败或漏检伴有染色体畸变的小克隆有重要的补充价值。异常核型的检出及其复杂程度是 MDS 又一个重要的预后不良因素。一项由德国、澳大利亚、西班牙等组成的 MDS 中心通过对 1 286 例患者的大量细胞遗传学资料观察,Haase 等提出了令人十分信服的染色体危度分层系统,在其预后系统中可以发现很多不同于 IPSS 的预后信息,对 MDS 的预后评估给出了更为详细、准确的预后信息,同时对治疗也具有指导意义。
FCM是利用细胞的免疫学表型对细胞进行计数及分类,由于MDS患者具有的细胞免疫表型异常,包括抗原跨系表达异常、抗原增强或缺失表达异常、抗原跨阶段表达异常、成熟粒细胞抗原分化异常、粒细胞的CD45/SSC异常等,而这些异常依据骨髓细胞形态检查来鉴别是非常困难的。本研究采用CD45/SSC设门,利用了CD16、CD33、CD13、CD117、CD15、CD11b、CD64、CD34、HLA-DR等多个抗体进行了多色流式分析,结果显示FCM单项诊断符合率为85.08%,和文献[18]报道一致,联合了FCM的五联诊断符合达到了93.15%。本研究中,主要的异常为粒细胞CD13/CD16分化异常,检出率为58.06%,略低于Stetler-Stevenson等报道的70%。其中存在2项及以上抗原表达异常检出率为74.60%,存在3项及以上的异常检出率为55.65%,和国内文献[18]报道较一致。
多参数流式可以对MDS患者骨髓细胞分别进行原始细胞群、成熟粒细胞群的分析,补充了细胞形态学对单核细胞评估的忽略,有助于MDS的诊断和评估。在2012年的欧洲白血病协作组(European leukemia net,ELN)会议中,免疫分型在诊断MDS中的地位再次得到证实,提出了免疫分型诊断MDS的标准化方案,当积分达到2时即可以考虑诊断为MDS。MDS患者骨髓细胞分化和发育过程中出现的异常表型及其复杂程度也是其预后评估的重要因素。2011年,Chu等提出的基于流式细胞术检测的评分系统FCSS则能很好地弥补IPSS和WPSS的缺陷。用FCSS评分系统将这些异常免疫表型进行量化可评价MDS患者的预后。
但是骨髓活检、染色体核型显带分析、FISH 技术及流式细胞学也均有其不足之处。WHO 分类目前仍是 MDS 诊断及分型的金标准,该分类主要还是以骨髓细胞形态学为基础的诊断方法,而对 MDS 的骨髓病理学特征、除 5q-以外的细胞遗传学特征及流式细胞学特征却提及较少。骨髓活检对单一细胞形态的识别也不及涂片准确,染色体核型分析则易受到分裂相的影响,对伴有较小染色体畸变克隆则容易漏检。
FISH 技术则只能对探针相应的染色体改变进行检测,无法发现除已知探针以外的染色体变异。目前的预后评分系统主要采用的仍是常规细胞遗传学检查。流式细胞学检测对粒系的病态发育检测有较高的特异性,但对红系的病态发育检测远不及形态学直接。
综上所述,目前国内外还没有某一种方法能对MDS 患者的各种临床特征全面进行检测,而 MICM五联综合诊断技术体系能有效提高 MDS 的诊断水平,对 MDS 分型、预后评估及优化治疗决策具有重要的临床意义。
参考文献:
[1] 浦权.实用血液病学[M].北京:科学出版社, 2013: 312.
[2] 周晓鸽. WHO(2008)造血与淋巴组织肿瘤分类[J]. 诊断病理学杂志,2008, 15(6): 510-512.
[3] Shaffer L G, Tommerup N. ISCN 2005: An international system for humancytogenetic nomenclature[M]. Basel: Karger Publication, 2005: 55.
[4] 陈文杰, 陈辉树. 造血系统疾病临床病理学[M].北京:北京医科大学、中国协和医科大学联合出版社,1997:147-148.
[5] Tkachuk D C, Hirschmann J V. Wintrobe’s atlas of clinical hematology[M].New York:Lippincott Williams & Wilkins, 2010:93-103.
[6] 浦权, 杨梅如. 血液病骨髓诊断病理学[M]. 北京:科学出版社, 2002:193-194.
[7] 关键虹, 王星烨, 郭桂丽, 等. 骨髓穿刺涂片与骨髓活检切片同步分析对诊断骨髓增生异常综合征的临床意义[J]. 现代肿瘤医学, 2009, 17(4):720-722.
[8] 程艳超, 孙慧, 甘思林, 等. 骨髓增生异常综合征染色体核型与病态造血和网硬蛋白的相关性研究[J]. 中国实验血液学杂志, 2013, 21(2):415-418.
[9] Marisavljevic D, Rolovic Z, Cemerikic V, et al. Myelofibrosis in primarymyelodysplastic syndromes:clinical and biological significance[J]. Med Oncol,2004, 21(4):325-331.
[10] Swerdlow S H, Campo E, Harris N L, et al. WHO classification oftumours of haematopoietic and lymphoid tissues [M]. 4th ed. Lyon: IARC press,2008: 14- 367.
[11] Babicka L, Ransdorfova S, Brezinova J, et al. Analysis of complexchromosomal rearrangements in adult patients with MDS and AML bymulticolor FISH[J]. Leuk Res, 2007, 31(1) : 39-47.
[12] Bernasconi P, Klersy C, Boni M, et al. World Health Organizationclassification in combination with cytogenetic markers improves the prognosticstratification of patients with de novo primary myelodysplastic syndromes[J].Br J Haematol, 2007, 137(3):193-205.
[13] Haase D, Germing U, Schanz J, et al. New insights into the prognosticimpact of the Karyotype in MDS and correlation with subtypes: evidence froma core dataset of 2124 patients [J]. Blood, 2007, 110(13): 4385-4395[14] 周庆兵, 胡晓梅, 刘峰, 等.骨髓增生异常综合征的遗传学检测研究进展[J]. 中国实验血液学杂志, 2011, 19(6):1536-1540.
[15] Coleman J F, Theil K S, Tubbs R R, et al. Diagnostic yield of bone marrowand peripheral blood FISH panel testing in clinically suspected myelodysplasticsyndromes and/or acute myeloid leukemia: a prospective analysis of 433cases[J]. Am J Clin Pathol, 2011, 135(6):915-920.
[16] Haase D, Schanz J, Tuechler F, et al. Updated cytogenetic risk features inMDS - present state[J]. Leuk Res, 2009, 33(Suppl 1):S9-S10.
[17] Porwit A. Role of flow cytometry in diagnostics of myelodysplasticsyndromes--beyond the WHO 2008 classification[J]. Semin Diagn Pathol, 2011,28(4): 273-282.
[18] 郭轶先, 孙雪静, 路继莲, 等. 87 例骨髓增生异常综合征多参数流式细胞术免疫表型分析[J]. 内科急危重症杂志, 2009, 15(5):241-244.
[19] Stetler-Stevenson M, Arthur D C, Jabbour N, et al. Diagnostic utility offlow cytometric immunophenotyping in myelodysplastic syndrome[J]. Blood,2001, 98(4):979-987.
[20] Westers T M, Ireland R, Kern W, et al. Standardization of flow cytometryin myelodysplastic syndromes: a report from an international consortium andthe European LeukemiaNet Working Group[J]. Leukemia, 2012, 26(7):1730-1741.
[21] Della-Porta M G, Picone C, Pascutto C, et al. Multicenter validation of areproducible flow cytometric score for the diagnosis of low-grademyelodysplastic syndromes: results of a European LeukemiaNET study[J].Haematologica, 2012, 97(8):1209-1217.
[22]Chu S C, Wang T F, Li C C, et al. Flow cytometric scoring system as adiagnostic and prognostic tool in myelodysplastic syndromes[J].Leuk Res, 2011,35(7): 868-873.