本文从不同脑区、脊髓及外周DRG等方面综述了HCN通道4个亚型在神经系统的分布,并且针对具体组织、核团分析其作用和生理功能。大家在相关论文写作时,可以参考这篇题目为“神经系统中超极化激活的环核苷酸门控的阳离子通道的分布与作用”的神经生物学论文。
原标题:HCN通道在神经系统中的分布及功能
摘要:超极化激活的环核苷酸门控的阳离子通道(hyperpolarization activated cyclic nucleotide gatedchannels,HCN) ,分为四个亚型:HCN1、HCN2、HCN3和HCN4.关于其在神经系统中作用的研究有很多,但是有些研究的结果似乎是矛盾的,这些矛盾的结果可能与其分布特点有关。在神经系统中,HCN通道的各个亚型的分布具有差异,这决定了其作用的差异性,因此在不同区域有其特定的生理功能。本文从不同脑区、脊髓及外周DRG等方面综述了HCN通道4个亚型在神经系统的分布,并且针对具体组织、核团分析其作用和生理功能。
关键词HCN通道; 神经系统; 分布。
超极化激活的环核苷酸门控的阳离子通道(hy-perpolarization activated cyclic nucleotide gated chan-nels,HCN) ,分为四个亚型:HCN1、HCN2、HCN3和HCN4.不同于大多数电压门控通道,HCN通道的激活受到双重机制的影响,即电压门控和配体门控。细胞膜在超极化状态下的HCN通道可以被激活,且c AMP能够直接与细胞膜上的通道蛋白结合,激活HCN通道,起到活化的作用。在不同细胞中,HCN通道的激活电压也会产生差异。通常情况下,当细胞膜在- 50 ~ - 60m V时即可被激活,接近大多数细胞的静息电位,而- 100m V左右的超极化电压可以使HCN通道完全被激活。与此同时,该通道在开放状态下允许Na+和K+按13至15的比例通过细胞膜,表现出非选择性通透,形成一个内向的阳离子电流,在神经系统中被称为Ih.而Ih参与了许多脑认知的生理过程,例如睡眠、学习和记忆等。
自从HCN通道被发现后,它的超极化激活特性立即引起了科学研究者的重视。HCN通道参与了许多神经活动[1],包括参与调节神经元活动的节律性和树突整合,调控细胞静息膜电位及突触传递等等。其中Ih在调节神经元内在兴奋性和突触传递上有重要作用,它既可以促进胚胎干细胞的增殖,也能处理外层视网膜的光反馈信号[2].另外,有研究发现苍白球中的突触后电流Ih能够抑制谷氨酸能和GABA能的突触传递,这表明HCN通道具有调节神经递质释放的作用。而近年来许多研究者将突触上的NMDA和GABAA受体以及突触外的氨基酸能递质受体作为参与癫痫疾病的发作机制进行研究[3],探索HCN通道在癫痫疾病中的作用。同时,也有一些研究表明HCN通道的调节异常可能与许多神经系统疾病有关,例如癫痫、神经病理性疼痛、帕金森综合征等等。
通过阅读大量文献可以发现,HCN通道在神经系统中发挥了十分重要的作用,但是许多研究结果不一致,甚至矛盾。如关于HCN电流在癫痫中的改变是上调还是下调的研究结果就不一致。Chen等(2001) 第一次发现热性癫痫模型鼠的海马CA1区椎体神经元中HCN电流是明显增加的,之后也有研究显示HCN通道在癫痫疾病发生过程中表达上调,功能增强[4].相反,有些研究显示HCN通道在癫痫模型中表达下调,功能降低[5].多年来,许多研究者通过免疫组织化学等方法陆续研究了HCN通道四个亚型在中枢神经系统中不同部位的分布情况。但是这些报道都是零星的,让后来的研究者读起来感到不系统甚至没有头绪。因此本文从不同脑区、脊髓及外周DRG等方面对神经系统中HCN通道四个亚型的分布情况加以综述,并叙述这种分布相关的生理功能,为进一步的科学研究整合了一些依据。
一、HCN通道在脑内的分布与功能
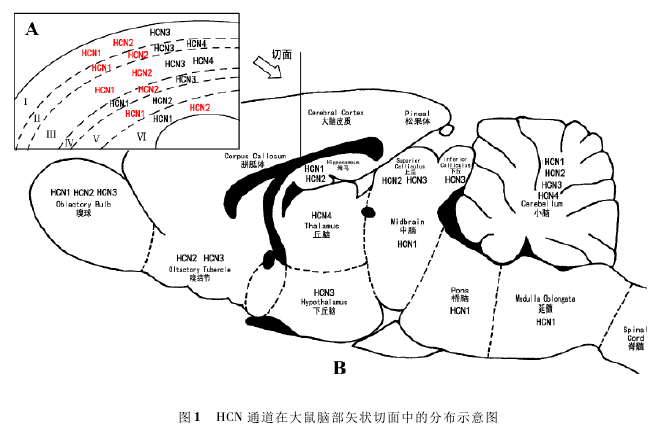
HCN通道在脑部不同区域的分布情况各不相同,Takuya Notomi和Ryuichi Shigemoto用免疫组织化学方法,系统分析了大鼠脑部HCN通道四个亚型的分布情况[6],我们根据目前文献研究及实验结果自行绘制了HCN通道在脑部的分布示意图( 图1) .
图中左上角为大脑皮质纵切面的放大图,在大脑皮质Ⅰ ~ Ⅵ层中分别标注 HCN 通道四个亚型的分布情况,红色字体标注的为在该层分布较多的亚型,黑色字体标注的为在该层表达量相对较少的亚型。主图中标注的是大脑不同区域表达量较多的 HCN 通道亚型。
( 一) 大脑新皮层
如图1所示,第I层中,HCN1和HCN2都有大量分布,HCN3的分布较少,而没有 发 现HCN4的 存 在。在 第II ~ III层 中,HCN1和HCN2含量较高,而HCN3和HCN4只有少量分布。在第IV层中,HCN2分布较多,HCN1和HCN3都只有少量分布,而没有发现HCN4的存在。在第V ~ VI层中无HCN3和HCN4,相比较而言,HCN1在第V层分布较多,而HCN2在第VI层大量分布。在大脑皮层神经元中,Zoltan Nusser总结了四种神经细胞上HCN1亚型的分布情况: 在大脑皮层第V层和海马中的椎体细胞上,HCN1呈梯度分布,从细胞胞体到近端树突,再到远端树突,HCN1的分布密度逐渐增加,且这种改变具有年龄依赖性,这种分布密度的增加,也表现为成熟神经元较未成熟神经元的树突尖端动作电位的幅度增加,而HCN通道的这些改变是超兴奋性皮质发育不良的一个重要的潜在机制。在主嗅球的外部簇细胞上,HCN1呈均匀分布,从胞体到树突,HCN1的分布密度是一致的。在海马篮状细胞中,HCN1主要表达在轴突终端及临近终端的轴突上。而在小脑篮状细胞上,HCN1在胞体到树突的膜上含量较少,而在轴突终端上分布相对较多。而HCN2在大脑皮层椎体细胞中的分布情况同HCN1,在树突上呈现距离依赖性:距离胞体越远的树突上,HCN2的密度越高[6].
( 二) 边缘系统
在嗅球及相关区域处,HCN1在主嗅球及嗅结节的CALLEJA岛上大量分布,而在辅助嗅球上分布的较少。HCN2和HCN3在主嗅球和嗅结节的网状层及梨状皮质上都大量表达,且HCN3在辅助嗅球的内部网状层也有较多分布,而在主嗅球及辅助嗅球的其他区域分布较少。相比之下,HCN4所分布的区域较少,只在主嗅球的外部网状层及嗅结节的梨状皮质中有分布。
在海马结构中,HCN1和HCN2在CA1区表达量最高。研究表明,在海马CA1区,HCN1和HCN2在神经元中发挥着调节Ih的作用,而Ih对调节大脑中神经元兴奋性有着重要作用,就有研究表明HCN1对调节树突的兴奋性有明显作用。随后,又有研究发现HCN1蛋白可以作为治疗焦虑和抑郁症的一个潜在药物靶点[7].与此同时,研究HCN2通道基因敲除的小鼠发现,敲除HCN2基因会导致炎性介质PGE2无法诱发动作电位[8],说明HCN2通道很可能参与调节伤害性感受器的兴奋性,从而诱发疼 痛。与 在CA1区 的 表 达 量 相 比,HCN1和HCN2在CA3区及齿状回上同样有较多分布,且HCN3的表达量明显增高,而HCN4只在齿状回的颗粒细胞层中有少量分布[9].有研究发现,海马椎体细胞上HCN1的分布量自胞体到远端树突逐渐增加,用免疫金染色发现,从胞体到远端树突的表达量增加了60倍,远端树突较近端树突的表达量多16倍。有趣的是,使用河豚毒素等兴奋性神经传递抑制剂后,HCN1又会在整个树突上重新均匀地分布。随后许多关于HCN1亚型的研究相继出现,YoavNoam等人将HCN1转染到培养的海马神经元细胞中,发现原代海马神经细胞和转染后的海马细胞中HCN1的表达量均具有谷氨酸依赖性: 随着谷氨酸与其受体结合,HCN1的表达量会相应增加[10].另有研究发现敲除HCN1基因的小鼠兴奋性和癫痫敏感性都会增加,且更容易产生红藻氨酸诱导的癫痫发作,在癫痫持续状态下死亡率也相当高。虽然至今为止关于人体内HCN通道与癫痫发作之间关系的研究还尚无定论,但是现有研究通过后天癫痫动物模型发现模型动物中HCN通道的表达量会下降,并会产生病理性兴奋过度,这说明HCN通道功能的紊乱与癫痫发作机制有着一定的联系。因此,我们有理由相信对HCN通道的分布情况及作用机制的深入研究是人类克服和解决癫痫这一重大疾病的并经之路,而HCN通道无疑会为癫痫疾病的治疗提供良好的新靶点。
在隔核和杏仁核中,HCN1在整个区域都有大量地分布,而HCN2只在隔核和基底神经节中含量较多。HCN3在基底神经节中也有较多表达,而HCN4在隔核、视前核、杏仁核及基底神经节上都分布较少。在帕金森病的啮齿动物模型中,可以发现苍白球上的HCN通道活性下降,Ih减小,HCN2的表达量下降,说明HCN2与帕金森综合症有密切联系。而有研究表明,HCN3在基底神经节输出神经元上分布量的增加可能是导致帕金森脑基底节输出神经元的电活动变化的机制[11].