摘 要: 背景:近年来, 随着干细胞与再生技术的不断进步, 骨组织工程得到了迅速的发展。虽然应用于骨组织工程中的种子细胞已经有很多, 但对于不同的疾病, 研究人员和临床工作者仍然面临着最佳种子细胞选择的问题。口腔骨组织重建是近年来研究的一个热点, 目前应用于口腔骨组织修复的方法很多, 但还没有一种方法能够取得满意的临床效果。因此, 充分利用干细胞在骨再生过程中的潜能将为口腔骨组织缺损修复提供一种新思路。目的:对不同来源干细胞促进口腔骨组织再生的潜能进行综述, 进而为组织工程选择种子细胞提供依据。方法:以“干细胞, 骨修复, 牙槽骨再生, 成骨, 骨组织”“stem cell, bone repair, alveolar bone regenerate, osteogenesis, bonetissue”为关键词, 检索中国生物医学文献数据库 (CBM) 、CNKI、PubMed、Elsevier以及Web of Science等数据库, 通过阅读文题和摘要进行初步筛选, 排除与文章主题不相关的文献, 最终纳入81篇文献进行结果分析。结果与结论:组织工程为口腔骨再生修复提供了新的方法, 但是对于干细胞的选择还没有标准化。应用于骨组织再生的干细胞种类有很多, 但因其来源不同在体内发挥的作用也不尽相同, 对于特定组织损伤的修复, 选择一种合适的干细胞就显得很重要。文章对胚胎干细胞、间充质干细胞以及诱导多能干细胞在口腔骨组织再生中的优缺点进行了比较, 旨在为口腔骨组织再生修复种子细胞的选择提供一种参考。
关键词: 干细胞; 胚胎干细胞; 间充质干细胞; 诱导多能干细胞; 牙槽骨修复; 骨再生; 成骨; 骨组织; 国家自然科学基金;
Abstract: BACKGROUND: In recent years, with the development of stem cell and regeneration technologies, bone tissue engineering has been rapidly developed. Despite there are a variety of seed cells for bone tissue engineering, researchers need to decide which types of stem cells are the best suitable for their specific purposes. To date, there is no ideal treatment for oral bone tissue repair, although a plenty of therapeutic methods have been proposed. Therefore, it will provide a new idea for repairing oral bone defects by fully utilizing the potential of stem cells during bone regeneration.OBJECTIVE: To review the osteogenic potential of stem cells from different sources on oral bone regeneration, thereby providing a basis for selecting seed cells for tissue engineering.METHODS: Databases of CBM, CNKI, PubMed, Elsevier, and Web of Science were retrieved with the keywords of “stem cell, bone repair, alveolar bone regenerate, osteogenesis, bone tissue” in English and Chinese, respectively. After initial screening of titles and abstracts, irrelevant articles were excluded and 81 eligible articles were included in final analysis.RESULTS AND CONCLUSION: Tissue engineering technology provides a new approach to oral bone regeneration, but the choice of stem cells has not been standardized. Many types of stem cells have been used for bone tissue regeneration, but their roles in the body vary due to different origins of stem cells. Therefore, choosing a suitable type of stem cells is important for the repair of specific tissue damage. In this review, we compared the advantages and disadvantages of embryonic stem cells, mesenchymal stem cells and induced pluripotent stem cells in the oral bone regeneration, and attempted to provide a reference for the selection of seed cells for the regeneration and repair of oral bone tissue.
Keyword: stem cells; embryonic stem cells; mesenchymal stem cells; induced pluripotent stem cells; alveolar bone repair; bone regeneration; osteogenesis; bone tissue; National Natural Science Foundation of China;
0、引言Introduction
牙槽骨缺损通常是由先天性畸形、骨折、创伤、肿瘤手术以及牙周炎等相关疾病所引起[1]。目前的治疗标准是使用骨移植来恢复牙槽骨缺损进而重建口腔的正常功能, 主要有自体骨移植、同种异体骨移植以及合成材料, 自体骨移植虽可以实现少量骨缺损的修复, 但是并不能满足大块骨缺损的修复以及可能会带来供区感染风险[2];同种异体骨移植和合成材料对骨诱导能力较差甚至可引起免疫排斥反应[3]。随着再生医学的发展, 干细胞在口腔骨再生修复中的潜力已经得到良好的展现[4,5]。目前, 胚胎干细胞、间充质干细胞和诱导多能干细胞已经用于口腔骨缺损修复[6,7]。文章综述了不同干细胞在口腔再生医学中的使用情况及其优缺点, 旨在为骨组织工程中种子细胞的选择提供方向。此外, 还介绍了不同信号分子 (细胞因子、生长因子) 对干细胞成骨分化的影响。

1、 资料和方法Data and methods
1.1、 资料来源
计算机检索中国生物医学文献数据库 (CBM) 、CNKI、Pub Med、Elsevier以及Web of Science数据库在2003至2018年期间收录的干细胞在口腔骨组织再生方面的相关文章。
1.2、 入选标准
纳入标准: (1) 有关胚胎干细胞在骨修复方面的相关文献; (2) 有关间充质干细胞在口腔骨再生修复方面的相关文献; (3) 有关诱导多能干细胞在口腔骨缺损修复方面的相关文献; (4) 干细胞与病理相关联的文献; (5) 同一领域中论点、论据可靠的文献。
排除标准: (1) 重复性研究且与研究目的无相关性的文章; (2) 资料无法提取的部分文献。
1.3、 数据的提取
研究内容由3人独立提取并通过讨论解决分歧。信息记录侧重于不同来源干细胞在口腔骨组织再生修复方面的相关文献。
1.4、 文献证据综合提炼
计算机检索初检得到542篇文献, 通过阅读文题和摘要进行初步筛选, 排除与文章主题不相关的文献, 根据纳入标准和排除标准, 最后纳入81篇文献进行综述, 见图1。
图1 文献检索流程简图
2、 结果Results
2.1、 用于再生医学的干细胞类型
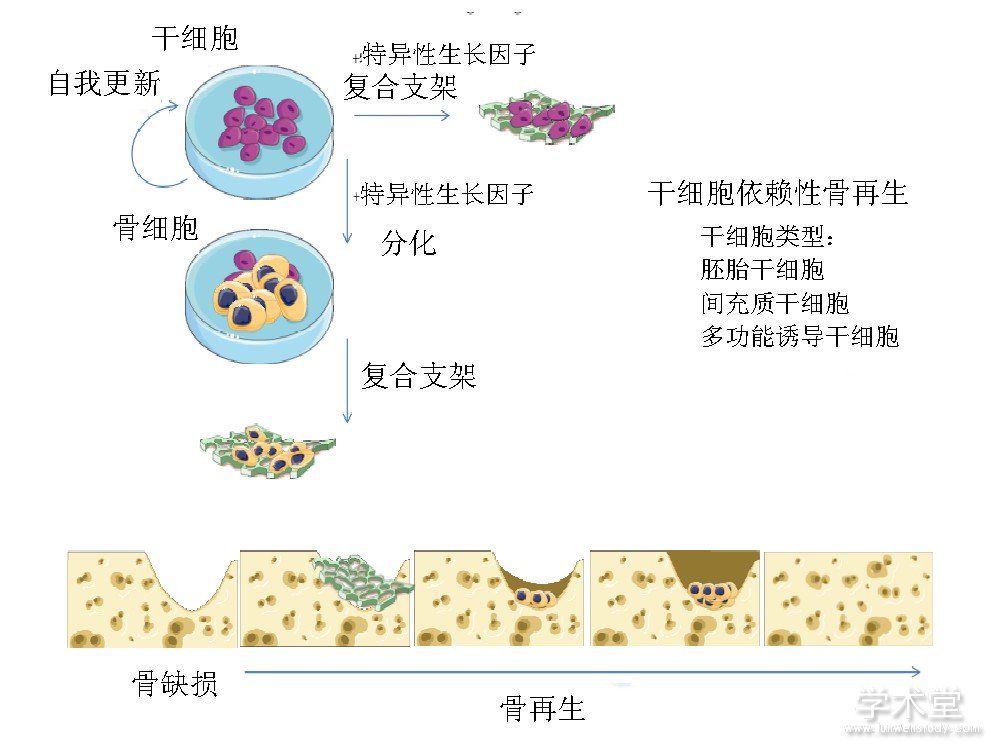
自20世纪80年代至今, 干细胞已经用于遗传疾病、免疫疾病、血液病以及骨肌肉系统疾病的治疗[8]。干细胞来源丰富、制备简单, 是再生医学领域最具有应用前景的种子细胞[9]。干细胞具有良好的免疫调节活性和旁分泌功能, 能够释放多种细胞因子, 促进细胞增殖, 抑制细胞凋亡, 修复损伤组织[10,11]。文章讨论了在口腔骨组织再生中应用较多的3种干细胞, 见图2[12], 比较了每种干细胞的优缺点以及成骨分化潜能。
图2 三种干细胞在骨组织再生方面的应用
2.1.1、 胚胎干细胞
胚胎干细胞是骨组织再生修复的种子细胞之一, 它是一种多能干细胞, 其高表达OCT4、c MYC、KLF44、NANOG、SOX2等干细胞特异性分子[13], 具有无限的自我更新能力和多向分化潜能, 在特定环境和细胞因子的作用下, 可以定向分化为骨细胞[14]。Bielby等[15]在体外将小鼠胚胎干细胞培养在含有抗坏血酸、β-甘油磷酸盐和地塞米松的培养液中, 发现小鼠胚胎干细胞具有成骨分化能力, 此外, 他们将人胚胎干细胞复合到聚乳酸支架内, 然后植入到裸鼠体内35 d, 通过von Kossa染色发现存在矿化组织, 而且没有任何畸胎瘤形成的痕迹。另外也有学者在体外将小鼠胚胎干细胞诱导为软骨组织, 然后将其植入免疫缺陷小鼠的皮下, 在这个已经分化的基础上, 21 d后有成骨细胞的出现以及层状骨形成[16]。Liu等[6]研究了人胚胎干细胞在大鼠颅骨严重缺损中的体内骨再生作用, 首先将人胚胎干细胞诱导成间充质干细胞, 进而与碳酸钙结合植入大鼠体内, 结果发现碱性磷酸酶、骨钙素的基因表达以及矿化能力都得到增强。Hwang等[17]、Kuznetsov等[18]、Both等[19]也都证明了胚胎干细胞能够成骨分化, 进而促进骨缺损修复。关于胚胎干细胞在口腔方面的应用, 有学者体外将胚胎干细胞诱导分化为拟胚体细胞, 然后与牙髓成纤维细胞共培养, 15 d后发现ALP、COLIA2、DSPP的表达逐渐增强, 结果表明拟胚体细胞在一定条件下可以向成牙本质样细胞分化[20]。Zhang等[21]也利用胚胎干细胞成功诱导生成了牙齿-牙周组织复合结构。尽管胚胎干细胞具有良好的成骨能力, 但关于其来源的争议限制了其应用, 其在再生医学中使用还需考虑其他因素, 主要问题是肿瘤的发生、免疫原性以及高纯度的功能分化。畸胎瘤的发生被认为是胚胎干细胞在再生医学中应用的主要限制之一, 为了避免这一问题, 研究人员提出先将胚胎干细胞定向分化成所需的细胞类型。然而这就面临着细胞分化的纯度问题[22]。虽然将胚胎干细胞进行体外分化被认为是一种更安全的方法, 但这些分化的细胞在移植用于再生目的时, 会在活体组织中引起免疫反应[23]。虽然可以应用免疫抑制剂来抑制胚胎干细胞移植后产生的免疫反应, 但也保证不了绝对的安全, 再加上胚胎干细胞来源有限, 其在口腔骨组织缺损修复中的应用受到了一定的约束。目前胚胎干细胞在骨损伤修复中的应用还处于初期研究阶段, 还不能得出其临床应用的确切结论, 特别是在口腔方面。
2.1.2、 间充质干细胞
口腔中含有多种具有成骨潜能的间充质干细胞, 牙髓、牙囊、牙根尖乳头、牙周韧带以及牙龈中均可发现间充质干细胞[24,25]。这些细胞的增殖活性和成骨能力是不同的。早在2003年, Miura等[26]首次从脱落乳牙的牙髓组织中发现并分离出具有高分化潜能的脱落乳牙干细胞 (stem cell from human exfoliated deciduous teeth, SHED) 。在体外, 脱落乳牙干细胞的克隆率、增殖率都要高于骨髓间充质干细胞, 而且脱落乳牙干细胞更容易获取且损伤最小, 另外研究人员也发现低温冷冻保存脱落的乳牙比恒牙更具有可行性[27]。关于脱落乳牙干细胞在体内的研究, Behnia等[28]将冻存5年的脱落乳牙干细胞移植到犬下颌骨缺损模型中, 发现其仍然具有增殖活力和促进成骨分化的能力, 并且无任何免疫排斥反应。Seo等[29]将脱落乳牙干细胞植入到裸鼠皮下, 能够产生非板层骨和牙本质样结构。也有学者应用组织工程技术将脱落乳牙干细胞与三维聚乳酸羟基乙酸支架结合植入到小鼠下颌骨缺损模型中, 1个月后处死动物, 发现缺损处有新骨形成, 且实验整个过程中小鼠无任何不良反应[30], 这也就提示脱落乳牙干细胞在口腔骨组织中具有很大的应用前景。
根尖乳头间充质干细胞来源于牙根尖乳头, 它的成骨分化能力要弱于牙髓间充质干细胞[31]。与骨髓间充质干细胞相比, 尽管牙髓间充质干细胞高表达干性标志物OCT4, 但是骨髓间充质干细胞具有更强的成骨能力[32]。而且, 与牙髓间充质干细胞相比, 骨髓间充质干细胞和滑膜干细胞的碱性磷酸酶活性和骨再生能力更强[33]。此外, 骨髓间充质干细胞释放的可溶性生长因子在诱导人牙髓细胞成骨分化方面非常有效[34]。虽然外源性骨髓间充质干细胞更适合骨再生, 但其也意味着相对侵袭性较强, 对患者存在潜在风险[35]。
口腔骨组织再生修复与局部微环境有关, 口腔局部微环境能够影响干细胞的增殖活性和成骨分化潜能。体外研究结果表明骨髓间充质干细胞和牙髓间充质干细胞在局部p H值较低时成骨能力和再生能力下降[36]。牙周病是导致牙齿缺失和牙槽骨缺损的一个重要原因, 这类患者的口腔干细胞数量减少。另外, 由于局部炎症, 这些细胞的再生能力也较低。Han等[37]将重组人IGFBP5蛋白转入到牙周韧带干细胞 (periodontal ligament stem cells, PDLSCs) 中, 结果表明其增殖能力增强, 而且在体内成骨分化能力也增强。影响口腔干细胞成骨分化的主要因素是促炎微环境, 实验表明骨髓间充质干细胞在体外条件下具有更好的耐受性[38]。将骨髓间充质干细胞和牙周韧带干细胞在富含肿瘤坏死因子α的培养基中培养14 d, 牙周韧带干细胞的Runx2基因表达水平降低, 碱性磷酸酶活性下降, 而骨髓间充质干细胞的相应成骨蛋白表达要高于牙周韧带干细胞[39]。成人口腔中革兰阴性菌分泌的脂多糖是通过与Toll样受体4的结合, 而激活NF-κB通路, 从而下调牙周韧带干细胞的成骨分化能力, 然而骨髓间充质干细胞的成骨分化能力并未受到影响[40]。
为了提高口腔干细胞的骨再生能力, Jin等[41]将下颌骨骨髓间充质干细胞和牙周韧带细胞体外共培养, 发现下颌骨来源的骨髓间充质干细胞能够增强牙周韧带细胞的成骨能力。将牙周韧带细胞和骨髓间充质干细胞共同复合于海藻酸钙水凝胶中, 研究发现这2种干细胞在成骨分化方面具有相辅相成的效果[42]。Zorin等[43]报道了牙龈源性间充质干细胞和骨髓间充质干细胞具有相同程度的成骨分化能力。尽管牙龈源性间充质干细胞的成骨分化能力仅在少数研究中得到评估, 但有研究表明其能够分泌大量牙釉质基质衍生物, 这将有助于促进牙龈源性间充质干细胞成骨分化[7]。另外将牙周韧带细胞与脂肪细胞来源的诱导性多能干细胞共培养, 可增强诱导性多能干细胞中成骨标志物 (RUNX2、ALP、PPARγ2、Sox9) 的表达[44]。牙槽骨骨髓源性间充质干细胞可能是侵袭性较低的骨髓间充质干细胞, 在小鼠体内研究表明其成骨分化能力较强[45]。Cai等[46]报道了将干细胞在体外定向分化以后再植入骨缺损处, 其修复效果不如干细胞直接移入骨缺损。不同的细胞在不同的微环境下具有不同的功能, 而且在炎症条件下有不同的机制控制其功能的变化, 抑制Wnt信号通路可促进牙周韧带细胞的成骨分化, 而骨髓间充质干细胞的成骨功能则会降低[38]。目前间充质干细胞在骨损伤修复中的应用很多, 但还缺乏统一的标准, 干细胞在临床骨缺损修复的应用中还面临着安全性、有效性、可控性等问题需要解决。
2.1.3、 诱导性多能干细胞
在一个成年生物体中, 分化细胞的可用性和数量都大于干细胞, 因此诱导性多能干细胞为组织再生提供了巨大的潜力。Choi等[47]利用病毒将4个转录因子 (OCT3/4、SOX2、KLF4和c-MYC) 转入到牙龈组织成纤维细胞中, 体外使其重新编程为多能干细胞, 然后将多能干细胞在成骨培养基中进行培养, 28 d后发现有骨细胞的形成。Wang等[48]将诱导性多能干细胞复合水凝胶在体外培养, 结果显示诱导性多能干细胞展现出了与人脐带间充质干细胞相类似的成骨能力。Yin等[49]体内实验结果表明, 在生长/分化因子5 (GDF5) 的作用下, 来自牙龈组织的诱导性多能干细胞比骨髓间充质干细胞成骨分化能力更强。骨形态发生蛋白2、骨形态发生蛋白7、转化生长因子β和成纤维细胞生长因子等均能促进诱导性多能干细胞成骨分化[50]。
利用诱导性多能干细胞修复口腔骨缺损 (主要是牙槽骨) 的研究已经有很多, Duan等[51]体外实验结果表明, 釉质基质衍生物能够促进诱导性多能干细胞Runx2和OSX的基因表达, 这也就提示釉质基质衍生物与诱导性多能干细胞的联合使用可以为口腔骨组织损伤修复提供一种新方法。Chien等[52]将骨形态发生蛋白6转入大鼠成纤维细胞中, 将构建的诱导性多能干细胞复合水凝胶移植到大鼠上颌骨磨牙缺损处, 6周后发现缺损得到修复。Jamal等[53]报道了转染骨形态发生蛋白6的诱导性多能干细胞能够减少炎症反应并刺激上颌磨牙骨缺损的再生。Hynes等[54]将诱导性多能干细胞应用于牙周炎小鼠, 研究发现诱导性多能干细胞可以减少炎症反应引起的骨质流失。成体细胞逆转为具有干细胞功能的能力各不相同, 这主要取决于诱导性多能干细胞的自我更新能力。例如, 牙龈成纤维细胞在培养中能够进行多达50次传代, 而皮肤成纤维细胞只能进行几次传代, 这使得牙龈成纤维细胞成为成体细胞重新编程的良好种子细胞选择[55]。新生骨组织的血管化很重要, 研究表明将磷酸钙支架与3种细胞 (周细胞、血管内皮细胞、诱导性多能干细胞) 一起植入比单独使用其中1种或2种细胞更能有效促进骨再生[56]。Chen等[57]研究发现将诱导性多能干细胞与人内皮细胞在磷酸钙支架上共培养时, 其新生骨和血管再生能力与骨髓间充质干细胞类似。
microRNAs (miRNAs) 是目前癌症诊断和治疗中广泛探索的非编码小序列, 能够调控基因的多样性[58]。Farhang等[59]利用CRISPR/Cas9靶向白细胞介素1受体1来改变白细胞介素1信号通路, 从而设计出抗炎作用的诱导性多能干细胞。腺病毒介导的基因治疗增强了自体骨髓间充质干细胞中骨形态发生蛋白2和Pluronic F127 (PF127) 基因的表达, 成功地实现了包括牙槽骨在内的牙周组织的再生[60]。以下将对不同类型干细胞的特征总结于表1[61,62,63,64,65,66,67,68]。
2.2、 干细胞的成骨潜能及其与病理的关系
考虑到干细胞在临床中应用时, 最主要的担忧是致癌风险[69]。目前对于这方面的研究还存在一定的分歧, 有些研究者发现间充质干细胞对恶性肿瘤的形成具有抑制作用, 而另一些研究则强调间充质干细胞对肿瘤的形成有促进作用[70]。此外, 诱导性多能干细胞通常被认为是一种“危险”的干细胞, 因为它们的基因组不稳定, 可能会发生恶性转化[71]。最近的一项研究表明, 来自正常牙龈组织的间充质干细胞能分泌可溶性因子, 其可以促进促凋亡基因p-JNK、cleaved PARP、cleaved caspase-3、Bax过表达, 并下调抑凋亡基因p-ERK1/2、Bcl-2、CDK4、cyclin D1、PCNA、survivin的表达, 从而可以抑制口腔癌的发展[72]。Katagiri等[73]报道了间充质干细胞首次应用于人牙槽骨的修复, 并无局部或全身不良反应的发生, 且能够促进骨再生。就目前来看, 在使用间充质干细胞的临床试验研究中尚未发现恶性肿瘤的发生。
表1 用于再生医学的不同类型干细胞的特征

表注:+:低;++:中;+++:高。
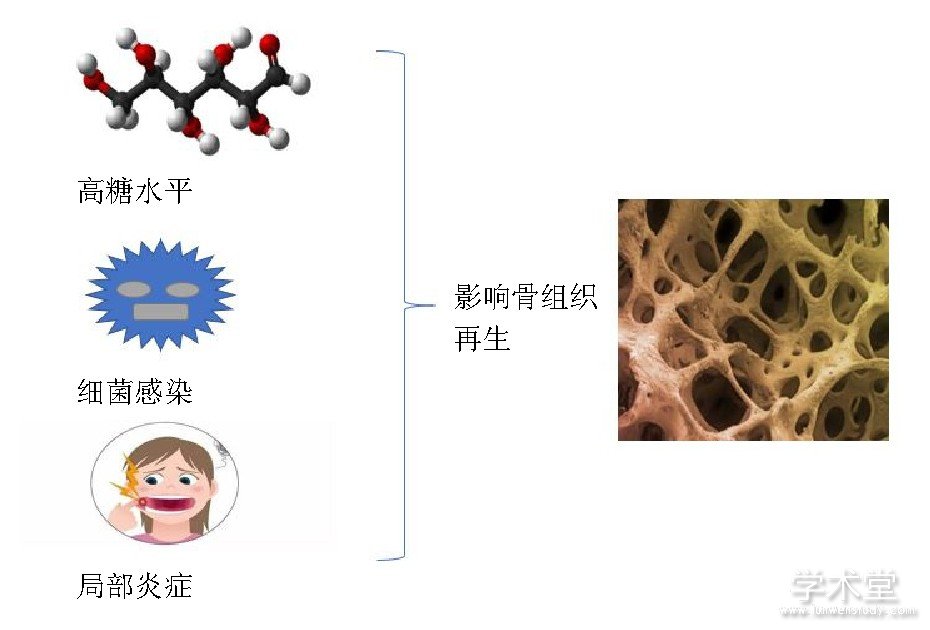
糖尿病是牙周病的主要危险因素, 牙周韧带干细胞在牙周组织再生中起着重要作用, Kato等[74]用人牙周韧带干细胞和高糖培养基体外模拟糖尿病微环境, 探讨高血糖对牙周组织再生的影响, 结果发现高糖培养基抑制了牙周韧带干细胞向成骨细胞的增殖和分化。Yan等[75]发现高糖抑制牙髓干细胞的增殖分化以及成骨能力。虽然干细胞的成骨能力受机体局部微环境的影响, 但是研究发现牙髓干细胞和牙龈源性间充质干细胞在炎症组织中增殖率更高, 细胞骨架标志物profilin-1、cofilin-1、vinculin和热休克蛋白 (HSP90和HSPA9) 表达水平也要高于健康组织中的间充质干细胞[76]。另外, 间充质干细胞暴露于富含促炎因子环境时, 骨钙素、Runx2、血管内皮生长因子和血管生成素也会上调[77]。Liu等[38]体外实验发现肿瘤坏死因子α能够通过调节Wnt信号通路来抑制牙周韧带干细胞的成骨分化, 且这种抑制程度超过骨髓间充质干细胞, 这主要是因为炎症条件下DKK-1可阻断典型的Wnt通路, 重建牙周韧带干细胞成骨分化, 而Wnt3a激活可促进骨髓间充质干细胞成骨分化。Yamawaki等[78]发现碱性磷酸酶的活性随着葡萄糖浓度的升高而降低, 另外高葡萄糖浓度情况下增加了骨组织的形成, 但矿化组织的质量下降, 且组织结构紊乱。牙龈卟啉单胞菌 (P.gingivalis, P.g) 脂多糖诱导促炎症细胞因子产生, 如白细胞介素1、白细胞介素6和白细胞介素8, 进而导致牙周组织破坏, 另外脂多糖能够促进牙周韧带干细胞的增殖, 抑制牙周韧带干细胞的碱性磷酸酶活性、COL1A1、骨钙素的产生及矿化, 但是不影响细胞表面干细胞标记[79,80]。不同干细胞的成骨分化能力在不同的病理状态不尽相同, 不同病理状态对干细胞成骨潜能的影响, 见表2, 图3[38,74,75,78,79,80,81]。
3 、总结Conclusions
目前, 组织工程在再生医学领域具有巨大的发展潜力, 为应用干细胞治疗骨相关疾病提供了重要基础, 但是对于干细胞的选择还没有标准化, 间充质干细胞移植修复骨缺损拥有广泛的应用前景, 从伦理道德角度来看, 胚胎干细胞似乎不适合作为种子细胞应用到组织工程;从客观的角度来看, 由于诱导多能干细胞收获方法的最小侵入性和较高的可用性, 对于口腔骨再生而言, 似乎是较合适的细胞类型, 然而, 诱导多功能干细胞的免疫原性以及致瘤性在一定程度上限制了其在临床上的应用;从再生能力、收集方法以及储存潜能方面来看, 脱落乳牙源性干细胞可能是一个较为理想的种子细胞选择。但是鉴于不同来源的干细胞其分化能力不同, 在进行种子细胞选择时, 研究人员和临床医生应仔细权衡不同干细胞的有效性和收集方法的可用性以及侵袭性, 同时还要考虑到所使用条件以及病理的影响。
表2 不同病理状态对干细胞成骨潜能的影响

图3 病理状态下对骨组织再生的影响
参考文献
[1]Intini G, Katsuragi Y, Kirkwood KL, et al.Alveolar bone loss:mechanisms, potential therapeutic targets, and interventions.Adv Dent Res.2014;26 (1) :38-46.
[2] Sakkas A, Wilde F, Heufelder M, et al.Autogenous bone grafts in oral implantology-is it still a"gold standard"?A consecutive review of 279patients with 456 clinical procedures.Int J Implant Dent.2017;3 (1) :23.
[3]Sheikh Z, Hamdan N, Ikeda Y, et al.Natural graft tissues and synthetic biomaterials for periodontal and alveolar bone reconstructive applications:a review.Biomater Res.2017;21:9.
[4]Zhang Z.Bone regeneration by stem cell and tissue engineering in oral and maxillofacial region.Front Med.2011;5 (4) :401-413.
[5] Euler de Souza Lucena E, Guzen FP, Lopes de Paiva Cavalcanti JR, et al.Experimental considerations concerning the use of stem cells and tissue engineering for facial nerve regeneration:a systematic review.J Oral Maxillofac Surg.2014;72 (5) :1001-1012.
[6]Liu X, Wang P, Chen W, et al.Human embryonic stem cells and macroporous calcium phosphate construct for bone regeneration in cranial defects in rats.Acta Biomater.2014;10 (10) :4484-4493.
[7] Wu SM, Chiu HC, Chin YT, et al.Effects of enamel matrix derivative on the proliferation and osteogenic differentiation of human gingival mesenchymal stem cells.Stem Cell Res Ther.2014;5 (2) :52.
[8] Hodgkinson CP, Gomez JA, Mirotsou M, et al.Genetic engineering of mesenchymal stem cells and its application in human disease therapy.Hum Gene Ther.2010;21 (11) :1513-1526.
[9]Oldershaw RA.Cell sources for the regeneration of articular cartilage:the past, the horizon and the future.Int J Exp Pathol.2012;93 (6) :389-400.
[10]Fahy N, de Vries-van Melle ML, Lehmann J, et al.Human osteoarthritic synovium impacts chondrogenic differentiation of mesenchymal stem cells via macrophage polarisation state.Osteoarthritis Cartilage.2014;22 (8) :1167-1175.
[11]朱瑜琪, 王金荣, 王智耀.间充质干细胞促进关节软骨的修复与再生[J].中国组织工程研究, 2015, 19 (50) :8195-8200.
[12] Buduru SD, Gulei D, Zimta AA, et al.The Potential of Different Origin Stem Cells in Modulating Oral Bone Regeneration Processes.Cells.2019;8 (1) :E29.
[13] Andrews PW, Benvenisty N, McKay R, et al.The International Stem Cell Initiative:toward benchmarks for human embryonic stem cell research.Nat Biotechnol.2005;23 (7) :795-797.
[14] Nishikawa S, Jakt LM, Era T.Embryonic stem-cell culture as a tool for developmental cell biology.Nat Rev Mol Cell Biol.2007;8 (6) :502-507.
[15] Bielby RC, Boccaccini AR, Polak JM, et al.In vitro differentiation and in vivo mineralization of osteogenic cells derived from human embryonic stem cells.Tissue Eng.2004;10 (9-10) :1518-1525.
[16] Aldahmash A, Atteya M, Elsafadi M, et al.Teratoma formation in immunocompetent mice after syngeneic and allogeneic implantation of germline capable mouse embryonic stem cells.Asian Pac J Cancer Prev.2013;14 (10) :5705-5711.
[17] Hwang NS, Varghese S, Lee HJ, et al.Biomaterials directed in vivo osteogenic differentiation of mesenchymal cells derived from human embryonic stem cells.Tissue Eng Part A.2013;19 (15-16) :1723-1732.
[18] Kuznetsov SA, Cherman N, Robey PG.In vivo bone formation by progeny of human embryonic stem cells.Stem Cells Dev.2011;20 (2) :269-287.
[19] Both SK, van Apeldoorn AA, Jukes JM, et al.Differential bone-forming capacity of osteogenic cells from either embryonic stem cells or bone marrow-derived mesenchymal stem cells.J Tissue Eng Regen Med.2011;5 (3) :180-190.
[20]江中明, 季佩红, 刘军, 等.小鼠胚胎干细胞向成牙本质样细胞的诱导分化[J].上海口腔医学.2006, 15 (6) :653-656.
[21]Zhang Y, Li Y, Shi R, et al.Generation of tooth-periodontium complex structures using high-odontogenic potential dental epithelium derived from mouse embryonic stem cells.Stem Cell Res Ther.2017;8 (1) :141.
[22]Tomioka I, Honma Y, Sasada H, et al.In Vitro Induction of Potential Primordial Germ Cells from Mouse Embryonic Stem Cells by Culture with Undifferentiated Gonadal Cells.J Mamm Ova Res.2008, 25 (1) :37-43.
[23] English K, Wood KJ.Immunogenicity of embryonic stem cell-derived progenitors after transplantation.Curr Opin Organ Transplant.2011;16 (1) :90-95.
[24] Estrela C, Alencar AH, Kitten GT, et al.Mesenchymal stem cells in the dental tissues:perspectives for tissue regeneration.Braz Dent J.2011;22 (2) :91-98.
[25]Yang H, Gao LN, An Y, et al.Comparison of mesenchymal stem cells derived from gingival tissue and periodontal ligament in different incubation conditions.Biomaterials.2013;34 (29) :7033-7047.
[26] Miura M, Gronthos S, Zhao M, et al.SHED:stem cells from human exfoliated deciduous teeth.Proc Natl Acad Sci U S A.2003;100 (10) :5807-5812.
[27]Lindemann D, Werle SB, Steffens D, et al.Effects of cryopreservation on the characteristics of dental pulp stem cells of intact deciduous teeth.Arch Oral Biol.2014;59 (9) :970-976.
[28] Behnia A, Haghighat A, Talebi A, et al.Transplantation of stem cells from human exfoliated deciduous teeth for bone regeneration in the dog mandibular defect.World J Stem Cells.2014;6 (4) :505-510.
[29]Seo BM, Sonoyama W, Yamaza T, et al.SHED repair critical-size calvarial defects in mice.Oral Dis.2008;14 (5) :428-434.
[30]Vakhrushev IV, Antonov EN, Popova AV, et al.Design of tissue engineering implants for bone tissue regeneration of the basis of new generation polylactoglycolide scaffolds and multipotent mesenchymal stem cells from human exfoliated deciduous teeth (SHED cells) .Bull Exp Biol Med.2012;153 (1) :143-147.
[31] Cantore S, Ballini A, De Vito D, et al.Characterization of human apical papilla-derived stem cells.J Biol Regul Homeost Agents.2017;31 (4) :901-910.
[32] Aghajani F, Hooshmand T, Khanmohammadi M, et al.Comparative Immunophenotypic Characteristics, Proliferative Features, and Osteogenic Differentiation of Stem Cells Isolated from Human Permanent and Deciduous Teeth with Bone Marrow.Mol Biotechnol.2016;58 (6) :415-427.
[33] Isobe Y, Koyama N, Nakao K, et al.Comparison of human mesenchymal stem cells derived from bone marrow, synovial fluid, adult dental pulp, and exfoliated deciduous tooth pulp.Int J Oral Maxillofac Surg.2016;45 (1) :124-131.
[34] Al-Sharabi N, Xue Y, Fujio M, et al.Bone marrow stromal cell paracrine factors direct osteo/odontogenic differentiation of dental pulp cells.Tissue Eng Part A.2014;20 (21-22) :3063-3072.
[35] Ichiyanagi T, Anabuki K, Nishijima Y, et al.Isolation of mesenchymal stem cells from bone marrow wastes of spinal fusion procedure (TLIF) for low back pain patients and preparation of bone dusts for transplantable autologous bone graft with a serum glue.Biosci Trends.2010;4 (3) :110-118.
[36]Massa A, Perut F, Chano T, et al.The effect of extracellular acidosis on the behaviour of mesenchymal stem cells in vitro.Eur Cell Mater.2017;33:252-267.
[37]Han N, Zhang F, Li G, et al.Local application of IGFBP5 protein enhanced periodontal tissue regeneration via increasing the migration, cell proliferation and osteo/dentinogenic differentiation of mesenchymal stem cells in an inflammatory niche.Stem Cell Res Ther.2017;8 (1) :210.
[38] Liu W, Konermann A, Guo T, et al.Canonical Wnt signaling differently modulates osteogenic differentiation of mesenchymal stem cells derived from bone marrow and from periodontal ligament under inflammatory conditions.Biochim Biophys Acta.2014;1840 (3) :1125-1134.
[39]Zhang J, Li ZG, Si YM, et al.The difference on the osteogenic differentiation between periodontal ligament stem cells and bone marrow mesenchymal stem cells under inflammatory microenviroments.Differentiation.2014;88 (4-5) :97-105.
[40] Li C, Li B, Dong Z, et al.Lipopolysaccharide differentially affects the osteogenic differentiation of periodontal ligament stem cells and bone marrow mesenchymal stem cells through Toll-like receptor 4mediated nuclear factorκB pathway.Stem Cell Res Ther.2014;5 (3) :67.
[41] Jin Z, Feng Y, Liu H.Conditioned media from differentiating craniofacial bone marrow stromal cells influence mineralization and proliferation in periodontal ligament stem cells.Hum Cell.2016;29 (4) :162-175.
[42] Chen L, Shen R, Komasa S, et al.Drug-Loadable Calcium Alginate Hydrogel System for Use in Oral Bone Tissue Repair.Int J Mol Sci.2017;18 (5) :E989.
[43]Zorin VL, Komlev VS, Zorina AI, et al.Octacalcium phosphate ceramics combined with gingiva-derived stromal cells for engineered functional bone grafts.Biomed Mater.2014;9 (5) :055005.
[44]Tansriratanawong K, Tamaki Y, Ishikawa H, et al.Co-culture with periodontal ligament stem cells enhances osteogenic gene expression in de-differentiated fat cells.Hum Cell.2014;27 (4) :151-161.
[45] Mason S, Tarle SA, Osibin W, et al.Standardization and safety of alveolar bone-derived stem cell isolation.J Dent Res.2014;93 (1) :55-61.
[46]Cai X, Yang F, Yan X, et al.Influence of bone marrow-derived mesenchymal stem cells pre-implantation differentiation approach on periodontal regeneration in vivo.J Clin Periodontol.2015;42 (4) :380-389.
[47]Choi H, Park KH, Lee AR, et al.Control of dental-derived induced pluripotent stem cells through modified surfaces for dental application.Acta Odontol Scand.2017;75 (5) :309-318.
[48] Wang L, Zhang C, Li C, et al.Injectable calcium phosphate with hydrogel fibers encapsulating induced pluripotent, dental pulp and bone marrow stem cells for bone repair.Mater Sci Eng C Mater Biol Appl.2016;69:1125-1136.
[49]Yin X, Li P, Li Y, et al.Growth/differentiation factor-5 promotes in vitro/vivo periodontal specific differentiation of induced pluripotent stem cell-derived mesenchymal stem cells.Exp Ther Med.2017;14 (5) :4111-4117.
[50]Vo TN, Kasper FK, Mikos AG.Strategies for controlled delivery of growth factors and cells for bone regeneration.Adv Drug Deliv Rev.2012;64 (12) :1292-1309.
[51] Duan X, Tu Q, Zhang J, et al.Application of induced pluripotent stem (iPS) cells in periodontal tissue regeneration.J Cell Physiol.2011;226 (1) :150-157.
[52] Chien KH, Chang YL, Wang ML, et al.Promoting Induced Pluripotent Stem Cell-driven Biomineralization and Periodontal Regeneration in Rats with Maxillary-Molar Defects using Injectable BMP-6 Hydrogel.Sci Rep.2018;8 (1) :114.
[53]Jamal M, Lewandowski SL, Lawton ML, et al.Derivation and characterization of putative craniofacial mesenchymal progenitor cells from human induced pluripotent stem cells.Stem Cell Res.2018;33:100-109.
[54]Hynes K, Bright R, Marino V, et al.Potential of iPSC-Derived Mesenchymal Stromal Cells for Treating Periodontal Disease.Stem Cells Int.2018;2018:2601945.
[55] Yu G, Okawa H, Okita K, et al.Gingival Fibroblasts as Autologous Feeders for Induced Pluripotent Stem Cells.J Dent Res.2016;95 (1) :110-118.
[56]Zhang C, Hu K, Liu X, et al.Novel hiPSC-based tri-culture for pre-vascularization of calcium phosphate scaffold to enhance bone and vessel formation.Mater Sci Eng C Mater Biol Appl.2017;79:296-304.
[57]Chen W, Liu X, Chen Q, et al.Angiogenic and osteogenic regeneration in rats via calcium phosphate scaffold and endothelial cell co-culture with human bone marrow mesenchymal stem cells (MSCs) , human umbilical cord MSCs, human induced pluripotent stem cell-derived MSCs and human embryonic stem cell-derived MSCs.J Tissue Eng Regen Med.2018;12 (1) :191-203.
[58]Redis RS, Berindan-Neagoe I, Pop VI, et al.Non-coding RNAs as theranostics in human cancers.J Cell Biochem.2012;113 (5) :1451-1459.
[59] Farhang N, Brunger JM, Stover JD, et al.CRISPR-Based Epigenome Editing of Cytokine Receptors for the Promotion of Cell Survival and Tissue Deposition in Inflammatory Environments.Tissue Eng Part A.2017;23 (15-16) :738-749.
[60] Chen YL, Chen PK, Jeng LB, et al.Periodontal regeneration using ex vivo autologous stem cells engineered to express the BMP-2 gene:an alternative to alveolaplasty.Gene Ther.2008;15 (22) :1469-1477.
[61]Mahla RS.Stem Cells Applications in Regenerative Medicine and Disease Therapeutics.Int J Cell Biol.2016;2016:6940283.
[62] Kim HJ, Park JS.Usage of Human Mesenchymal Stem Cells in Cell-based Therapy:Advantages and Disadvantages.Dev Reprod.2017;21 (1) :1-10.
[63] Srinivasan S, Jayasree R, Chennazhi KP, et al.Biocompatible alginate/nano bioactive glass ceramic composite scaffolds for periodontal tissue regeneration.Carbohydrate Polymers.2012;87 (1) :274-283.
[64]Wan M, Du W, Zhou X, et al.Stem Cell-based Tooth Engineering and their Potential in Dental Medicine.Curr Stem Cell Res Ther.2015;10 (5) :443-449.
[65] Chalisserry EP, Nam SY, Park SH, et al.Therapeutic potential of dental stem cells.J Tissue Eng.2017;8:2041731417702531.
[66]Diniz IM, Chen C, Ansari S, et al.Gingival Mesenchymal Stem Cell (GMSC) Delivery System Based on RGD-Coupled Alginate Hydrogel with Antimicrobial Properties:A Novel Treatment Modality for Peri-Implantitis.J Prosthodont.2016;25 (2) :105-115.
[67] Singh VK, Kalsan M, Kumar N, et al.Induced pluripotent stem cells:applications in regenerative medicine, disease modeling, and drug discovery.Front Cell Dev Biol.2015;3:2.
[68] Medvedev SP, Shevchenko AI, Zakian SM.Induced Pluripotent Stem Cells:Problems and Advantages when Applying them in Regenerative Medicine.Acta Naturae.2010;2 (2) :18-28.
[69] Lee HY, Hong IS.Double-edged sword of mesenchymal stem cells:Cancer-promoting versus therapeutic potential.Cancer Sci.2017;108 (10) :1939-1946.
[70] Takeda D, Hasegawa T, Ueha T, et al.Induced Pluripotent-stem-cell Related Genes Contribute to De-differentiation in Oral Squamous Cell Carcinoma.Anticancer Res.2017;37 (3) :1075-1082.
[71] Liang Y, Zhang H, Feng QS, et al.The propensity for tumorigenesis in human induced pluripotent stem cells is related with genomic instability.Chin J Cancer.2013;32 (4) :205-212.
[72]Ji X, Zhang Z, Han Y, et al.Mesenchymal stem cells derived from normal gingival tissue inhibit the proliferation of oral cancer cells in vitro and in vivo.Int J Oncol.2016;49 (5) :2011-2022.
[73] Katagiri W, Osugi M, Kawai T, et al.First-in-human study and clinical case reports of the alveolar bone regeneration with the secretome from human mesenchymal stem cells.Head Face Med.2016;12:5.
[74] Kato H, Taguchi Y, Tominaga K, et al.High Glucose Concentrations Suppress the Proliferation of Human Periodontal Ligament Stem Cells and Their Differentiation Into Osteoblasts.J Periodontol.2016;87 (4) :e44-51.
[75]Yan L, Sun S, Qu L.Insulin-like growth factor-1 promotes the proliferation and odontoblastic differentiation of human dental pulp cells under high glucose conditions.Int J Mol Med.2017;40 (4) :1253-1260.
[76]Tomasello L, Mauceri R, Coppola A, et al.Mesenchymal stem cells derived from inflamed dental pulpal and gingival tissue:a potential application for bone formation.Stem Cell Res Ther.2017;8 (1) :179.
[77]Katagiri W, Sakaguchi K, Kawai T, et al.A defined mix of cytokines mimics conditioned medium from cultures of bone marrow-derived mesenchymal stem cells and elicits bone regeneration.Cell Prolif.2017;50 (3) :e12333.
[78]Yamawaki I, Taguchi Y, Komasa S, et al.Effects of glucose concentration on osteogenic differentiation of type II diabetes mellitus rat bone marrow-derived mesenchymal stromal cells on a nano-scale modified titanium.J Periodontal Res.2017;52 (4) :761-771.
[79]Kato H, Taguchi Y, Tominaga K, et al.Porphyromonas gingivalis LPSinhibits osteoblastic differentiation and promotes pro-inflammatory cytokine production in human periodontal ligament stem cells.Arch Oral Biol.2014;59 (2) :167-175.
[80] Albiero ML, Amorim BR, Martins L, et al.Exposure of periodontal ligament progenitor cells to lipopolysaccharide from Escherichia coli changes osteoblast differentiation pattern.J Appl Oral Sci.2015;23 (2) :145-152.
[81] Hong JW, Lim JH, Chung CJ, et al.Immune Tolerance of Human Dental Pulp-Derived Mesenchymal Stem Cells Mediated by CD4?CD25?Fox P3?Regulatory T-Cells and Induced by TGF-β1 and IL-10.Yonsei Med J.2017;58 (5) :1031-1039.
间充质干细胞(Mesenchymalstemcells,MSCs)是成体干细胞的一种,具有多向分化潜能。来源广泛,可从多种组织中分离得到,易于体外扩增培养,应用不涉及伦理问题,副反应少,安全性较高,在组织修复和再生方面的临床应用前景广阔。目前间充质干细胞已用于...
间充质干细胞(MSCs)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层,属于多能干细胞,MSCs最初在骨髓中发现,目前骨髓来源MSCs在临床上应用最广,但仍然存在不少不足,有研究表明成人骨髓中MSCs的含量仅为0.001~0.01%[1],并且骨髓采集...
神经干细胞(NSCs)广泛存在于胚胎和成年哺乳动物中枢神经系统,是一类具有分裂潜能和自我更新能力的前体细胞,它可以通过对称分裂和不对称分裂方式进行自我更新并产生神经组织的各类细胞,包括神经元、星形胶质细胞和少突胶质细胞等[1].NSCs的发现为神经...
外排体(Exosome)是由多种细胞的胞内体衍生而来,通过出芽方式释放到细胞外的一种脂质双层膜性结构〔1〕,大小为40~100nm。由于其携带母细胞成分已逐渐被认为是细胞间进行信息交流,从而产生相互作用的新方式。树突状细胞(DC)作为一种体内分布广泛、最强的抗原提...
间充质干细胞(mesenchymal stem cells,MSCs)具有自我更新、多向分化能力和低免疫原性,可分化为脂肪细胞、骨细胞、软骨细胞、肌肉细胞和骨髓基质细胞等,不仅存在于骨髓,还分布在脂肪,脐带和牙体等组织。...
随着人类基因组计划的不断推进,人们发现90%以上的基因组DNA能转录成RNA,而其中不足2%编码蛋白质[1-2],其余不能编码蛋白质的转录产物被称为非编码RNA(non-codingRNAs,ncRNAs)[3].根据长度不同,ncRNAs可以分为短链ncRNAs和长链ncRNAs(lon...
肠神经嵴干细胞(entericneuralcreststemcells,ENCSCs)来源于迷走神经嵴(vagalcrest,VC)和骶神经嵴(sacralcrest,SC).VC来源的ENCSCs定植于整个消化道,构成肠神经系统的绝大部分肠神经节.该过程发生障碍,将造成肠道不同部位缺乏神经节细胞,局部肠管痉...
磁性纳米材料指尺度为1~100nm的磁性材料,目前以铁系氧化物居多。磁性纳米材料通常在磁性纳米颗粒表面修饰上多种生物大分子或者靶的配体,这样就既具备良好的磁导向性,也具有良好的生物相容性或者靶向性,可与多种功能分子如蛋白质、核酸和维生素等结...
脐带来源的间充质干细胞可在体外培养、扩增, 具有和骨髓来源的间充质干细胞相似的生物形态和抗原表型, 为细胞治疗探索出的新的来源。...
脂肪干细胞(adipose-derivedstemcells)来源于脂肪组织,取材方便、对自体损伤较小,具有自我更新、多向分化能力、自体移植不发生排斥反应等特点,是组织工程中最有应用前景的种子细胞之一。量很低,占3%左右,并且分离出来的细胞纯度不理想[1].因此如...