摘 要: 胚胎干细胞(embryonic stem cells,ESCs)和诱导多能干细胞(induced pluripotent stem cells,iPSCs)是能够进行自我更新和多系分化的细胞系,几乎所有的干细胞都具有这两大特性。干细胞的这种特性受到各类因素的控制和调节,如基因表达调控层面的转录因子调节、RNA层面的可变剪接、蛋白质翻译后修饰以及蛋白质在机体内代谢调控等。其中,蛋白质翻译后修饰(post translational modifications,PTMs)机制之一泛素蛋白酶体系统在调节干细胞自我更新、增殖和分化中起着核心作用。该文综述了泛素动态变化在干细胞自我更新和分化调节中的重要作用,泛素连接酶和去泛素化酶作为泛素蛋白酶体系统中研究最为深入和广泛的酶分子,对于维持干细胞自我更新和分化的蛋白分子稳态有重要作用。该文将重点对去泛素化酶的作用进行总结和归纳,以充分揭示泛素动态调控对干细胞自我更新和分化的贡献。
关键词: 干细胞; 自我更新和分化; 去泛素化酶;
Abstract: ESCs (embryonic stem cells) and iPSCs (induced pluripotent stem cells) are the class of cell lines capable of self-renewal and multi-lineage differentiation.Almost all stem cells possess these two characteristics.This characteristic of stem cells is controlled and regulated by many factors,such as transcription factor regulation at the level of gene expression,mRNA alternative splicing regulation,protein post-translational modification,etc.Given UPS (ubiquitin proteasome system),which is a major machinery as a part of the protein post-translational modifications,has played great roles in the regulation of protein dynamics.There is no doubt UPS plays a key role in regulating the self-renewal,reproduction and differentiation of stem cells.Among the three kinds of enzymes contained in the UPS,the E3 ligases and deubiquitinases are the most researched and highly focused.Here this study concluded the important cellular roles of ubiquitin dynamics in the regulating of stem cell characteristics,focusing on the summary and induction of the role of DUBs (deubiquitinates) in the control of stem cell fate to fully uncover the contribution of ubiquitin dynamics to stem cell self-renewal and differentiation.
Keyword: stem cell; self-renewal and differentiation; deubiquitinase;

1998年,THOMOSON[1]成功从内细胞团和囊胚中分离出人胚胎干细胞(human embryonic stem cells,hESCs)。由于这类细胞具有无限自我更新能力且能被诱导分化成内、中、外三个胚层细胞进而成为成熟细胞的分化潜能而备受青睐。在体内,干细胞的这种分化潜能,一方面受到多能性基因表达和多能性转录因子,如Sox2、含POU结构域的八聚体结合的转录因子4(octamer-binding transcription factor 4,Oct4)(也叫Pou5f1)、Nanog、Kruppel样因子4(kruppel-like factor 4,Klf4)、Lin28和cMyc等的调控;另一方面通过迁移至特定环境,在微环境因子和细胞内的营养因子共同刺激下,促进分化相关基因表达引起细胞分化,最终成为在个体中不同位置发挥作用的细胞、组织、器官[2]。2006年,YAMANAKA[3]将4个转录因子(Sox2、Oct4、Klf4和cMyc)转入成熟体细胞将后者诱导成类似胚胎干细胞功能的多能干细胞(induced pluripotent stem cells,iPSCs),即既能自我更新又能各向分化的细胞类型,这进一步证明了转录因子对于细胞在多能和分化状态之间转换的重要作用。鉴于干细胞在基础研究和临床治疗方面的巨大潜能,针对干细胞的自我更新、生长分化的各类研究迅速增长。作为生命存在基础的中心法则决定了生命基础信息的产生,而各类蛋白质作为中心法则的一般结果,其从生成到降解的各个过程都影响着细胞生命活动,这体现在干细胞里,则对干细胞命运有着巨大影响[4]。基因翻译得来的蛋白,经翻译后修饰,在不同的通路和活动中动态地调控着细胞内各个机器的正常运转,确保了干细胞对于环境中的各类刺激能够快速响应[5],进而决定是增殖还是分化。泛素蛋白酶体系统(ubiquitin proteasome system,UPS)作为生物体内主要的蛋白调节和代谢系统,在干细胞的生长发育中发挥着重要作用,受到广泛关注[6]。
泛素分子是一个拥有76个氨基酸的小蛋白质,能够以单体形式或多聚链形式共价修饰在蛋白底物上。这种修饰造成的拓扑学的构像变化决定了底物后续命运,通常底物可能丧失其稳定性被蛋白酶体机器降解、而或者底物与其他分子结合强弱被改变、又或者在细胞内的定位改变等。泛素化修饰过程通常由3类酶执行:E1泛素激活酶、E2泛素聚合酶和E3泛素连接酶。对于将泛素分子从底物上移去的过程也由一类酶负责执行,其被称为去泛素化酶(deubiquitinase,DUB)。作为泛素化的逆反应过程,去泛素化酶在体内的作用通常有:(1) 帮助未成熟的泛素分子成熟,或从头翻译产生泛素分子;(2) 通过其硫酯键中间体在细胞内进行小的亲核反应参与到蛋白的泛素化过程;(3) 断裂细胞中的暂时无用多聚泛素链,形成泛素单体分子;(4) 解除底物上连接的泛素分子,去除泛素化对底物的作用。因此,去泛素化酶也广泛地参与到蛋白酶体、溶酶体依赖的蛋白降解,基因表达调控,细胞周期调控,细胞分裂时染色体分离,激酶活化,细胞凋亡,蛋白定位,DNA损伤修复,精子发生和中间信号调节分子的降解等[7]多种生命活动过程中。去泛素化酶参与的上述这些事件,与干细胞的自我更新、干细胞“蛰伏”、细胞分化等过程也息息相关[6]。
本文将从基因转录水平—去泛素化酶在染色质核小体上的修饰对于多能性基因或细胞分化相关基因的抑制或激活,翻译后修饰水平—去泛素化酶对于核心多能转录因子稳态调节,以及细胞水平—泛素蛋白酶体系统对于干细胞细胞周期和细胞自噬的调控等方面概括去泛素化酶对于干细胞命运调控的重要意义。
1、组蛋白去泛素化对干细胞基因转录的调节
基因组学和蛋白质组学技术的飞速发展为研究者们认识特异性表达在胚胎干细胞中或者同时存在于其他干细胞种类中的去泛素化酶和E3连接酶的种类提供了研究手段和图谱[8]。干细胞若维持干性则需要干细胞多能性因子的表达或发育相关基因的抑制,体现在染色质水平则是受到一群蛋白分子的调控。基因组双链DNA作为遗传物质载体,在高等真核生物中不是裸露存在的,而是与细胞核内的组蛋白(H1、H2A、H2B、H3、H4)形成致密的染色质。生物体在染色质这个结构平台上完成与DNA相关的生命活动。
染色质的三维结构空间和动态变化为某个基因的表达提供了时间和空间上的独特性。通常认为,PcG(polycomb group)和TrxG(trithorax group)蛋白复合体分别参与了染色质的抑制和激活状态[9]。这种抑制和激活作用保障了发育相关基因不会在特定时间和空间外表达。与甲基化、磷酸化或乙酰化等小尺寸的修饰不同,泛素化修饰将一个或多个约8 kDa的蛋白共价结合在组蛋白上,引起组蛋白构像变化,影响了染色质的结构,进而导致基因的表达调控受到影响。干细胞基因组中,组蛋白的泛素化和去泛素化修饰对干细胞染色质稳态和基因转录进行着重要调节[10]。组蛋白的泛素化通常是单泛素化,泛素化位点具有物种保守性(如H2AK119、H2BK120)。组蛋白H1的泛素连接酶E3通常有环指蛋白RNF8和RNF168,主要参与DNA双链断裂信号调控,组蛋白H3的泛素化被认为在核小体的组装中起作用[11]。如图1所示,组蛋白H2A和H2B的泛素化和去泛素化在调节基因表达方面有重要意义[10]。
1.1、组蛋白H2A的去泛素化
胚胎细胞发生发展过程中,多梳组蛋白(polycomb group,PcG)亚基PRC1(polycomb repressive complex 1,PRC1)和PRC2(polycomb repressive complex 2,PRC2)抑制着细胞生长过程中重要的转录因子基因的表达,PRC2一般会在这些基因上产生H3K27me3转录抑制标记,此标记不会自发引起染色质的聚集,但是会使得其他促进染色质压缩的蛋白(如Eed、Cbx)停泊在这个标记上,而Cbx是PRC1复合体的成分,可以看出,PRC1的存在促进了PRC2对于染色质的压缩,促进异染色质形成[12]。当然,这种异染色质化导致的基因抑制除表现为组蛋白甲基化外也同时存在其他类型的修饰,如磷酸化、糖基化、乙酰化以及本文中描述的泛素化等[13]。PRC1通过其亚基RING1A/B(在鼠中)或RING2(在人中)对组蛋白H2A进行单泛素化,抑制干细胞分化基因的表达[14]。RING1A和RING1B的缺失会导致泛素化的H2A大量降低,细胞丧失胚胎干细胞特性,形态改变,趋向于分化。突变Ring1B(也叫Rnf2)引起早期胚胎发育紊乱,但是通常与其泛素化酶活性的异常无关,说明RING1A/B在体内还存在与其功能相冗余的E3连接酶,过表达E3连接酶(如MDM2、TRIM37、DZIP3等)也会引起H2A的单泛素化水平增加[15]。单泛素化的H2A(表示为ubH2A,后文同)阻碍转录激活标记H3K4me2和H3K4me3的形成,而且会伴随着基因转录激活信号H3K36me2的去甲基化,从而抑制转录起始[16],而且在胚胎干细胞的分化中,多能特异性基因相关组蛋白上两种状态的修饰(H3K4me3和H3K27me3)变成单状态修饰(H3K27me3),多能特异性基因受到表观遗传修饰而沉默[17]。因此,不难理解,H2A的去泛素化酶可能与基因转录激活相关。
图1去泛素化酶通过调控组蛋白的去泛素化调节细胞干性基因和分化基因表达
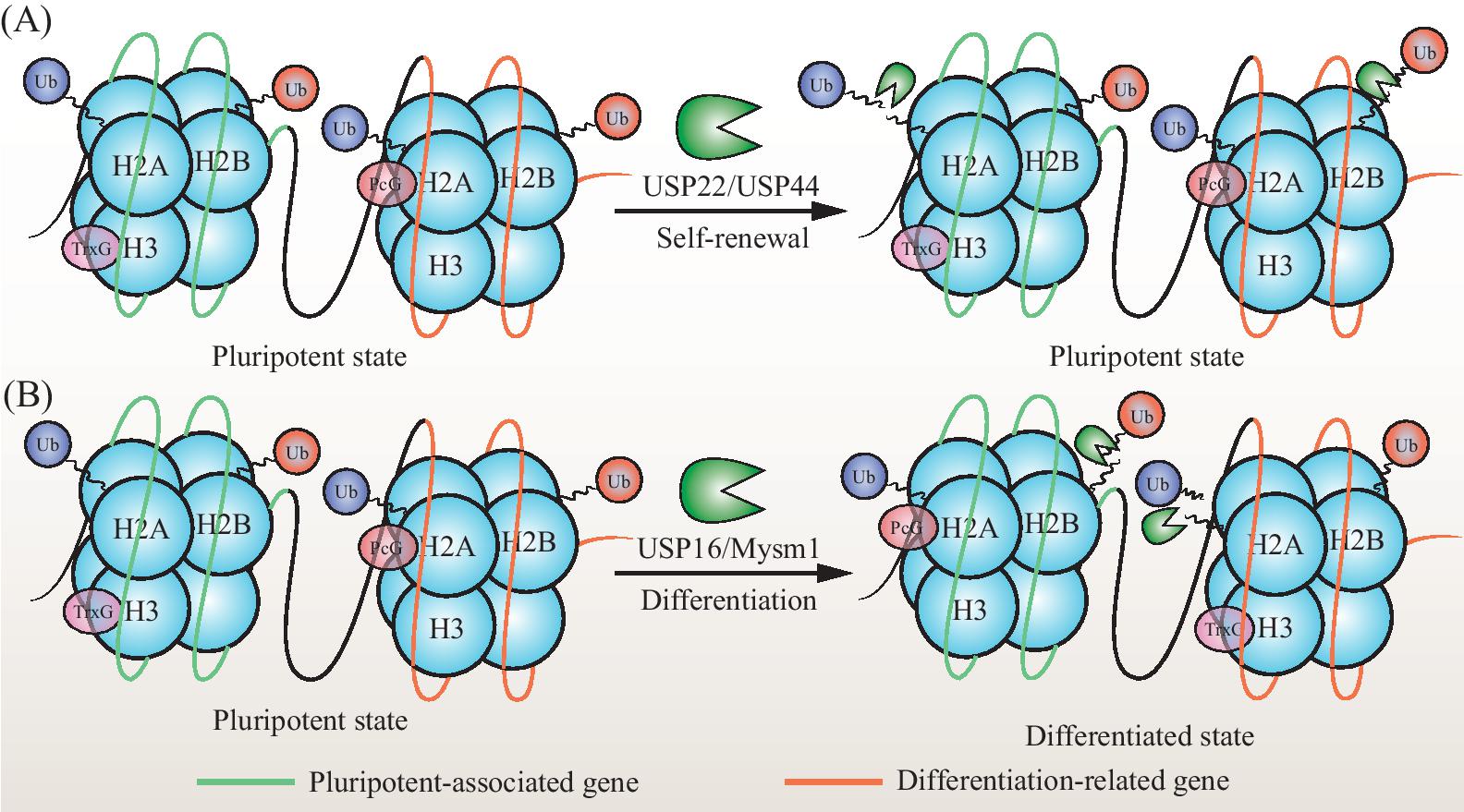
Fig.1 Schematic representation of the stem cell pluripotency associated gene or differentiated gene expressionregulated by deubiquitinates
A:分化相关基因上H2B的泛素化状态被去泛素化酶USP44移除,分化基因发生沉默;而多能性相关基因组蛋白H2A上的泛素化被去泛素化酶USP22移除,细胞多能性基因表达,细胞的干性得到维持,进行自我更新。B:分化相关基因上组蛋白H2A的泛素化状态被去泛素化酶Mysm1和USP16特异性移除,引起分化基因表达,细胞分化。
A:the ubiquitinated state of H2B on the typical differentiation-related genes were removed by the deubiquitination enzyme USP44,and then the differentiation genes were silenced;whereas the ubiquitinated histone H2A on the pluripotency-related genes were deubiquitinated by enzyme USP22,then the genes expressed,these cells keep pluripotency and can be self-renewed.B:the ubiquitinated state of histone H2A on the differentiation-related genes is specifically removed by the deubiquitination enzymes Mysm1 and USP16,causing the expression of differentiation genes and cell differentiation.However,the ubiquitinated histone H2B on the pluripotency-related genes could be reversed by deubiquitinases,which cause pluripotency-related genes expression and then the cell differentiation.
通过免疫共沉淀的方法可以筛选到很多去泛素化酶分子,尤其是在干性转录因子的启动子区,表明去泛素化酶影响着干细胞中染色质的组装和基因表达[11]。对于这些去泛素化酶的研究有助于揭示其在染色质组装和干细胞干性调节中的机制。能够对ubH2A进行去泛素化的DUB分子已有一些报道:如USP16、Mysm1(2A-Dub)、USP21、USP22、USP7、USP11、USP3、BAP1、BRCA36等[18]不同家族的去泛素化酶分子都直接或间接地影响着H2A的泛素化状态。如表达USP16的基因在人21号染色体上,报道称usp16突变是引起唐氏综合征发生的原因之一,具体可能是因为usp16基因含量增加,导致抑制性的ubH2A含量减少,分化基因表达,细胞分化,引起个体早衰。YANG等[19]发现,USP16缺失的ESCs中,因为不能引起相关转录基因上的ubH2A去泛素化而不能进行细胞分化,外源输入有活性的USP16能够挽救USP16缺陷导致的ESCs分化失败现象。间接调节ubH2A的去泛素化酶如USP7和USP11可通过调节PRC1的含量,影响H2A的泛素化[20]。有趣的是,去泛素化酶USP26可以去泛素化稳定PRC1复合体的组分CBX4和CBX6,从而促进H2A的泛素化,导致多能性因子Sox2和Nanog的表达被抑制,负性调控iPSC的重编程[21]。ZHAO等[22]发现,组蛋白乙酰基转移酶(histone acetyltransferases,HAT)复合体具有在基因位点处松弛染色质的功能,而这一功能的实现借助于2 mDa的GCN5含HAT的TFTC/STAGA复合体,此复合体中含有额外的共激活亚基ATXN7L3、USP22和ENY2,均是H2A、H2B的去泛素化酶,去泛素化酶联合HAT TFTC/STAGA复合体中其他成分一起对抗沉默的异染色质,和细胞核受体分子一起激活基因的转录。去泛素化酶还可以通过稳定H2A稳定干性因子的表达,Mysm1是金属蛋白酶家族的去泛素化酶,研究表明Mysm1通过其ubH2A去泛素化酶活性促进雄激素受体靶向基因的表达,若敲除Mysm1基因,小鼠的造血干细胞维持、自我更新和分化均受到影响[23]。泛素C末端水解酶BAP1是一个多功能酶,也具有ubH2A去泛素化酶活性,然而BAP1针对ubH2A的去泛素化酶活性在这个多功能酶复合体中的作用仍不清楚[18]。USP21对ubH2AK119的去泛素化促进肝细胞转录因子的激活,促进肝脏再生[16]。ubH2A在细胞中这种抑制基因转录的作用,表明了其对于干细胞多能性维持是有利的,但是在去泛素化酶Mysm1的研究中,似乎ubH2A对于造血干细胞的稳定起到抑制作用。生物体是一个高度活跃和动态变化的有序机体,每一种状态都受到精确的调控,弄清楚其发生的机制有利于我们更好地理解和解决由这些过程紊乱导致的疾病。
1.2、组蛋白H2B的泛素化
与H2A的泛素化相反,组蛋白H2B的泛素化与基因的转录激活相关。研究人员通过ChIP-on-chip技术揭示,H2B的单泛素化主要集中在一些高频表达的基因的转录区[24]。人RNF20/RNF40复合体是组蛋白H2B的泛素连接酶,组蛋白H2B的泛素化会增加H3K4或H3K79甲基化的水平,促进基因的转录,泛素化的H2B使得染色质中H2B和H2A形成二元复合物,被RNA聚合酶II替代,促进RNA聚合酶II在DNA上的转录延长[25]。而且ubH2B也是催化H3K4me2/me3标志形成的COMPASS复合体(为TrxG蛋白复合体的一种成员)的组成成分,一般认为COMPASS复合体的作用就是促进转录激活。诱导H2BK123泛素化会抑制COMPASS作用,阻碍H3K4me2/me3的形成。上述证据表明,ubH2B有助于基因的转录活化。此外,H2B的单泛素化也是H3K27乙酰化(基因表达标志)的前提条件[26],在PRC1没有被招募时,H3K27的去甲基化酶UTX抑制PRC1的招募,而在PRC1被招募以后,UTX仍然可以减少PRC1对H2A的单泛素化修饰,表明了UTX可以促进基因的转录。当UTX表达量下调时,PRC1复合体中RING finger成分(Bim1和Ring1A蛋白)升高,伴随着HOX基因处H2A单泛素化水平升高[26],基因转录被抑制。泛素化H2A和H2B的这种协同互作对于基因的精细调控意义重大。
ubH2B促进基因的转录依赖于去泛素化酶,如在酵母中,去泛素化酶Ubp8是SAGA乙酰基转移酶复合体的成分,可以去泛素化ubH2B,建立正确的组蛋白甲基化H3K4me和H3K36me形式,一般认为在建立了H3K4me和H3K36me后,招募染色体重塑因子、组蛋白乙酰化或去乙酰化酶以及组蛋白去甲基化酶,随后DNA发生转录延伸。然而,也有研究表明,H2B的单泛素化也会抑制基因的表达,如酵母中另一个去泛素化酶Ubp10也能对ubH2B进行去泛素化,但Ubp10通常在染色质沉默位点维持低水平的H2Bub1和H3K4me/H3K79me,H3K79me3也是端粒酶和核糖体RNA聚集位点,Ubp10通过调节泛素化H2B维持转录抑制性染色质状态[27]。而ubH2B的作用不仅仅在于形成正确的H3K4me结构,还会促进染色质开放,使染色质结构开放,调节核小体的组装和去组装,促进基因转录[28]。
所以,可以看出ubH2B的E3和DUB分子对于基因的激活都是必需的,也表明组蛋白H2B的泛素化去泛素化的动态变化对于基因的表达非常重要。去泛素化酶USP22、USP44和USP7是细胞中反向调控H2B泛素化的去泛素化分子。USP22在基因启动子上完成ubH2B的去泛素化,调节雌雄激素受体介导的基因转录[29]。在肿瘤干细胞中USP22还参与cMyc靶基因的激活[30]。证明了ubH2B在某些情况下也会介导基因的沉默,其去泛素化酶则调节基因的转录激活。USP22是转录复合体SAGA的亚基,也是Ubp8的同源蛋白,SUSSMAN等[31]研究发现,USP22对于胚胎干细胞向三胚层分化有调节作用,USP22抑制Sox2位点基因的转录,并且认为这种抑制作用与USP22对Sox2启动子处ubH2BK200的去泛素化相关。USP44通过介导H2B的去泛素化,导致分化相关基因的转录沉默,维持干细胞干性状态[32]。USP7作为H2B的去泛素化酶,通常也被认为是PRC1复合体的组成部分,控制着H2A的泛素化水平。USP7可以催化H2B的去泛素化,也能和PRC1复合体相互作用调控同源异型基因的沉默[33]。
去泛素化酶对于核小体组蛋白H2A和H2B的这种泛素动态的调节对于基因转录和细胞命运决定起着不可或缺的作用,保证了正常生命活动的进展。
2、去泛素化酶对干细胞特性的调控
干细胞两大特性(即自我更新和多向分化)的发生很大程度上取决于干细胞多能性因子或者分化倾向因子的表达及抑制状态之间的平衡作用。而生命体中对干细胞因子表达的调节一般在两个方面:基因表达层面干细胞多能性基因及其调控基因的复制、转录及翻译;蛋白质层面包括翻译后修饰的加工以及随后的蛋白降解过程。
2.1、去泛素化酶对干细胞转录因子的调控
转录翻译及基因表达层面的调控体现在信号通路中受到一些信号分子的刺激;翻译后修饰(post-translational modifications,PTMs)通过对蛋白合成后的再加工,调控着细胞生理过程。蛋白的翻译后修饰涉及到生命活动的各方面。在干细胞调控中,磷酸化、乙酰化、甲基化、sumo化、泛素化修饰等协调互作,保证了细胞特性的维持或转换。如果把各类修饰比喻成化妆师,则各类修饰作用的底物–细胞转录因子是站在舞台中央“表演”的演员,而整个细胞乃至个体的生命过程则是这场盛大的剧目。各类翻译后修饰中,干细胞转录因子的降解主要受到蛋白代谢通路之一泛素蛋白酶体系统(ubiquitin proteasome system,UPS)的调控,通过泛素化降解或构像变化而发挥不同的作用。决定细胞的多能性状态(分为稳定多能状态,预分化多能状态)或者诱导干细胞走向分化的转录因子同时也受到去泛素化酶的精细调节(图2)。下面将具体展开描述去泛素化酶对主要的干细胞转录因子的调控作用。
2.1.1 、Nanog
Nanog在内细胞团细胞和胚胎干细胞中是调控多能性的重要分子,在没有白细胞抑制因子LIF和转录因子STAT3的情况下能够维持干细胞的自我更新,Nanog与其他的干细胞多能性因子Sox2和Oct4可以构成正负反馈通路共同调节着干细胞的多能性,在哺乳动物体内Nanog的表达调控对于维持生物的正常生长十分重要,缺乏或下调Nanog的表达将导致干细胞分化[34]。在Nanog序列结构N-端47~72位有一个PEST的序列(包含多个P、E、S、T氨基酸),通常会招募泛素化酶对其泛素化随后经蛋白酶体降解,人胚胎干细胞中Nanog的半衰期在120 min[35]。研究表明,泛素连接酶FBXW8(含F框和WD40域的蛋白8)会对Nanog进行多聚泛素化引起其含量降低,导致胚胎干细胞分化[36]。细胞中还存在一些稳定Nanog水平的去泛素化酶。本课题组与其他的一些研究组[37,38,39]均发现,去泛素化酶USP21能够通过去除Nanog上的泛素分子信号,稳定多能干细胞中Nanog的水平,维持干细胞的多能性状态。其中,JIN等[38]的研究显示,USP21不仅在翻译后修饰阶段通过去泛素化稳定Nanog蛋白水平外,还可以在转录水平在Nanog的引导下调节H2A的去泛素化,增加组蛋白H3K4三甲基化(H3K4me3)的水平,正向促进Nanog的转录,增加干细胞中的Nanog含量。更有趣的是,ESCs中的LIF/STAT3信号通路的激活可以促进USP21的表达,当没有LIF时,细胞分化刺激信号激活ERKs通路引起USP21和Nanog磷酸化,磷酸化的USP21对Nanog不能再起稳定作用,导致Nanog被泛素蛋白酶体途径降解。可见,细胞生长环境中的各类信息通过刺激信号通路的激活或关闭,影响着细胞内蛋白的调节作用,精细调控着干细胞的状态。然而,尽管ESCs中敲除USP21导致细胞分化,但是USP21基因敲除小鼠的各类发育和生命活动未见影响,一方面表明了细胞层面和组织个体层面存在一定的差异性;另一方面也可能是去泛素化酶的代偿性功能冗余,在体内可能存在一些其他的去泛素化酶与USP21有功能交叉。除胚胎干细胞外,OH等[40]的研究表明,在乳腺干细胞生长分化过程中,USP34是上皮间质细胞转换的负调控子,在乳腺干细胞形成的细胞团中,USP34表达水平较低,而且USP34的敲除使得乳腺细胞成球能力提升,并且伴随着Nanog、Oct4和Sox2水平的升高,细胞的干性增强。寻找和鉴定生物体内Nanog的去泛素化酶有利于对干细胞的特性进行更深层的剖析和理解。
图2去泛素化酶调节干细胞多能性和自我更新示意图
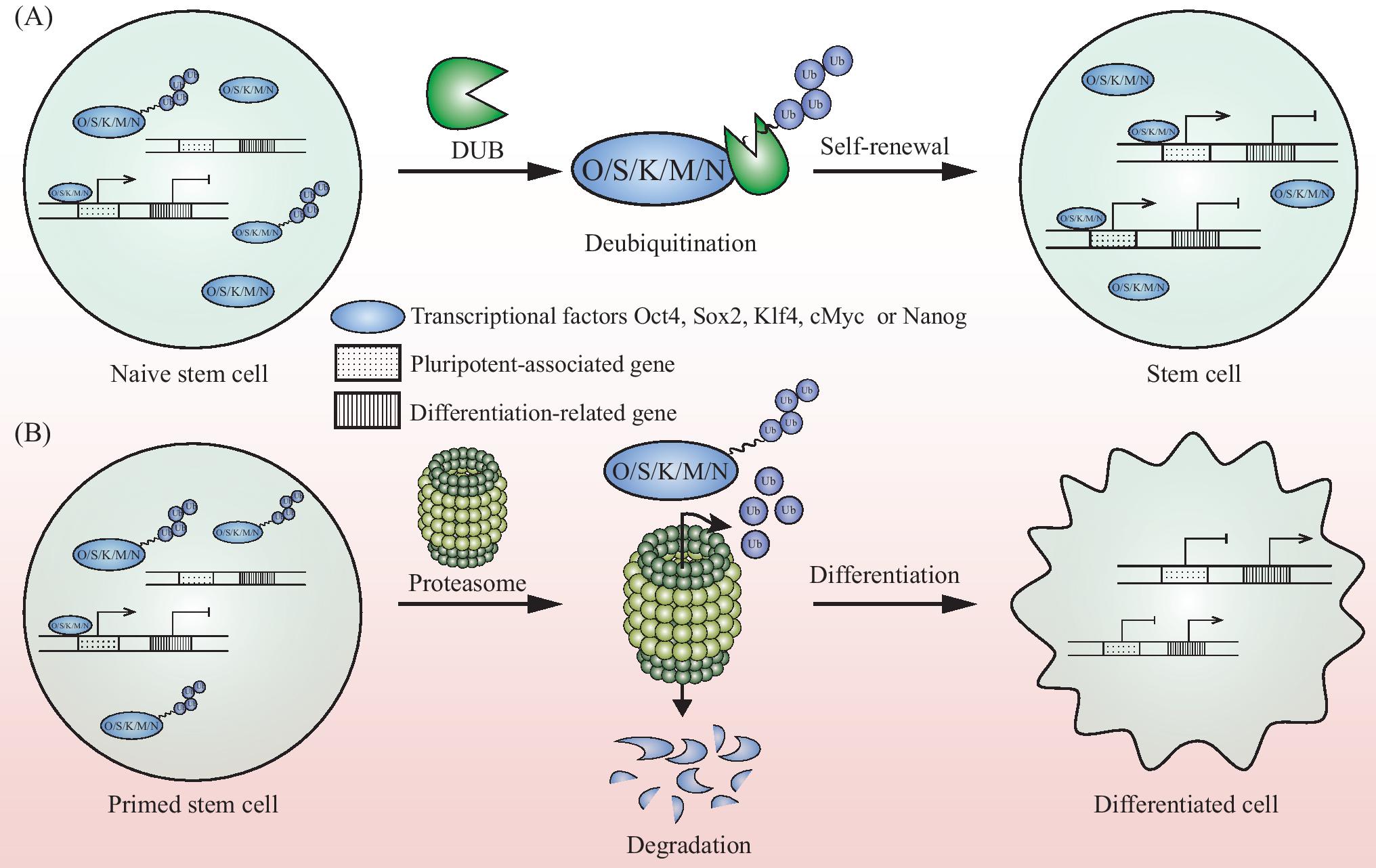
Fig.2 Schematic representation of the stem cell pluripotency and self-renewal regulated by deubiquitinate
A:干细胞转录因子被去泛素化酶稳定后,调节干性维持相关基因的表达,使细胞只发生自我更新。B:在没有去泛素化酶稳定多能性因子的情况下,细胞分化相关基因表达,细胞趋向分化。
A:the transcriptional factors were stabilized by deubiquitinate and promoted the expression of stem cell pluripotent gene,keeping the stem cell self-renewal only.B:whereas the differentiated genes were expressed and differentiated cells were produced without the deubiquitinates to stablize the transcriptional factors.
2.1.2 、Sox2
Sox2是蛋白结构和序列与Y染色体性别决定域(sex-determining region of chromosome Y,SRY)蛋白极为相似的一个大家族成员。Sox2可与Oct4、Klf4、cMyc一起将成熟的终末分化细胞逆转成多能干细胞,重建细胞多能性[3]。Sox2是维持iPSCs、ESCs和NSCs干性的细胞表面标志物,也是调节胚胎发育和ESC分化的重要分子之一,同时Sox2可以使iPSC和ESCs分化至神经干细胞[41],可见这个分子在干细胞命运决定中的关键地位。
Sox2包含高度可变区(high mobility group,HMG)可以与碱基A、T丰富的序列形成L型结合表面,这种L型表面导致了DNA的弯曲,参与了基因的转录激活。高度可变区的一些区域与其C末端的转录激活相关。Sox2的活性受到多种翻译后修饰的联合调控,Sox2 T118位点的磷酸化是由Akt1介导的,而Sox2 K119的甲基化是由Set7介导的,WWP2则是Sox2的泛素化酶,Akt1抑制WWP2对Sox2的泛素化作用,而Set7可以促进WWP2的泛素化作用;干性状态时,Akt1的作用超过Set7的作用,当细胞分化时,Set7表达量上调,引起Sox2降解,细胞分化[42]。Sox2对干细胞状态的动态影响体现为干细胞需要维持干性状态时,Sox2与Oct4形成异源二聚体激活干性基因的表达,抑制分化基因表达;而细胞需要分化时,Sox2、Oct4解体,Sox2与其他蛋白相互作用,调节一系列分化基因的表达[43]。Sox2引起的细胞分化有1200多个基因的参与,Oct4和Sox2正向反馈调节彼此的活性,稳定了细胞的多能性状态[44]。
细胞中也存在着一些去泛素化酶来直接或间接地调节干细胞状态。如上文中提到过,USP22可以调节ubH2B的去泛素化,干细胞中其结果是导致Sox2基因表达的抑制,而引起干细胞向三胚层分化的发生[31]。USP22可结合在Sox2基因的启动子区,去除Sox2基因启动子区被RNF20泛素化的ubH2B上的泛素标记,引起Sox2基因转录失活。Sox2基因启动子的再次开放则需要移除USP22,阻断Sox2的表达可以挽救USP22缺失引起的细胞不能分化的表型,消耗USP22能够增加Sox2的含量,Sox2调控的下游Nanog的表达量也会增加,但是Oct4的水平不变。在Sox2的基因启动子区,USP22的存在使得核小体变得更为致密,USP22底物ubH2B的含量降低,表明Sox2在USP22作用的下游,且USP22是在转录翻译层面调节着Sox2的水平,影响着干细胞的状态[31]。WEI等[45]研究发现,干细胞中转录因子BTB和CNC同源1蛋白(BTB domain and cnc homolog 1,BACH1)能够招募去泛素化酶USP7,稳定干细胞转录因子Nanog、Sox2、Oct4在细胞中的水平,稳定干细胞的多能性状态。去泛素化酶USP9x可直接作用于Sox2,稳定Sox2的水平,促进细胞的增殖。USP2、USP14对Sox2的蛋白水平也有影响。在一些针对转录因子的生物信息学分析中(表1),检测出USP15、USP24、USP34、USP37和USP49等都与Sox2有相互作用,但是在干细胞中发挥作用的去泛素化酶的报道不多。近来,本课题组[46]研究发现,OTU家族去泛素化酶OTUD7B能够对CUL4ADET1-COP1引起的Sox2的多聚泛素化进行去泛素化,稳定了神经祖细胞(neural progenitor cells,NPCs)中Sox2蛋白含量,维持了NPCs的干性,阻止了分化发生。是否还存在其他去泛素化酶分子通过Sox2影响细胞的干性维持或分化选择仍然需要进一步探究。
2.1.3、 cMyc
cMyc是重编程诱导分子,参与直接激活多能性标志物,在细胞中的作用是保持mESC干细胞状态。cMyc的生物学功能是调节参与细胞增殖的靶基因。除了转录水平上控制cMyc分子含量,cMyc含量和功能也受到转录后修饰水平的调节。由GSK-3介导的cMyc的保守结构BoxI位点中Thr58和Ser62位点的磷酸化修饰会进一步招募SCFFBXW7对cMyc进行泛素化,引起随后的蛋白降解[47]。在神经干细胞分化中,cMyc起着重要作用,cMyc通常被泛素连接酶TRIM32泛素化降解,引起干细胞的神经系分化。因此在神经生成的过程中伴随着TRIM32水平的升高,同时TRIM32从成神经细胞的细胞质中转移至神经元的细胞核。然而,在神经组织中有一类增殖细胞C其细胞核中已经含有TRIM32但是却不向神经方向分化,在增殖细胞C中cMyc能够被TRIM32泛素化降解,研究者通过质谱技术筛选出去泛素化酶USP7与cMyc的稳定相关,发现正是由于细胞中存在的去泛素化酶USP7能够去除cMyc的泛素化,从而稳定了神经干细胞[48]。而且作者发现抑制USP7的功能,神经干细胞的另一重要标志物Sox2的表达水平也下降了,提示USP7在神经干细胞的生长、增殖中有重要作用。SUN等[49]发现,USP36能够在细胞核内去泛素化cMyc稳定自身水平,而且cMyc会靶向调控USP36的表达,两者形成正向反馈循环,可见细胞中存在不同定位的去泛素化酶调节着cMyc的水平。进一步地,有研究表明USP28[50]也被认为是cMyc的去泛素化酶,能够通过去泛素化解除Fbw7对cMyc的泛素化作用,稳定cMyc的水平,但是与USP7和USP36不同,USP28的这种去泛素化作用是在细胞质中发生的,而且研究的是在肺癌中的USP28的去泛素化作用。同样地,USP13能够拮抗FBXL14对cMyc的泛素化,维持胶质细胞瘤干细胞的干性生长[51]。PAN等[52]发现,cMyc也可以被USP37稳定,而且USP37帮助癌细胞适应低氧环境。此外,去泛素化酶USP22也被认为是cMyc的辅助因子,调节cMyc靶向基因的转录[31],与肿瘤发生发展相关。
2.1.4 、Oct4
Oct4在调节多能性ESCs的命运和多能干细胞的重编程中发挥重要作用。Oct4含有一个N-端激活域、一个POU域、一个C-端激活域。POU域包含2个结构上独立的DNA结合域(NH2末端POUS域和C末端POUH域),Oct4依靠自身独特的构像既能与其他转录因子一起形成异二聚体和也能与DNA序列一起形成同二聚体。其POU域对于Oct4的细胞质定位是必须的,Oct4有5个赖氨酸残基介导E3泛素连接酶的识别和泛素分子的连接[53]。Oct4的过表达会促进细胞分化到内胚层和中胚层,Oct4的表达下降时促进胚胎干细胞向外胚层的分化[44]。
表1转录因子相关去泛素化酶汇总
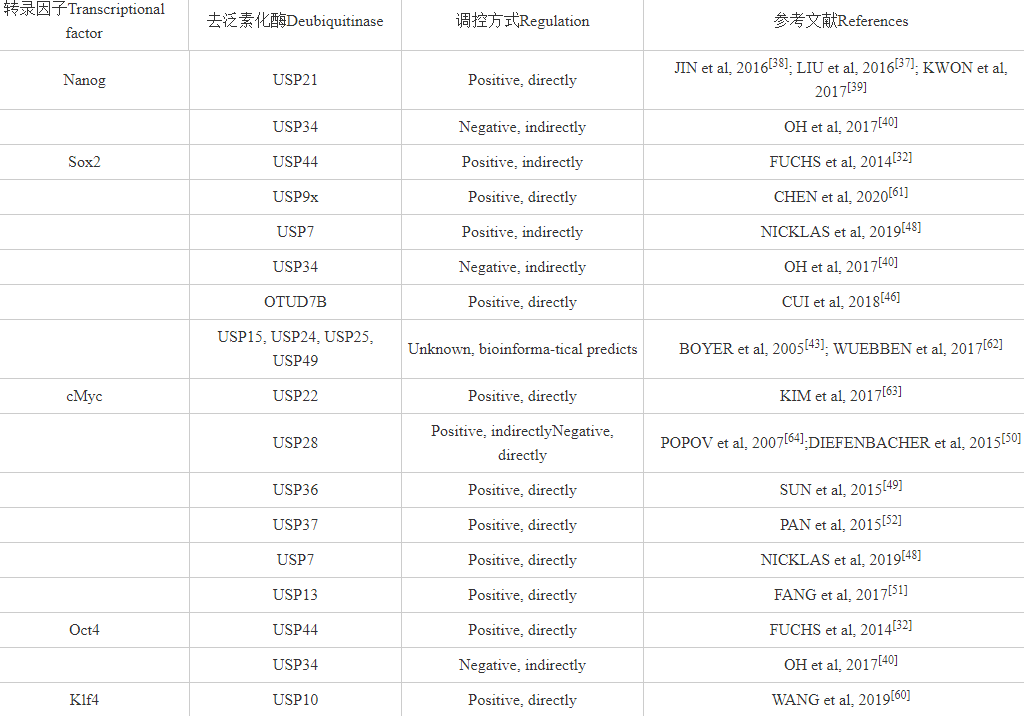
综合来看,泛素连接酶FBXW8和ITCH主要在细胞处于多能性状态时调控Oct4的丰度,而WWP2、DPF2、TRIM6是在细胞开始分化时发挥作用[53]。例如,WWP2作为Oct4的泛素化酶以剂量依赖的方式介导多能干细胞的分化[54],在干细胞维持干性自我更新时,WWP2不影响Oct4的表达,但是当细胞需要分化时,WWP2就会发挥降低Oct4水平的功能,促进细胞退出多能性状态进入分化状态[54]。类似地,TRIM家族的成员TRIM6在干细胞处于多能性状态时不影响cMyc的表达水平,然而TRIM6会影响Oct4的转录水平[55]。BAHNASSAWY等[56]研究发现,TRIM32也能够调节Oct4的泛素化,TRIM-NHL家族的其他成员在调节细胞多能性和重编程中的作用也已经有所报道,所以TRIM32在干细胞中调控细胞的多能性不足为奇。类似Sox2对干细胞命运的调节,Oct4水平的波动均会影响干细胞的干性[53],因此,去泛素化酶对这些过程的精确控制对于干细胞的状态转换是非常关键的。在ESCs的分化过程中,USP34/44是调节Oct4的去泛素化酶,但是两者调节作用下Oct4的含量波动是朝着不同方向变化的。USP34的缺失促进Oct4的水平增加[40],而USP44的缺失则导致Oct4的水平下降[32]。可以看出USP34和USP44在胚胎干细胞的干性维持方面的功能是反向的,而且Oct4并非两者的直接底物,进一步证实了去泛素化酶在干细胞调控过程中的多态性和复杂性。
另一项研究显示,去泛素化酶PSMD14作为26S蛋白酶体亚基19S的成分,在多能干细胞中也有高表达,其表达含量的下降会导致细胞中Oct4表达水平的降低,引起干细胞形态异常和细胞分化的发生。降低PSMD14的表达,导致蛋白酶体活性丧失,引起K48和K63型的多聚泛素化蛋白聚集,Oct4的表达丢失,ESC分化。去泛素化酶PSMD14通过去泛素化作用帮助蛋白酶体活性的维持,保证细胞干性,同时保证成熟体细胞重编程的效率[8],但是Oct4是否是PSMD14的直接底物尚不清楚。直接作用于Oct4的去泛素化酶还有待研究和鉴定,但是毋容置疑,这类工作是有重要意义的。
2.1.5 、Klf4
Klf4是保守的锌指转录因子,与多能转录因子相互作用,调节干细胞的多能性状态和重编程。持续性表达Klf4抑制ESCs的分化,因此细胞的分化事件发生需要降低Klf4的表达量[57]。同源敲除klf4基因远端增强子引起Klf4转录本减少17倍,但是其蛋白水平只减少不到2倍,可见对Klf4在转录后的控制超过了转录水平[58]。Klf4因子比较稳定,半衰期超过了24 h,因此转录水平上应对其含量变化进行的调节不敏感。但其稳定性与所处环境相关,细胞需要分化时,针对Klf4的翻译后修饰使其稳定性下降,半衰期下降到2 h以下,细胞退出多能状态[59]。在人的ESC和iPSCs细胞中都可以发现高水平的USP22,而且Klf4会被同时招募至usp22的启动子区,结合H3K4me3,启动usp22基因的转录,而转录翻译出来的USP22可以促进cMyc的表达,抑制Sox2的表达,可见Klf4不仅可以调控干细胞多能性基因也可以通过调控去泛素化酶的基因表达,调节干细胞的状态[31]。本课题组鉴定出在肺癌发生中,去泛素化酶USP10是Klf4的特异性去泛素化酶[60],然而在干细胞中直接去泛素化Klf4的去泛素化酶分子还未有报道,需进一步研究。
将调控上述5种转录因子的去泛素酶进行总结和梳理后(表1),可以看到尽管已有部分去泛素化酶直接(dirctly)或间接地(indirectly)以正面的(positive)保护作用或负面的(negative)降解作用调控各类转录因子的含量和表达,该领域仍然存在大量空白有待被挖掘和研究。
2.2、去泛素化酶通过调控细胞周期影响干细胞的分化
维持细胞周期的静止是各类组织、器官、细胞以及哺乳动物造血干细胞抵抗外界压力的有效防御手段[65]。在大多数体细胞中,细胞从G1期向S期进展需要细胞周期蛋白(cyclins)等促有丝分裂活性的激酶复合体对Rb蛋白(retinoblastoma protein,Rb)进行磷酸化,如CDK4-cyclinD和CDK2-cyclinE激酶复合体等。当小鼠ESCs受到持续的MAPK信号激活后,其持续表达的CDK2-cyclinE持续磷酸化Rb,ESCs也就能跨越G1到S期的转化,持续自我更新。而在多能干细胞进行分化时,G1期显着延长,所以细胞不再自我更新。小鼠干细胞有着极短的细胞周期进程和迅速的G1期跨越,其原因可能是为了避免细胞感知外在环境中的分化信号,维持多能性状态[66]。而且,在选择用于重编程获得iPSC的成体细胞时,分化过程中离干细胞更近的细胞以及细胞周期进展快的细胞会更有优势,而且,实验表明可通过抑制p53/p21通路或者外源表达Lin28来加快细胞周期进行,增加成纤维细胞向iPSC转换的速度。此外,cMyc在促进细胞周期进展中的角色也为其能够促进细胞重编程效率的作用提供了一种机制上的支撑[67]。
在细胞分裂时,细胞分裂周期蛋白25磷酸酶家族(CDC25A、B、C)负责移除细胞周期依赖激酶(cyclin-dependent kinases,CDK2)催化位点处的抑制性磷酸化信号,使得CDK2活化以调控G1/S和G2/M细胞周期的转换。对比小鼠的其他细胞类型,CDC25A在胚胎干细胞中的表达含量更高,表明了其可能主要负责非典型的G1/S期的转换。而CDC25A蛋白丰度主要受到多聚泛素化和蛋白酶降解的影响,如去泛素化酶DUB3(也被称为USP17L2)可以通过去泛素化稳定CDC25A的蛋白量(图3)。胚胎干细胞中去泛素化酶DUB3的表达使得G1期的时长维持在较短的水平,保证干细胞的自我更新。尽管还有4种参与CDC25A稳定性的去泛素化酶USP13、29、48和Dub2A,其中只有USP48的mRNA水平在细胞分化过程中显着降低,但是其表达水平仍然很高直到分化期末[68]。DUB3在细胞中与USP48的功能是否冗余还需要进行验证。在模式生物果蝇中,Bam与Otu发挥协同作用负性调节CycA的泛素化,导致CycA在生殖干细胞(germline stem cells,GSCs)中的积累,从而引起细胞向生殖细胞的分化。而且Bam和Otu是和其他成分一起形成了去泛素化酶复合体完成的CycA的去泛素化[69]。
图3 DUB3含量变化重塑细胞周期和干细胞谱系选择
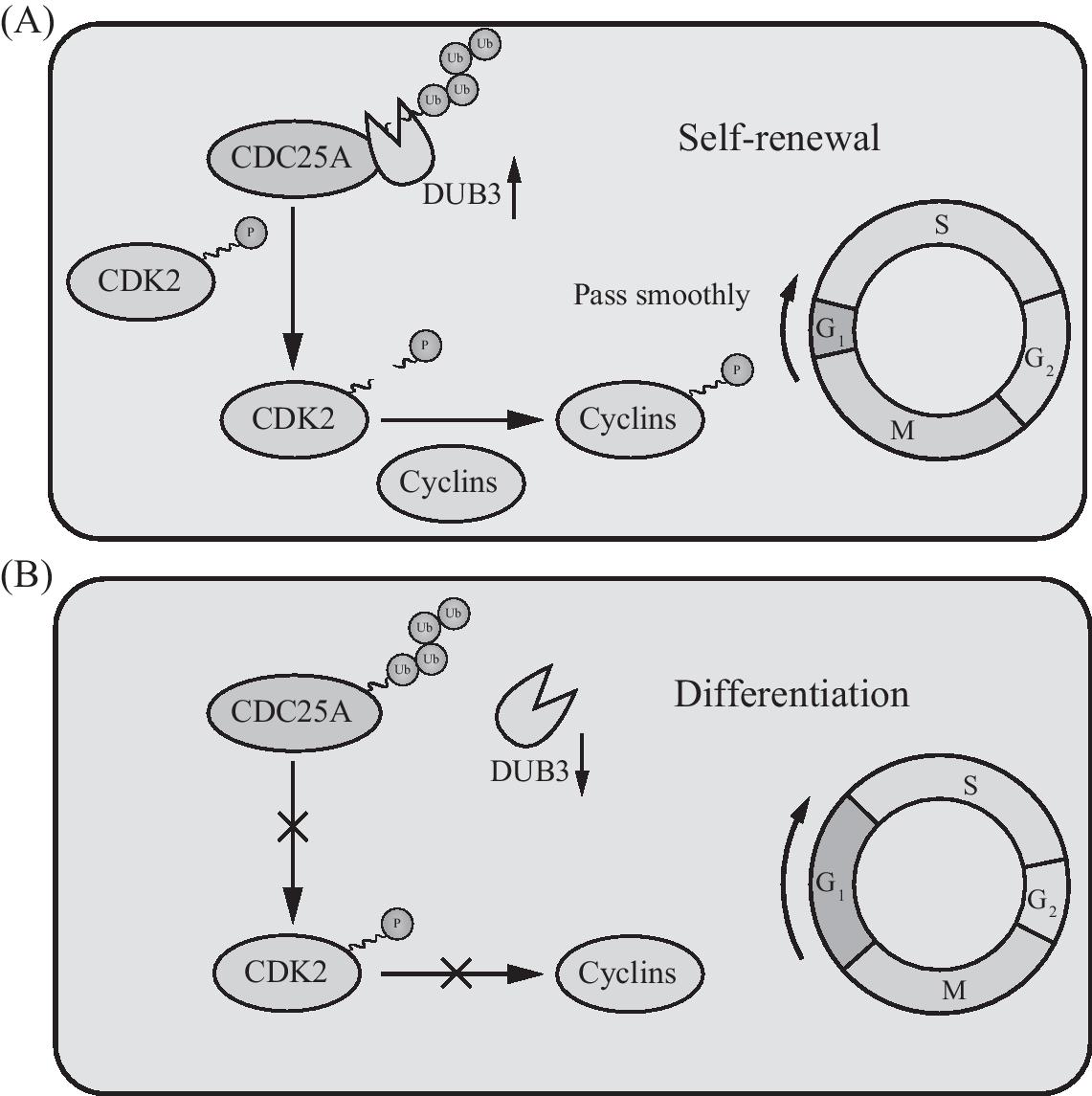
Fig.3 The dosage of DUB3 regulate the cell-cycle remodeling and lineage commitment of pluripotent stem cells
A:高剂量DUB3使得细胞维持自我更新和多能性。B:DUB3含量下降时,细胞G1期延长,细胞发生分化。向上短箭头表示去泛素化酶含量上升,而向下短箭头表示去泛素化酶含量下降,顺时针箭头表示细胞周期反向,箭头上标记叉号代表不能对底物进行磷酸化。
A:a high level of DUB3 made the cell prone to be self-renewal and pluripotency maintenance.B:when the level of DUB3 decreased,the G1 phase expanded and cell differentiated.Short upward arrow indicates an increase in the content of deubiquitinase,a short downward arrow indicates a decrease in deubiquitinase content,a clockwise arrow indicates the orientation of cell cycle,and a cross on the arrow indicates that the processes were inhibited.
此外,CDC20是E3连接酶后期促进复合体或细胞周期体(anaphase promoting complex or cyclosome,APC/C)的共激活分子,可以促进多种细胞周期调节子的降解。而USP44是CDC20的去泛素化酶,USP44的活性对于调节纺锤体检验点和有丝分裂后期染色体的正确分离十分重要。只要存在未连接的动粒,CDC20就附着在有丝分裂纺锤体组装检点蛋白MAD2上,此时APC/C不能被激活,当CDC20被APC/C泛素化后,会从MAD2上释放,激活APC/C。USP44逆转了APC/C对CDC20的作用,保证检查点正常完成工作。APC/C泛素活性和USP44的去泛素化活性控制着细胞周期的进程[70],而在前文中,USP44还可以介导核小体组蛋白H2B的去泛素化,导致分化相关基因转录的沉默,维持干细胞干性状态[32]。这些方面的调控对于干细胞生长的调控也具有重要意义。所以,去泛素化酶可以通过调控干细胞细胞周期进程来调控细胞的命运,可以帮助我们更好地研究和理解干细胞的生命活动。
2.3、去泛素化酶对干细胞内自噬调控与干细胞生长分化的关系
自噬是真核生物高度保守的溶酶体介导的催化过程,最初是由于细胞在压力条件下对于能量和自身代谢的需求而出现的大规模降解过程。在机体需要大量的细胞重建活动,如胚胎生成、细胞分化或者细胞重编程等事件发生过程中,自噬的调控作用非常关键[71]。
胚胎干细胞内的高度自噬活动保证了细胞因高速增殖和自我更新而需要的较高的代谢速率,在Atg3敲除的鼠ESC中,自噬功能的缺失导致了细胞不能移除线粒体,其多能性下降[72]。EPG5是真核生物特异性的一种自噬调节分子,可以介导自噬体和溶酶体的融合,在ESCs中高度表达,促进ESC的特性维持,而去泛素化酶USP8结合在EPG5的线圈–线圈连接区将移去其非经典的K252处的K63泛素链,使得EPG5与LC3的相互作用增强[73]。这种相互作用阻止了ESC中的自噬过程,维持了ESC的干性。CHEN等[74]发现,在细胞处于饥饿状态时,细胞内的USP44表达升高,使ubH2B去泛素化,导致调控细胞自噬的基因转录激活,促进细胞自噬的发生,有利于维持干细胞的干性。在iPSC细胞中,细胞转录因子Sox2结合在mTOR启动子的抑制性区域,招募NuRD复合体介导mTOR的转录抑制[75],促进细胞的自噬发生,影响重编程过程。Sox2的去泛素化酶是否会通过自噬过程影响iPSC的重编程仍然需要进行研究。转录因子FOXO1介导ESCs中自噬核心机器基因的表达增加,降低FOXO1的表达则降低ESCs中的自噬流,损害细胞自我更新、多能性和分化[76]。干细胞中细胞因子对自噬通路的调控与去泛素化酶之间的其他联系仍然需要通过大量研究来揭示。在成体干细胞中,细胞的自噬不仅帮助细胞增强对压力的抗性,对于细胞的自我更新和分化也具有调节作用。多能干细胞利用线粒体的自噬机制避免氧化损伤,通过降低线粒体的含量,营造一个低氧的微环境,躲避活性氧的伤害。如,造血干细胞借助自噬清除活跃的线粒体,保持一个代谢率极低的静止状态[72]。
3、去泛素化酶对干细胞特性调控的其他方面举例
作为一个新的去泛素化酶成员,Mindy1在胚胎干细胞中高表达,能促进干细胞的自我更新[77],在胚胎发育前期Mindy1的表达迅速下降,直到发育完成后又逐渐增加,在干细胞生长分化中的这种变化机制目前还没研究清楚。已有多项研究表明,蛋白酶体复合物在干细胞多能性、分化状态调控中发挥重要作用。例如,蛋白酶体亚基影响转录因子和RNA聚合酶II等顺式作用原件的数量和活性,抑制细胞类型特异性基因的表达,维持干细胞的状态,此外蛋白酶体亚基中的另外一些成员可以直接结合在特定基因位点,沉默基因的表达[5]。相反地,干细胞通过转录因子FOXO4促进蛋白酶体亚基PSMD11的表达[78],转录因子Nrf2也可以通过调节蛋白酶体的活性促进干细胞的干性维持,避免分化发生[79]。转录因子和蛋白酶体之间的这种互相调节维持了细胞的特性。19S蛋白酶复合体亚基的成分PSMD11(在鼠中是PSMD14)作为一个去泛素化酶分子,通过识别相应的底物,在蛋白代谢过程中发挥校对官的作用,将有可能危害干细胞活性的毒性蛋白或错误折叠的蛋白通过蛋白酶体途径降解,保证干细胞的特性[78],也解释了为什么干细胞中的蛋白酶体的数量一般比分化细胞中要高,可见干细胞利用蛋白酶体途径为自己的活性保驾护航。
4、结语和展望
泛素蛋白酶体系统影响着细胞多能性的维持和消失。通过泛素化关键多能性转录因子如Oct4、Nanog、cMyc、Klf4和Sox2等调节干细胞的多能性状态。泛素蛋白酶体系统在干细胞多能性诱导、维持和遗失方面的作用也越来越多地被报道,这类研究对于未来再生医学、细胞替代治疗和药物药效评估及筛选等多个领域有重要意义。比如,如何高效地获得重编程的细胞、如何通过改变泛素蛋白酶体系统地调控调节细胞的状态?通过泛素蛋白酶体系统对于细胞周期蛋白的调控,对细胞转录因子和蛋白翻译的调节,对损伤蛋白的控制和降解,维持多能性细胞的增殖潜能和多能性状态等机制研究,有助于揭示蛋白质代谢和细胞发育的机制。
胚胎干细胞和诱导多能干细胞都具有自我更新和多向分化的独特特性,它们自发地向中、外、内三胚层分化。随着泛素蛋白酶体对于信号通路的精细调控逐渐得到揭示,泛素蛋白酶体信号对于干细胞分化的调节也得到日益增长的研究。泛素蛋白酶体系统参与到几乎所有细胞活动的调控中,如细胞周期调节、细胞自我更新、细胞信号转导、转录、翻译、氧化应激、免疫反应和细胞凋亡等[80]。去泛素化酶作为泛素蛋白酶体系统的一部分,其在细胞生命活动中也充当着重要角色。研究去泛素化酶在干细胞特性调控中的作用有助于理解细胞的生命活动,有利于开发再生医学治疗各类疾病的新途径。综上,在生物学和医学领域,研究泛素蛋白酶体系统和干细胞多能性调控之间的相互作用机制有重大生物学和医学意义。
参考文献
[1]THOMSON J A,ITSKOVITZ-ELDOR J,SHAPIRO S S,et al.Embryonic stem cell lines derived from human blastocysts[J].Science,1998,282(5391):1145-7.
[2]BLANPAIN C,LOWRY W E,GEOGHEGAN A,et al.Self-renewal,multipotency,and the existence of two cell populations within an epithelial stem cell niche[J].Cell,2004,118(5):635-48.
[3]TAKAHASHI K,YAMANAKA S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-76.
[4]BAHARVAND H,HAJHEIDARI M,ASHTIANI S K,et al.Proteomic signature of human embryonic stem cells[J].Proteomics,2006,6(12):3544-9.
[5]SZUTORISZ H,GEORGIOU A,TORA L,et al.The proteasome restricts permissive transcription at tissue-specific gene loci in embryonic stem cells[J].Cell,2006,127(7):1375-88.
[6]WERNER A,MANFORD A G,RAPE M.Ubiquitin-dependent regulation of stem cell biology[J].Trends Cell Biol,2017,27(8):568-79.
[7]HANPUDE P,BHATTACHARYA S,DEY A K,et al.Deubiquitinating enzymes in cellular signaling and disease regulation[J].Iubmb Life,2015,67(7):544-55.
[8]BUCKLEY S M,ARANDA-ORGILLES B,STRIKOUDIS A,et al.Regulation of pluripotency and cellular reprogramming by the ubiquitin-proteasome system[J].Cell Stem Cell,2012,11(6):783-98
[9]BRAND M,NAKKA K,ZHU J,et al.Polycomb/trithorax antagonism:cellular memory in stem cell fate and function[J].Cell Stem Cell,2019,24(4):518-33.
[10]CAO J,YAN Q.Histone ubiquitination and deubiquitination in transcription DNA damage response,and cancer[J].Front Oncol,2012,2:26
[11]BELLE J I,NIJNIK A.H2A-DUBbing the mammalian epigenome:expanding frontiers for histone H2A deubiquitinating enzymes in cell biology and physiology[J].Int J Biochem Cell Biol,2014,50:161-74.
[12]MARGUERON R,LI G H,SARMA K,et al.Ezh1 and Ezh2 maintain repressive chromatin through different mechanisms[J].Molecular Cell,2008,32(4):503-18.
[13]SCHUETTENGRUBER B,BOURBON H M,DI CROCE L,et al.Genome regulation by polycomb and trithorax:70 years and counting[J].Cell,2017,171(1):34-57.
[14]BOYER L A,PLATH K,ZEITLINGER J,et al.Polycomb complexes repress developmental regulators in murine embryonic stem cells[J].Nature,2006,441(7091):349-53.
[15]BHATNAGAR S,GAZIN C,CHAMBERLAIN L,et al.TRIM37 is a new histone H2A ubiquitin ligase and breast cancer oncoprotein[J].Nature,2014,516(7529):116-20.
[16]NAKAGAWA T,KAJITANI T,TOGO S,et al.Deubiquitylation of histone H2A activates transcriptional initiation via trans-histone cross-talk with H3K4 di-and trimethylation[J].Genes Dev,2008,22(1):37-49.
[17]MIKKELSEN T S,KU M C,JAFFE D B,et al.Genome-wide maps of chromatin state in pluripotent and lineage-committed cells[J].Nature,2007,448(7153):553-60.
[18]SCHEUERMANN J C,ALONSO A G D A,OKTABA K,et al.Histone H2A deubiquitinase activity of the Polycomb repressive complex PR-DUB[J].Nature,2010,465(7295):243-7.
[19]YANG W,LEE Y H,JONES A E,et al.The histone H2A deubiquitinase Usp16 regulates embryonic stem cell gene expression and lineage commitment[J].Nat Commun,2014,5:3818
[20]MAERTENS G N,EL MESSAOUDI-AUBERT S,ELDERKIN S,et al.Ubiquitin-specific proteases 7 and 11 modulate Polycomb regulation of the INK4a tumour suppressor[J].EMBO J,2010,29(15):2553-65.
[21]NING B,ZHAO W,QIAN C,et al.USP26 functions as a negative regulator of cellular reprogramming by stabilising PRC1 complex components[J].Nat Commun,2017,8(1):349
[22]ZHAO Y,LANG G,ITO S,et al.A TFTC/STAGA module mediates histone H2A and H2B deubiquitination,coactivates nuclear receptors,and counteracts heterochromatin silencing[J].Mol Cell,2008,29(1):92-101.
[23]WANG T,NANDAKUMAR V,JIANG X X,et al.The control of hematopoietic stem cell maintenance,self-renewal,and differentiation by Mysm1-mediated epigenetic regulation[J].Blood,2013,122(16):2812-22.
[24]MINSKY N,SHEMA E,FIELD Y,et al.Monoubiquitinated H2B is associated with the transcribed region of highly expressed genes in human cells[J].Nat Cell Biol,2008,10(4):483-90.
[25]CHANDRASEKHARAN M B,HUANG F,SUN Z W.Histone H2B ubiquitination and beyond regulation of nucleosome stability,chromatin dynamics and the trans-histone H3 methylation[J].Epigenetics,2010,5(6):460-8
[26]LEE M G,VILLA R,TROJER P,et al.Demethylation of H3K27 regulates polycomb recruitment and H2A ubiquitination[J].Science,2007,318(5849):447-50.
[27]EMRE N C,INGVARSDOTTIR K,WYCE A,et al.Maintenance of low histone ubiquitylation by Ubp10 correlates with telomere-proximal Sir2 association and gene silencing[J].Mol Cell,2005,17(4):585-94.
[28]LARIBEE R N,FUCHS S M,STRAHL B D.H2B ubiquitylation in transcriptional control:a FACT-finding mission[J].Genes Dev,2007,21(7):737-43.
[29]ZHAO X,HENG J I T,GUARDAVACCARO D,et al.The HECT-domain ubiquitin ligase Huwe1 controls neural differentiation and proliferation by destabilizing the N-Myc oncoprotein[J].Nat Cell Biol,2008,10(6):643-53.
[30]ZHANG X Y,VARTHI M,SYKES S M,et al.The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for acivated transcription and cell-cycle progression[J].Mol Cell,2008,29(1):102-11.
[31]SUSSMAN R T,STANEK T J,ESTESO P,et al.The Epigenetic modifier ubiquitin-specific protease 22 (usp22) regulates embryonic stem cell differentiation via transcriptional repression of sex-determining region Y-box 2 (SOX2)[J].J Biol Chem,2013,288(33):24234-46.
[32]FUCHS G,SHEMA E,VESTERMAN R,et al.RNF20 and USP44 regulate stem cell differentiation by modulating H2B monoubiquitylation[J].Mol Cell,2012,46(5):662-73.
[33]LECONA E,NARENDRA V,REINBERG D.USP7 cooperates with SCML2 to regulate the activity of PRC1[J].Mol Cell Biol,2015,35(7):1157-68.
[34]ZHANG W,SUI Y,NI J,et al.Insights into the Nanog gene:a propeller for stemness in primitive stem cells[J].Int J of Biol Sci,2016,12(11):1372-81.
[35]RAMAKRISHNA S,SURESH B,LIM K H,et al.PEST motif sequence regulating human NANOG for proteasomal degradation[J].Stem Cells Dev,2011,20(9):1512-20.
[36]KIM S H,KIM M O,CHO Y Y,et al.ERK1 phosphorylates Nanog to regulate protein stability and stem cell self-renewal[J].Stem Cell Res,2014,13(1):1-11.
[37]LIU X,YAO Y,DING H,et al.USP21 deubiquitylates Nanog to regulate protein stability and stem cell pluripotency[J].Signal Transduct Target Ther,2016,1:16024
[38]JIN J,LIU J,CHEN C,et al.The deubiquitinase USP21 maintains the stemness of mouse embryonic stem cells via stabilization of Nanog[J].Nat Commun,2016,7:13594.
[39]KWON S K,LEE D H,KIM S Y,et al.Ubiquitin-specific protease 21 regulating the K48-linked polyubiquitination of NANOG[J].Biochemical Biophys Res Commun,2017,482(4):1443-8.
[40]OH E,KIM J Y,SUNG D,et al.Inhibition of ubiquitin-specific protease 34 (USP34) induces epithelial-mesenchymal transition and promotes sternness in mammary epithelial cells[J].Cell Signal,2017,36:230-9.
[41]KOPP J L,ORMSBEE B D,DESLER M,et al.Small increases in the level of Sox2 trigger the differentiation of mouse embryonic stem cells[J].Stem Cells,2008,26(4):903-11.
[42]FANG L,ZHANG L,WEI W,et al.A Methylation-phosphorylation switch determines Sox2 stability and function in ESC maintenance or differentiation[J].Mol Cell,2014,55(4):537-51.
[43]BOYER L A,LEE T I,COLE M F,et al.Core transcriptional regulatory circuitry in human embryonic stem cells[J].Cell,2005,122(6):947-56.
[44]WANG Z,ORON E,NELSON B,et al.Distinct lineage specification roles for NANOG,OCT4,and SOX2 in human embryonic stem cells[J].Cell Stem Cell,2012,10(4):440-54.
[45]WEI X,GUO J,LI Q,et al.Bach1 regulates self-renewal and impedes mesendodermal differentiation of human embryonic stem cells[J].Sci Adv,2019,5(3):eaau7887.
[46]CUI C P,ZHANG Y,WANG C J,et al.Dynamic ubiquitylation of Sox2 regulates proteostasis and governs neural progenitor cell differentiation[J].Nat Commun,2018,9(1):4648
[47]GREGORY M A,QI Y,HANN S R.Phosphorylation by glycogen synthase kinase-3 controls c-Myc proteolysis and subnuclear localization[J].J Biol Chem,2003,278(51):51606-12.
[48]NICKLAS S,HILLJE A L,OKAWA S,et al.A complex of the ubiquitin ligase TRIM32 and the deubiquitinase USP7 balances the level of c-Myc ubiquitination and thereby determines neural stem cell fate specification[J].Cell Death Differ,2019,26(4):728-40.
[49]SUN X X,HE X,YIN L,et al.The nucleolar ubiquitin-specific protease USP36 deubiquitinates and stabilizes c-Myc[J].Proc Natl Acad Sci USA,2015,112(12):3734-9.
[50]DIEFENBACHER M E,CHAKRABORTY A,BLAKE S M,et al.Usp28 counteracts Fbw7 in intestinal homeostasis and cancer[J].Cancer Res,2015,75(7):1181-6.
[51]FANG X,ZHOU W,WU Q,et al.Deubiquitinase USP13 maintains glioblastoma stem cells by antagonizing FBXL14-mediated Myc ubiquitination[J].J Exp Med,2017,214(1):245-67.
[52]PAN J,DENG Q,JIANG C,et al.USP37 directly deubiquitinates and stabilizes c-Myc in lung cancer[J].Oncogene,2015,34(30):3957-67.
[53]LI S,XIAO F,ZHANG J,et al.Disruption of OCT4 ubiquitination increases OCT4 protein stability and ASH2L-B-mediated H3K4 methylation promoting pluripotency acquisition[J].Stem Cell Rep,2018,11(4):973-87.
[54]LIAO B,JIN Y.Wwp2 mediates Oct4 ubiquitination and its own auto-ubiquitination in a dosage-dependent manner[J].Cell Res,2010,20(3):332-44.
[55]SATO T,OKUMURA F,ARIGA T,et al.TRIM6 interacts with Myc and maintains the pluripotency of mouse embryonic stem cells[J].J Cell Sci,2012,125(Pt 6):1544-55.
[56]BAHNASSAWY L A,PERUMAL T M,GONZALEZ-CANO L,et al.TRIM32 modulates pluripotency entry and exit by directly regulating Oct4 stability[J].Sci Rep,2015,5:13456
[57]PAPAPETROU E P,TOMISHIMA M J,CHAMBERS S M,et al.Stoichiometric and temporal requirements of Oct4,Sox2,Klf4,and c-Myc expression for efficient human iPSC induction and differentiation[J].Proc Natl Acad Sci USA,2009,106(31):12759-64.
[58]DHALIWAL N K,ABATTI L E,MITCHELL J A.KLF4 protein stability regulated by interaction with pluripotency transcription factors overrides transcriptional control[J].Genes Dev,2019,33(15/16):1069-82.
[59]THOMSON M,LIU S J,ZOU L N,et al.Pluripotency factors in embryonic stem cells regulate differentiation into germ layers[J].Cell,2011,145(6):875-89.
[60]WANG X,XIA S,LI H,et al.The deubiquitinase USP10 regulates KLF4 stability and suppresses lung tumorigenesis[J].Cell Death Differ,2020,27(6):1747-64.
[61]CHEN X,ZHANG X,CAI H,et al.Targeting USP9x/SOX2 axis contributes to the anti-osteosarcoma effect of neogambogic acid[J].Cancer Lett,2020,469:277-86.
[62]WUEBBEN E L,RIZZINO A.The dark side of SOX2:cancer-a comprehensive overview[J].Oncotarget,2017,8(27):44917-43.
[63]KIM D,HONG A,PARK H I,et al.Deubiquitinating enzyme USP22 positively regulates c-Myc stability and tumorigenic activity in mammalian and breast cancer cells[J].J Cell Physiol,2017,232(12):3664-76.
[64]POPOV N,HEROLD S,LLAMAZARES M,et al.Fbw7 and Usp28 regulate Myc protein stability in response to DNA damage[J].Cell Cycle,2007,6(19):2327-31.
[65]ARAI F,HIRAO A,OHMURA M,et al.Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche[J].Cell,2004,118(2):149-61.
[66]ORFORD K W,SCADDEN D T.Deconstructing stem cell self-renewal:genetic insights into cell-cycle regulation[J].Nat Rev Genet,2008,9(2):115-28.
[67]SINGH A M,DALTON S.The cell cycle and myc intersect with mechanisms that regulate pluripotency and reprogramming[J].Cell Stem Cell,2009,5(2):141-9.
[68]VAN DER LAAN S,TSANOV N,CROZET C,et al.High Dub3 expression in mouse ESCs couples the G1/S checkpoint to pluripotency[J].Mol Cell,2013,52(3):366-79.
[69]JI S,LI C,HU L,et al.Bam-dependent deubiquitinase complex can disrupt germ-line stem cell maintenance by targeting cyclin A[J].Proc Natl Acad Sci USA,2017,114(24):6316-21.
[70]STEGMEIER F,RAPE M,DRAVIAM V M,et al.Anaphase initiation is regulated by antagonistic ubiquitination and deubiquitination activities[J].Nature,2007,446(7138):876-81.
[71]HO T T,WARR M R,ADELMAN E R,et al.Autophagy maintains the metabolism and function of young and old stem cells[J].Nature,2017,543(7644):205-10.
[72]LIU K,ZHAO Q,LIU P,et al.ATG3-dependent autophagy mediates mitochondrial homeostasis in pluripotency acquirement and maintenance[J].Autophagy,2016,12(11):2000-8.
[73]GU H,SHI X,LIU C,et al.USP8 maintains embryonic stem cell stemness via deubiquitination of EPG5[J].Nat Commun,2019,10(1):1465
[74]CHEN S,JING Y,KANG X,et al.Histone H2B monoubiquitination is a critical epigenetic switch for the regulation of autophagy[J].Nucleic Acids Res,2017,45(3):1144-58.
[75]WANG S,XIA P Y,YE B Q,et al.Transient activation of autophagy via Sox2-mediated suppression of mTOR is an important early step in reprogramming to pluripotency[J].Cell Stem Cell,2013,13(5):617-25.
[76]LIU P,LIU K,GU H,et al.High autophagic flux guards ESC identity through coordinating autophagy machinery gene program by FOXO1[J].Cell Death Differ,2017,24(10):1672-80.
[77]REHMAN S A A,KRISTARIYANTO Y A,CHOI S Y,et al.MINDY-1 is a member of an evolutionarily conserved and structurally distinct new family of deubiquitinating enzymes[J].Mol Cell,2016,63(1):146-55.
[78]VILCHEZ D,BOYER L,MORANTTE I,et al.Increased proteasome activity in human embryonic stem cells is regulated by PSMD11[J].Nature,2012,489(7415):304-8.
[79]JANG J W,WANG Y D,KIM H S,et al.Nrf2,a regulator of the proteasome,controls self-renewal and pluripotency in human embryonic stem cells[J].Stem Cells,2014,32(10):2616-25.
[80]REYES-TURCU F E,VENTII K H,WILKINSON K D.Regulation and cellular roles of ubiquitin-specific deubiquitinating enzymes[J].Annu Rev of Biochem,2009,78:363-97.
间充质干细胞(Mesenchymalstemcells,MSCs)是成体干细胞的一种,具有多向分化潜能。来源广泛,可从多种组织中分离得到,易于体外扩增培养,应用不涉及伦理问题,副反应少,安全性较高,在组织修复和再生方面的临床应用前景广阔。目前间充质干细胞已用于...
间充质干细胞(MSCs)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层,属于多能干细胞,MSCs最初在骨髓中发现,目前骨髓来源MSCs在临床上应用最广,但仍然存在不少不足,有研究表明成人骨髓中MSCs的含量仅为0.001~0.01%[1],并且骨髓采集...
神经干细胞(NSCs)广泛存在于胚胎和成年哺乳动物中枢神经系统,是一类具有分裂潜能和自我更新能力的前体细胞,它可以通过对称分裂和不对称分裂方式进行自我更新并产生神经组织的各类细胞,包括神经元、星形胶质细胞和少突胶质细胞等[1].NSCs的发现为神经...
外排体(Exosome)是由多种细胞的胞内体衍生而来,通过出芽方式释放到细胞外的一种脂质双层膜性结构〔1〕,大小为40~100nm。由于其携带母细胞成分已逐渐被认为是细胞间进行信息交流,从而产生相互作用的新方式。树突状细胞(DC)作为一种体内分布广泛、最强的抗原提...
间充质干细胞(mesenchymal stem cells,MSCs)具有自我更新、多向分化能力和低免疫原性,可分化为脂肪细胞、骨细胞、软骨细胞、肌肉细胞和骨髓基质细胞等,不仅存在于骨髓,还分布在脂肪,脐带和牙体等组织。...
随着人类基因组计划的不断推进,人们发现90%以上的基因组DNA能转录成RNA,而其中不足2%编码蛋白质[1-2],其余不能编码蛋白质的转录产物被称为非编码RNA(non-codingRNAs,ncRNAs)[3].根据长度不同,ncRNAs可以分为短链ncRNAs和长链ncRNAs(lon...
肠神经嵴干细胞(entericneuralcreststemcells,ENCSCs)来源于迷走神经嵴(vagalcrest,VC)和骶神经嵴(sacralcrest,SC).VC来源的ENCSCs定植于整个消化道,构成肠神经系统的绝大部分肠神经节.该过程发生障碍,将造成肠道不同部位缺乏神经节细胞,局部肠管痉...
磁性纳米材料指尺度为1~100nm的磁性材料,目前以铁系氧化物居多。磁性纳米材料通常在磁性纳米颗粒表面修饰上多种生物大分子或者靶的配体,这样就既具备良好的磁导向性,也具有良好的生物相容性或者靶向性,可与多种功能分子如蛋白质、核酸和维生素等结...
脐带来源的间充质干细胞可在体外培养、扩增, 具有和骨髓来源的间充质干细胞相似的生物形态和抗原表型, 为细胞治疗探索出的新的来源。...
脂肪干细胞(adipose-derivedstemcells)来源于脂肪组织,取材方便、对自体损伤较小,具有自我更新、多向分化能力、自体移植不发生排斥反应等特点,是组织工程中最有应用前景的种子细胞之一。量很低,占3%左右,并且分离出来的细胞纯度不理想[1].因此如...