摘 要: 牵拉成骨技术广泛应用于骨科、修复重建外科、口腔颌面外科、神经外科、下肢血管病科等多学科,其作用机制纷繁复杂。骨髓系统是牵拉成骨中必要组分之一,骨髓细胞则是骨髓系统的主体成分。尽管如此,并未见系统性骨髓细胞在牵拉成骨中作用机制的报道。本文对骨髓中多种与牵拉成骨有关的细胞(如骨髓间充质干细胞、内皮祖细胞、成骨细胞、破骨细胞等)进行归纳总结,发现其各自分工的同时又通过细胞间相互作用、通过不同的信号通路共同调控延长区新血管、新骨的形成,且临床中应用移植骨髓细胞促进牵拉成骨愈合证实了骨髓细胞重要的作用。虽然骨髓细胞在促进牵拉成骨愈合中扮演了重要角色,但仍需进一步研究其细胞间相互作用。
关键词: 骨髓细胞; 骨髓; 牵拉成骨;
牵拉成骨(distraction osteogenesis, DO)是在截骨的两端安装牵拉装置,然后以适当的速率牵拉截骨端,激发体内组织再生能力,在延长区内诱导新骨形成的过程,目前已广泛应用于骨缺损、骨延长、骨感染、肢体矫形、下肢慢性缺血性疾病[1]等。成骨的作用离不开骨髓与骨膜的共同作用。骨髓中含有多种细胞成分,这些细胞是DO过程中形成新血管及骨组织的重要来源之一。从骨髓中分离的成人间充质干细胞(bone mesenchymal stem cells, MSCs)具有多种潜能,可分化为骨、软骨、肌肉和脂肪等组织。骨髓中同时含有丰富的生长因子,这些生长因子为在DO中新骨形成中起到重要的调节作用。在DO中,血管再生是新骨生成的基本保证,而骨髓中富饶的血管系统,为DO提供了充足的营养与支持作用。既往有学者以骨膜为入手点综述其在DO中的作用机制[2],故本文以骨髓细胞为入手点综述其对DO的作用机制。
1、 DO相关的骨髓细胞成分及其发生
骨髓位于髓腔及松质骨间隙中,是一种近似海绵状、胶冻状或脂肪性的柔软组织,由血管、网状组织和各种基质组成,富含多种细胞成分。骨髓促进牵张成骨的作用与其细胞成分密切相关,主要包括骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)[3]、内皮祖细胞(endothelial progenitor cells, EPCs)[4]、成骨细胞(osteoblasts, OBs)[5]、破骨细胞(osteoclasts, OCs)[5]等。

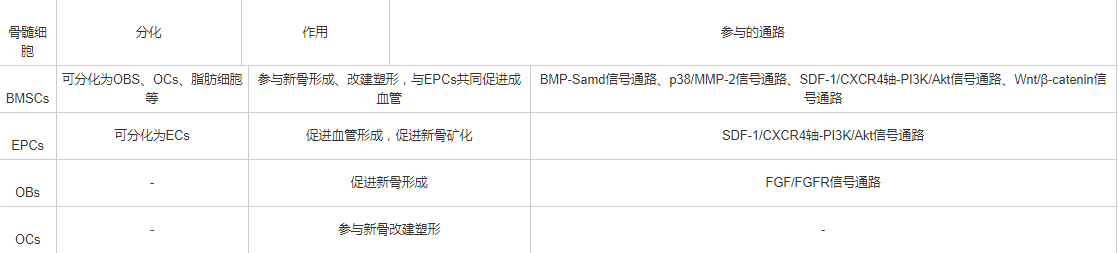
BMSCs是一种来源于中胚层的非造血性多能干细胞,存在于髓腔骨内膜、基质以及血管周围,具有极强的成骨能力。Pittenger等[6]对BMSCs的诱导分化实验中证明,在BMSCs的培养基中加入不同的诱导剂可诱导形成脂肪细胞、软骨细胞、成骨细胞等。来源于髓系血细胞的单核巨噬细胞所融合而成的破骨细胞,则具有吸收骨质的能力。成骨细胞的生成骨质能力与破骨细胞的骨质吸收能力共同作用,参与骨质的改建与塑形。因此,骨髓间充质干细胞、成骨细胞、破骨细胞等在DO中起到重要的成骨塑形作用。
EPCs起源于胚胎发育早起的中胚层,主要来源于骨髓,是一种能直接分化为血管内皮细胞(endothelial cells, ECs)的前体细胞,可促进血管的修复与再生[7]。Lee等[8]在DO过程中检测到EPCs分泌的细胞动员因子如血管内皮生长因子(vascular endothelial growth factor, VEGF)、超化因子1(stromal cell-derived factor-1,SDF-1)增加,证明了DO过程中EPCs的动员。SDF-1可促进DO中延长区新骨矿化。Lee等[9]的另一DO实验,在大鼠DO模型中测量血流量及EPCs分布,证明了EPCs的动员以及归巢有助于DO中新血管的生成。Jia等[4]与Lee等[9]分别在大鼠实验与临床研究中证明了骨髓细胞中的内皮祖细胞通过刺激血管形成加快了DO的骨矿化过程。由此看来,EPCs分化为ECs促进血管形成,对于DO中髓腔的循环起到了至关重要的作用,众所周知循环系统可发挥营养支持作用;同时EPCs分泌的SDF-1促进了DO的骨矿化。因此EPCs也是DO中不可或缺的细胞之一。
2 、DO中重要骨髓细胞间相互作用
复杂的生物学效应并不是由某种细胞单独发挥作用,而是多种细胞之间通过相互作用来表达。
BMSCs和EPCs作为DO中两种重要的细胞,各司其职的同时又互相影响。有研究表明,当BMSCs与EPCs共同培养相比单独培养时,VEGF、Ⅰ型胶原蛋白(type-Ⅰ collagen)、骨桥蛋白(osteopontin, OPN)、骨结核素(osteonectin, OCN)的mRNA表达明显上调,说明BMSCs与EPCs相互作用既可以促进成骨也可以促进成血管[10]。EPCs已被证实可以通过分泌某些因子分化为血管内皮细胞,Qin等[11]对EPCs与BMSCs研究指出,EPCs通过分泌细胞外小泡(endothelial progenitor cells extracellularvesicles, EPC-EVs)来调节BMSCs的增殖与分化。Yu等[12]的研究中表明,当BMSCs与EPCs共同培养时,不仅相互促进增殖,而且提高了抗凋亡蛋白Bcl-2的表达以及降低了促凋亡蛋白Bax和Caspase3的表达,因此两种细胞共同培养时具有互相抑制凋亡的作用,同时也证明了BMSCs与EPCs两者通过PI3K/Akt/Cox2轴来介导上述作用。因此,DO中的BMSCs与EPCs共存时相互提高活性,不仅促进各自独有的作用,而且共同促进成骨塑形与成血管作用。
骨的动态平衡由OCs与OBs共同作用,前者移除旧的骨质,后者形成新的骨质。当这种动态平衡被打破时,会导致骨质疏松症或骨硬化症。成骨细胞可分泌多种细胞因子,如核因子κ B受体活化因子配体(receptor activator of nuclear factor-κB ligand, RANKL)、巨噬细胞集落刺激因子(macrophage-stimulating factor, M-CSF)、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)等[13]。M-CSF上调破骨细胞前体细胞膜上RANK的表达,加强RANK的配体RANKL与其结合,促进破骨细胞的分化以及骨质的吸收[14]。MCP-1与破骨细胞前体细胞表达的MCP-1受体特异性结合,RANKL调控前体破骨细胞向破骨细胞分化的过程[15]。破骨细胞也可分泌多种细胞因子影响成骨细胞的发生与其成骨作用,如肝配蛋白、臂板蛋白和丛状蛋白等[16]。总的来说,DO中新骨的改建与塑形离不开OBs与OCs的相互作用。
各种骨髓细胞在DO过程中发挥不同的作用,相互影响共同调控DO过程,简要作用见表1。
表1 骨髓细胞在牵拉成骨中的作用
3、 DO中骨髓重要细胞的信号通路
3.1 、经典BMP信号通路
骨形态发生蛋白(bone morphogenetic protein, BMP)属于转化生长因子β(transforming growth factor-β,TGF-β)超家族的一类多功能生长因子,目前对其研究及应用最为广泛,BMP的信号传导既有典型的依赖Samd途径[17],也有非典型的不依赖Samd途径(如p38丝裂原活化蛋白激酶,p38-MAPK)[18]。
BMP在DO中具有极强的成骨作用[19,20]。DO中,经典的级联反应BMP-Samd信号通路,BMP2、BMP4等首先与细胞膜上具有丝氨酸/苏氨酸激酶活性的受体BMPR Ⅱ结合并使其磷酸化,然后激活受体BMPR Ⅰ,BMPR Ⅰ进一步磷酸化Smad1、Smad5和Smad8,磷酸化后的Smad1、5、8与Smad4在细胞质中形成复合物,转位到细胞核后,复合物与成骨细胞中的其他转录因子如Runx2相互作用使靶基因翻译及表达相关蛋白[18],促进BMSCs向前体成骨细胞分化[21]。Khanal 等[22]用免疫组织化学方法的对DO中的BMP2、BMP4和Smad1、Smad5、Smad8进行检测,这些因子首先出现在截骨边缘的间充质细胞与成骨细胞中,随着延长的进行这些细胞高度表达,牵拉结束后相关因子随着时间的推移逐渐表达降低。Li等[23]在兔DO的模型中指出,应用rhBMP-2和rhBMP-2联合纤维蛋白的实验组无论在放射学、Micro-CT、组织学还是弯曲力学检查上,均优于空白组及对照组,说明了rhBMP-2对DO具有较强的成骨作用。
3.2 、p38/MMP-2信号通路
DO稳定、持续、缓慢的牵拉提供了一个几乎静态的机械应变力,BMSCs感知静态应变力后,被血管基底膜(vessel of basilar membrane, VBM)释放并迁移到延长区促进骨的再生与修复。p38蛋白作为丝裂原活化蛋白激酶超家族的成员之一,可调节细胞对机械信号的反应及促进细胞迁移。Yang等[24]团队的一项实验中证实了实验组(DO组)大鼠的延长区骨痂中Nestin+/p38+细胞数明显高于对照组(非DO组),且体外实验中具有活性的p38可促进BMSCs的迁移及应用p38的阻断剂后阻断了p38的活化及MMP-2的表达,首次揭示了静态应变通过p38/MMP-2信号通路促进BMSCs迁移。
3.3 、FGF/FGFR信号通路
成纤维细胞生长因子(fibroblast growth factor, FGF)在胞膜上与具有酪氨酸激酶活性的受体FGFR(FGFR1、FGFR2、FGFR3、FGFR4)特异性结合后,引起细胞内信号传导级联反应,其中对DO中成骨细胞具有重要影响。Haque等[25]采用兔胫骨的DO模型分析了FGF1,FGF2,FGF18,IGF1,IGF2,TGFβ1的时间与空间上的分布,结果显示延长期的成骨细胞明显表达FGF2,且FGF18不同于其他影响因子,其在牵拉各个时期均显着表达,提示FGF18对DO的作用尤为显着。Fang等[26]对小鼠下颌骨DO的研究中表明,在截骨后第13天(延长期),正常牵拉组小鼠的FGF2水平是急性延长组小鼠FGF2水平的4倍,正常牵拉组小鼠均获得骨性愈合,而急性延长组小鼠则出现纤维性骨不连的情况,表明FGF2对DO具有重要的成骨作用。
3.4、 SDF-1/CXCR4轴-PI3K/Akt信号通路
细胞基质衍生因子(stromal cell derived factor-1,SDF-1)与G蛋白偶联受体C-X-C基序趋化因子受体(C-X-C motif receptor 4,CXCR4)特异性结合后,PI3K(磷脂酰肌醇3激酶)再被偶联受体上的Gβγ亚基结合,使PIP2磷酸化成PIP3,PIP3作为细胞内重要的第二信使可磷酸化Akt(蛋白激酶B)从而发挥下游的生物学效应。SDF-1/CXCR4轴-PI3K/Akt信号通路作为人体中一条重要的信号通路,有研究表明其不仅对EPCs募集、分化、迁移、抗凋亡具有关键的作用[27,28],也有研究表明其同时对BMSCs具有分化、迁移作用[29,30]。
Fujio等[31]对小鼠DO的实验中证明快速DO组(H-DO)的小鼠局部应用SDF-1后,可募集骨髓的内皮细胞与EPCs加速血管生成从而促进延长区的矿化。Xu等[32]在大鼠DO与骨折的模型中证明,DO组SDF-1和成骨相关基因的表达水平均高于骨折组,SDF-1的峰值出现在牵张期结束时,且在大鼠BMSCs的培养中,应用CXCR4拮抗剂AMD3100后,碱性磷酸酶与早期成骨相关基因表达明显降低。
3.5 、Wnt/β-catenin信号通路
Wnt/β-catenin信号通路又被称为经典的Wnt通路,Wnt与细胞表面受体Frizzled结合后阻止β-catenin降解,上调的β-catenin转移到细胞核后刺激下游相关基因的表达。Wnt/β-catenin信号已被证明可以促进BMSCs向成骨细胞的分化[33]。Wang等[34]对大鼠DO实验中证明,应用Wnt通路拮抗剂rrDkk1后,β-catenin和Lef-1受到抑制,长期的结果显示延长区矿化明显受限,因此Wnt信号通路参与了DO的整个过程。
DO延长区中新血管形成、新骨形成改建塑形受到可受到多条关键信号通路共同调控,经典BMP信号通路、p38/MMP-2信号通路、FGF/FGFR信号通路、SDF-1/CXCR4轴-PI3K/Akt信号通路、Wnt/β-catenin信号通路等在调节新骨形成改建塑形扮演了重要角色,同时SDF-1/CXCR4轴-PI3K/Akt信号通路对延长区中新血管的形成也起到了不可或缺的作用。p38/MMP-2信号通路、SDF-1/CXCR4轴-PI3K/Akt信号通路受到牵张力的刺激后可促进BMSCs向延长区的迁移,当BMSCs到达延长区后又受到经典BMP信号通路、FGF/FGFR信号通路、Wnt/β-catenin信号通路等的调控,促进BMSCs向OBs的分化;SDF-1/CXCR4轴-PI3K/Akt信号通路与此同时调控EPCs的募集、分化,加速延长区中新血管的形成,为成骨过程提供有利的环境。这些信号通路相互联系、互相影响、共同作用。虽然DO中信号通路的研究在某些方面取得了重要进展,但各个通路之间是否存在多个交集、是否单个信号可调控多通路的机制仍未完全明确,有待学者们的进一步研究。
4 、DO中髓腔内的循环
DO依赖于良好循环的建立,因髓腔中无淋巴循环,故主要是延长区新血管的形成,局部血供是新骨形成最基本的条件,各种细胞成分、营养因子多通过血管系统到达所需部位,促进DO中骨的形成、塑形与改建。
正常的骨组织中,滋养血管穿过皮质骨进入髓腔,滋养动脉形成的小分支动脉围绕在滋养静脉形成的中央静脉的周围,部分进入皮质骨哈弗管的细小动脉经血窦回流到小静脉,髓腔内的血液流动呈环形,髓腔中心流向髓腔周围再返回髓腔中心[35]。在DO中,髓腔内血管的再生,为延长区提供了多种循环因子以及细胞,同时迁移的血管内皮细胞是新骨生成与骨改建重塑中的活跃分子。Choi等[36]对大鼠胫骨进行了DO研究,在延长区采用血管铸型与扫描电镜观察的方法,结果显示截骨后髓内小静脉与血窦明显扩张,并且在血窦周围出现了许多新生萌芽血管,延长区内新骨的形成从血窦生成开始,伴随着延长,从截骨面新生的血管相向而行,血管生成与血流量逐渐丰富,但并未进入由成纤维细胞、软骨样细胞与中间态细胞形成的位于延长区中间的纤维间带(fibrous interzone, FIZ)中,延长期结束后,截骨面两侧相向而行的新生血管互相吻合,此后发生骨组织的再生。只有形象的观察正常骨组织与DO中的血液循环,才有助于学者们深入了解DO中新骨形成、塑形与改建这一复杂的新骨形成规律。
5、 骨髓细胞促进DO愈合的临床应用
利用骨髓细胞移植的方式加速DO愈合的报道越来越多,并取得了令人满意的结果。Kitoh等[37]对46例(92侧骨)患者的下肢进行DO技术后采用注射自体骨髓系细胞(bone marrow cells, BMC)联合富血小板血浆(platelet-rich plasma, PRP)治疗的临床研究中表明,注射BMC+PRP治疗组患者的愈合指数明显小于未注射的对照组,治疗组未出现延迟矿化,对照组有45%的患者出现延迟矿化,两组有关并发症发生率分别为6%和23%,各数据差异均有统计学意义。同时发现注射BMC+PRP后股骨的治疗效果优于胫骨。Memeo等[38]对8例因软骨发育不全而行DO延长术治疗但发生延迟愈合的患者采用了注射自体浓缩骨髓抽吸物(bone marrow aspirate concentrate, BMAC),经髂骨骨髓抽取的BMAC富含干细胞、单核细胞、淋巴细胞及骨髓固有细胞等有核细胞,将BMAC注射到延长区的新生骨中。术后所有8例患者的新生骨的质量得到改善,延迟愈合平均恢复时间为5.2个月,愈合指数18.7~23.8 d/cm, 平均23.1 d/cm。Memeo等[38]可能是首次使用BMAC治疗因软骨发育不全患者行DO中延迟愈合的问题。Lee等[39]对20例行DO延长双侧胫骨的患者进行随机分组后,治疗组中10例(20侧胫骨)患者注射自体BMAC+PRP,而对照组未注射。术后治疗组的每侧皮质愈合指数及完全负重指数均小于对照组,差异有统计学意义,提示了治疗组的骨愈合较快且较早达到完全负重,证明了在DO中截骨部位应用BMAC+PRP有助于促进骨愈合。Lim等[40]对1例下颌骨发育不良的患者采用了DO矫正畸形,为缩短治疗周期,该团队将取自患者髂骨的骨髓分离出BMSCs, 经传代培养后分化为OBs, 注射到矿化期的延长区中。该患者获得了有效愈合且没有出现任何并发症。
由于骨髓细胞富含单个核细胞,其成分较多,具有较强的分化能力,在骨愈合方面具有很高的潜力;富血小板血浆中同时富含一些营养因子。因此究竟是骨髓细胞或是富血小板血浆起主要作用,亦或是两者对于加速DO愈合同等重要,尚未有明确报道。仍有待学者们的进一步探索。
6、 总结与展望
本文以骨髓细胞在DO中作用机制为切入点,总结骨髓中与DO有关的细胞(如BMSCs、EPCs、OBs、OCs等)及其发生、细胞间的相互作用、细胞相关通路等,发现各司其能的同时又共同调控延长区新血管形成和新骨的形成改建塑形,通过简述DO髓腔内的循环有助于加深了解DO这一复杂的新骨形成规律,列举骨髓系细胞的临床应用有力的佐证了骨髓细胞在DO中不可或缺的地位。
目前学者们多以骨膜为切入点研究DO的作用机制,但骨髓与骨膜同为骨骼系统的重要组成部分,共同调控DO这一过程。经查阅相关文献后,骨髓细胞在DO中的作用机制相对较少。骨髓细胞间通过何种具体机制相互作用共同DO愈合仍未明确,未来的研究方向应着重于细胞间的相互作用,因为生物学效应依赖多细胞的共同的作用。在DO中,临床医师在详细了解每种细胞的分子机制、细胞间相互作用及生物信号通路等更能造福患者并推动DO技术的发展。
DO技术通过对所牵拉组织施加缓慢、持续、稳定的牵张力,可使相应组织细胞发生类似于胚胎再发育的过程。经过半个多世纪的发展,此技术应用于多种难治性疾病并取得了显着成效,伴随着新研究方法的出现,可能发现更多的机制以及某些已发现的机制需要进一步的完善。
参考文献
[1] 王斌,宫中平,刘英杰,等.腓骨横向骨搬移微血管网再生术治疗糖尿病足[J].中华医学杂志,2020,100(9):710-711.
[2] 付繁刚,张锴.骨膜在牵拉成骨中的作用研究进展[J].中国修复重建外科杂志,2017,31(7):876-879.
[3] Jia Y,Qiu S,Xu J,et al.Exosomes secreted by young mesenchymal stem cells promote new bone formation during distraction osteogenesis in older rats[J].Calcif Tissue Int,2020,106(5):509-517.
[4] Jia Y,Zhu Y,Qiu S,et al.Exosomes secreted by endothelial progenitor cells accelerate bone regeneration during distraction osteogenesis by stimulating angiogenesis[J].Stem Cell Res Ther,2019,10(1):12.
[5] Akcay H,Kuru K,Tatar B,et al.Vitamin E promotes bone formation in a distraction osteogenesis model[J].J Craniofac Surg,2019,30(8):2315-2318.
[6] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[7] 王斯琪,卢海源,程腊梅.3种不同组织来源的间充质干细胞促内皮祖细胞血管形成作用的比较[J].中南大学学报(医学版),2018,43(2):184-191
[8] Lee DY,Cho TJ,Lee HR,et al.Distraction osteogenesis induces endothelial progenitor cell mobilization without inflammatory response in man[J].Bone,2010,46(3):673-679.
[9] Lee DY,Cho TJ,Kim JA,et al.Mobilization of endothelial progenitor cells in fracture healing and distraction osteogenesis[J].Bone,2008,42(5):932-941.
[10] Wu L,Zhao X,He B,et al.The possible roles of biological bone constructed with peripheral blood derived EPCs and BMSCs in osteogenesis and angiogenesis[J].Biomed Res Int,2016,2016:8168943
[11] Qin Y,Zhang C.Endothelial progenitor cell-derived extracellular vesicle-meditated cell-to-cell communication regulates the proliferation and osteoblastic differentiation of bone mesenchymal stromal cells[J].Mol Med Rep,2017,16(5):7018-7024.
[12] Yu J,Jiang L,Gao Y,et al.Interaction between BMSCs and EPCs promotes IUA angiogenesis via modulating PI3K/Akt/Cox2 axis[J].Am J Transl Res,2018,10(12):4280-4289.
[13] Redlich K,Smolen JS.Inflammatory bone loss:pathogenesis and therapeutic intervention[J].Nat Rev Drug Discov,2012,11(3):234-250.
[14] Boyle WJ,Simonet WS,Lacey DL.Osteoclast differentiation and activation[J].Nature,2003,423(6937):337-342.
[15] Feng X,Mcdonald JM.Disorders of bone remodeling[J].Annu Rev Pathol,2011,6:121-145.
[16] 谢冰洁,冯捷,韩向龙.破骨细胞生物学特征的研究与进展[J].中国组织工程研究,2017,21(11):1770-1775.
[17] Chen D,Zhao M,Mundy GR.Bone morphogenetic proteins[J].Growth Factors,2005,22(4):233-241.
[18] Daigang L,Jining Q,Jinlai L,et al.LPS-stimulated inflammation inhibits BMP-9-induced osteoblastic differentiation through crosstalk between BMP/MAPK and Smad signaling[J].Exp Cell Res,2016,341(1):54-60.
[19] 任志勇,邱世超,黄现峰.骨形态发生蛋白2基因修饰自体骨髓间充质干细胞移植促进兔胫骨牵张成骨的实验研究[J].中国矫形外科杂志,2014,22(5):453-457.
[20] Zeng JJ,Guo P,Zhou N,et al.Treatment of large bone defects with a novel biological transport disc in non-vascular transport distraction osteogenesis[J].Int J Oral Maxillofac Surg,2016,45(5):670-677.
[21] Chen G,Deng C,Li YP.TGF-β and BMP signaling in osteoblast differentiation and bone formation[J].Int J Biol Sci,2012,8(2):272-288.
[22] Khanal A,Yoshioka I,Tominaga K,et al.The BMP signaling and its Smads in mandibular distraction osteogenesis[J].Oral Dis,2008,14(4):347-355.
[23] Li Y,Li R,Hu J,et al.Recombinant human bone morphogenetic protein-2 suspended in fibrin glue enhances bone formation during distraction osteogenesis in rabbits[J].Arch Med Sci,2016,12(3):494-501.
[24] Yang Z,Wu B,Jia S,et al.The mechanically activated p38/MMP-2 signaling pathway promotes bone marrow mesenchymal stem cell migration in rats[J].Arch Oral Biol,2017,76:55-60.
[25] Haque T,Amako M,Nakada S,et al.An immunohistochemical analysis of the temporal and spatial expression of growth factors FGF 1,2 and 18,IGF 1 and 2,and TGFbeta1 during distraction osteogenesis[J].Histol Histopathol,2007,22(2):119-128.
[26] Fang TD,Nacamuli RP,Song HM,et al.Creation and characterization of a mouse model of mandibular distraction osteogenesis[J].Bone,2004,34(6):1004-1012.
[27] Madeddu P,Kraenkel N,Barcelos LS,et al.Phosphoinositide 3-kinase gamma gene knockout impairs postischemic neovascularization and endothelial progenitor cell functions[J].Arterioscler Thromb Vasc Biol,2008,28(1):68-76.
[28] Miriuka SG,Rao V,Peterson M,et al.mTOR inhibition induces endothelial progenitor cell death[J].Am J Transplant,2006,6(9):2069-2079.
[29] Meng J,Ma X,Wang N,et al.Activation of GLP-1 Receptor Promotes Bone Marrow Stromal Cell Osteogenic Differentiation through β-Catenin[J].Stem Cell Reports,2016,6(4):579-591.
[30] Yu J,Li M,Qu Z,et al.SDF-1/CXCR4-mediated migration of transplanted bone marrow stromal cells toward areas of heart myocardial infarction through activation of PI3K/Akt[J].J Cardiovasc Pharmacol,2010,55(5):496-505.
[31] Fujio M,Yamamoto A,Ando Y,et al.Stromal cell-derived factor-1 enhances distraction osteogenesis-mediated skeletal tissue regeneration through the recruitment of endothelial precursors[J].Bone,2011,49(4):693-700.
[32] Xu J,Chen Y,Liu Y,et al.Effect of SDF-1/Cxcr4 signaling antagonist AMD3100 on bone mineralization in distraction osteogenesis[J].Calcif Tissue Int,2017,100(6):641-652
[33] Qiu W,Andersen TE,Bollerslev J,et al.Patients with high bone mass phenotype exhibit enhanced osteoblast differentiation and inhibition of adipogenesis of human mesenchymal stem cells[J].J Bone Miner Res,2007,22(11):1720-1731.
[34] Wang X,Luo E,Bi R,et al.Wnt/β-catenin signaling is required for distraction osteogenesis in rats[J].Connect Tissue Res,2018,59(1):45-54.
[35] Travlos GS.Normal structure,function,and histology of the bone marrow[J].Toxicol Pathol,2006,34(5):548-565.
[36] Choi IH,Ahn JH,Chung CY,et al.Vascular proliferation and blood supply during distraction osteogenesis:a scanning electron microscopic observation[J].J Orthop Res,2000,18(5):698-705.
[37] Kitoh H,Kitakoji T,Tsuchiya H,et al.Transplantation of culture expanded bone marrow cells and platelet rich plasma in distraction osteogenesis of the long bones[J].Bone,2007,40(2):522-528.
[38] Memeo A,Verdoni F,Ingraffia C,et al.Mesenchymal stem cells as adjuvant therapy for limb lengthening in achondroplasia[J].J Pediatr Orthop B,2019,28(3):221-227.
[39] Lee DH,Ryu KJ,Kim JW,et al.Bone marrow aspirate concentrate and platelet-rich plasma enhanced bone healing in distraction osteogenesis of the tibia[J].Clin Orthop Relat Res,2014,472(12):3789-3797.
[40] Lim HJ,Lee EM,Kim WK,et al.Application of autologous human bone marrow-derived mesenchymal stem cells in distraction osteogenesis for the treatment of bilateral mandibular hypoplasia[J].J Craniofac Surg,2018,29(6):1629-1632.
骨髓基质细胞(BMSCs)是干细胞及处于不同分化阶段的前体细胞的混合物,具有自我更新能力及多向分化潜能。由于取材方便、创伤小,用于细胞移植和基因治疗有许多优势,具有很好的临床应用前景。由于骨髓中细胞成分比较混杂,BMSCs在骨髓中含量极少,仅占骨髓中...
骨髓基质干细胞(BMSCS)是具有多项分化潜能的干细胞,体外诱导培养表达成骨、神经分化等细胞表型是现代研究热点及难点。现代医学对其促分化及影响因子进行了积极的科研探索。现代基础研究多应用骨髓基质干细胞经典成骨诱导基本辅剂(地塞米松、-甘油磷酸钠...
磁性纳米材料指尺度为1~100nm的磁性材料,目前以铁系氧化物居多。磁性纳米材料通常在磁性纳米颗粒表面修饰上多种生物大分子或者靶的配体,这样就既具备良好的磁导向性,也具有良好的生物相容性或者靶向性,可与多种功能分子如蛋白质、核酸和维生素等结...
人骨髓间充质干细胞(bonemarrowmesenchy-malstemcells,BMMSCs)具有较强的增殖和多向分化潜能,相较于胚胎干细胞、脐血干细胞和神经干细胞,其伦理学限制较少,有利于基础和临床研究的大范围开展,且BMMSCs自体移植免疫原性更低,可作为良好的供体与...
由于近年来对癌症病人治疗方案(化疗、放疗、骨髓移植)的不断完善,癌症患者长期存活数明显增长,而对于许多年轻的生育期女性存活者来说,经常会出现闭经、不孕及卵巢早衰的临床表现,但是其中许多人都希望建立家庭后可以恢复生育能力,可以拥有属于自己的...
ESM-1是具有多种生物学活性的细胞因子。本课题组前期研究证实,ESM-1预处理MSCs后可提高其存活、增殖能力,增加干细胞移植后的梗死周围心肌组织血管形成[1,2].目前ESM-1改善MSCs生物学特性的具体机制尚不明确。因此,本实验对其可能机制进行探讨...
骨髓间充质干细胞具有自我更新、增殖潜能和分化成多种细胞类型的能力, 包括成骨细胞、脂肪细胞、软骨细胞、神经元等。骨髓间充质干细胞向脂肪细胞和成骨细胞的分化是竞争性调节的[4,5], 在骨微环境平衡中起着关键的作用。...
间充质干细胞(mesenchymalstemcells,MSCs)具有高度增殖和多谱系分化能力,与各种组织的功能维持与修复再生有着密切的联系。但MSC可在体内外环境的影响下,出现增殖能力下降,甚至发生凋亡等现象。在这些影响因素中,活性羰基类物质(reactivecarbonyl...
IL-18能明显诱导hBMSC的成骨分化作用,进一步证明脾脏在骨折愈合过程发挥重要作用。因此骨折合并脾损伤需手术治疗时术中应尽量保留脾脏,以保证术后患者免疫功能的稳定。...
1993年ODown等[1]首次发现7次螺旋的跨膜区段组成的G蛋白偶联受体APJ(apelin-angioten-sinreceptor-like,APJ).1998年,Tatemoto等[2]从牛的胃蛋白提取并纯化APJ的内源性配体apelin.Apelin/APJ系统组织分布广泛,生物学功能多样。研究...