人骨髓间充质干细胞( bone marrow mesenchy-mal stem cells,BMMSCs) 具有较强的增殖和多向分化潜能,相较于胚胎干细胞、脐血干细胞和神经干细胞,其伦理学限制较少,有利于基础和临床研究的大范围开展,且 BMMSCs 自体移植免疫原性更低,可作为良好的供体与宿主细胞进行更好的整合,是治疗 中 枢 神 经 系 统 疾 病 的 理 想 载 体。但BMMSCs 在骨髓细胞中所占比例较小,且分化细胞存活时间较短。本研究旨在建立成熟的细胞培养模型,以 获 得 大 量 纯 度 较 高 的 BMMSCs,并 提 高BMMSCs 向 神 经 细 胞 分 化 后 的 存 活 时 间,为BMMSCs 的临床应用提供实验基础。
1 材料与方法
1. 1 骨髓采集 选取 2005年 6 月在郑州大学医学院第一附属医院门诊因不明原因发热就诊的患者 5例,其中男 2 例,女 3 例,年龄 20 ~ 51 岁,平均( 36. 40 ±11. 61) 岁。无菌条件下用骨髓穿刺针在髂骨处抽取骨髓,每例 3 ~5 mL,置于 4 ℃抗凝管中备用。患者对实验知情同意。
1. 2 主要试剂与仪器 Dulbecco's 改良 Eagle 培养基( Dulbecco' s modified Eagle' s medium,DMEM/F12) ( 美国 Gibco 公司) ,胎牛血清( fetal bocine ser-um,FBS) ( 美国 Hyclone 公司) ,β-巯基乙醇( β-mer-captoethanol,BME) 、3-丁基-4-羟基茴香醚( 3-tert-bu-ty-4-hydroxyanisole,BHA) 、二甲基亚砜( dimethylsul-foxide,DMSO) 、脑源性神经生长因子( brain-derivedneurotrophic factor,BDNF) 、牛血清蛋白( bovine ser-um albumin,BSA) ( 美国 Sigma 公司) ,淋巴细胞分离液( 天津森润生物技术有限公司) ,磷酸盐缓冲液( phosphate buffer solution,PBS) ( 北京康为世纪生物科技有限公司) ,山羊抗人神经元特异性烯醇化酶( neuron specific enolase,NSE) 多克隆抗体、异硫氰酸荧光素( fluorescein isothiocyanate,FITC) 标记兔抗山羊二抗( 北京中杉生物技术有限公司) 。倒置显微镜( 日本 Olympus 公司) ,细胞培养箱( 美国 Thermo 公司) ,高速离心机( 上海安亭科学仪器厂) ,医用净化工作台( 苏州高新净化工程有限公司) 。
1. 3 BMMSCs 分离培养 用无菌 PBS( pH = 7. 2)将抗凝骨髓 1∶1 稀释混匀,再 1∶1 等体积叠加到淋巴细胞分离液上,1 800 r·min- 1离心 20 min。Pasteur 吸管吸取单核细胞层,PBS 洗涤后加入含体积分数 15%FBS 的 DMEM/F12 完全培养液,调整细胞密度至 1 × 109L- 1,接种于培养瓶,37 ℃ 体积分数 5%CO2细胞培养箱培养。倒置显微镜观察细胞生长情况。
1. 4 BMMSCs 传代培养 原代细胞( P0) 贴壁生长达 80%融合时加入 37 ℃质量分数 0. 25%的胰蛋白酶1 mL 消化贴壁细胞。待细胞收缩变圆,细胞间隙不断增大,加入含 FBS 的 DMEM/F12 培养液终止消化。Pasteur 吸管吹打使贴壁细胞完全悬浮,PBS 洗涤后,加入 DMEM/F12 完全培养液置培养箱中传代培养。倒置显微镜下观察细胞生长情况。
1. 5 BMMSCs 分化培养 选第 4 代细胞( P4) 以1 × 108L- 1细胞密度接种于培养瓶和 6 孔板中( 孔中预置用多聚赖氨酸处理的盖玻片) ,待细胞生长达到80% 融合时弃去培养液,诱导组加入含体积分数 20%FBS 预 诱 导 剂 ( DMEM / F12 + 1 × 10- 3mol · L- 1BME + 50 μg·L- 1BDNF) ,24 h 后去除预诱导剂,再加入含体积分数 2% DMSO 诱导剂( DMEM/F12 +1 × 10- 3mol·L- 1BME + 2 × 10- 4mol·L- 1BHA +50 μg·L- 1BDNF) 进行诱导。对照组不加预诱导剂和诱导剂。倒置显微镜观察细胞生长情况。
1. 6 免疫荧光细胞化学染色 分化细胞进行 NSE免疫荧光染色。取生长有细胞的盖玻片,体积分数4% 多聚甲醛固定 10 min,体积分数 3% H2O2室温孵育 10 min,体积分数 5%BSA 封闭 10 min,加入山羊抗人 NSE 多克隆抗体( 1∶200) ,并设阴性对照,用 PBS 代替一抗,4 ℃ 过夜,37 ℃ 孵育 2 h,然后在避光条件下,加入 FITC-标记兔抗山羊二抗,37 ℃孵育 40 min 后荧光封片剂封片。
1. 7 细胞增殖活性的测定 收集不同发育阶段的细胞,分为对照组和诱导组。诱导前 P4BMMSCs 为对照组,诱导分化细胞为诱导组。诱导组又分为诱导 1 d 组( 诱导分化第 1 天细胞) 、诱导 2 d 组( 诱导分化第 2 天细胞) 和诱导 3 d 组( 诱导分化第 3 天细胞) 。将 4 组细胞进行碘化丙啶染色: 细胞经 PBS洗涤,用体积分数 70%的乙醇固定,500 μL RNaseA酶缓冲液( 100 mg·L- 1RNaseA + 20 mg·L- 1碘化丙啶) 避光染色 30 min。用流式细胞仪分析细胞周期变化。每组计数 10 000 个细胞。
1. 8 统计学处理 应用 SPSS 13. 0 软件进行统计分析,计量资料以均数 ± 标准差( x珋 ± s) 表示,组间比较采用 t 检验,P <0. 05 为差异有统计学意义。
2 结果
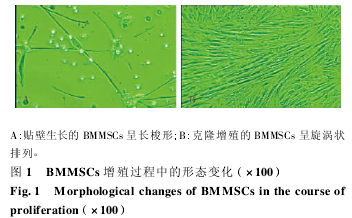
2. 1 BMMSCs 的分离和传代培养 骨髓离心获得单个核细胞接种培养 72 h 后,可见有少许细胞开始贴壁生长,其胞体狭长,散在分布( 图 1A) 。7 ~9 d,部分长梭形细胞增殖形成集落,未贴壁细胞在连续换液中被不断清除。15 ~ 20 d,梭形细胞呈极性或旋涡状排列,形态一致( 图 1B) 。传代后,细胞增殖旺盛,其形态保持梭形无变化。随传代次数增加,BMMSCs 得到不断纯化和扩增。
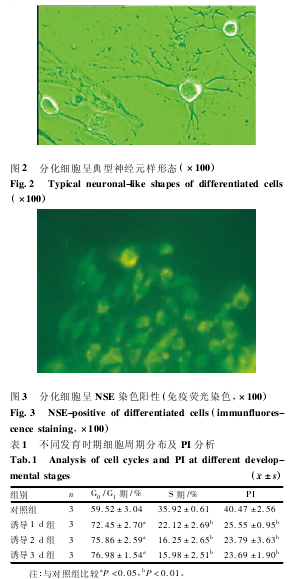
2. 2 BMMSCs 的分化培养及鉴定 对 BMMSCs 进行诱导,加入预诱导剂 24 h 后,梭形细胞折光性降低。加入诱导剂 2 h 后即可见其胞体开始向细胞核方向收缩,并伸出较短突起。6 h 后胞体收缩呈圆形,折光性强,细胞突起继续延长,类似于神经元轴突的单个长突起,呈典型神经元的形态( 图 2) 。细胞诱导 4 ~10 h,对分化细胞固定进行 NSE 免疫荧光染色,阳性细胞呈绿色荧光( 图 3) 。
2. 3 细胞增殖活性的测定 将 S + G2/ M 期的细胞百分比作为增殖指数( proliferation index,PI) 判定细胞增殖活性。结果显示,诱导前 P4细胞( 对照组) PI较高,说明细胞增殖旺盛,增殖能力较强。与对照组比较,诱导后的细胞发生 G0/ G1期阻滞,各诱导组 S期细胞比例及 PI 均显着降低( P <0. 01) ,说明细胞增殖明显抑制。而各诱导组之间细胞比例无明显变化( P >0. 05) ,说明细胞处于较稳定的存活及分化状态; 见表 1。
3 讨论
神经退行性疾病的功能恢复是医学界急需解决的难题之一,BMMSCs 增殖与分化研究为临床治疗提供了新思路。但 BMMSCs 在骨髓细胞中所占比例较小,如何分离获得 BMMSCs 并在体外大量扩增,是进行 BMMSCs 相关研究和临床治疗的关键。本研究通过密度梯度离心获得含有 BMMSCs 的单核细胞悬液,经多次连续传代,获得大量增殖旺盛的长梭形 BMMSCs。细胞周期检测显示 P4细胞( 对照组) PI 较高,说明细胞增殖活性较强,处于较活跃的DNA 合成和分裂期,表明分离培养的 BMMSCs 具有良好持续增殖和稳定传代能力,细胞的形态特点和克隆增殖能力与 Jung 等报道基本相同。
本研究采用改良的化学诱导法,以 DMSO 和BHA 为基础诱导剂,联合 BDNF 将 BMMSCs 定向诱导为神经元细胞,分化后的细胞具有典型神经元的形态。免疫荧光染色结果也显示多数分化的细胞表达 NSE,本实验室以往研究已经证实 BMMSCs 能高效分化为神经元样细胞,与 Woodbury 等结果一致。另外,诱导剂中存在的 BDNF 是神经营养因子家族中的重要成员。研究表明,机体发育期 BD-NF 对神经元存活及诱导分化有重要作用,而且对成体神经元再生修复也起保护作用。结果显示,细胞分化各阶段,各诱导组之间细胞周期比例无明显变化,细胞处于较稳定的存活及分化状态,说明 BD-NF 发挥了神经细胞的保护作用,对诱导生成的神经元样细胞具有较好的营养作用,能防止分化细胞受损死亡。结果说明本实验室能高效稳定地诱导BMMSCs 向神经细胞定向分化。当然,BMMSCs 向神经细胞分化的过程涉及细胞自身多种特异性基因的多个步骤的调控,其确切诱导机制还需进一步研究。
总之,本研究采用密度梯度离心法结合贴壁培养法,在体外分离扩增和纯化 BMMSCs,并成功诱导其分化为神经元样细胞。但分化的神经元样细胞是否具有一定的电生理特性,移植到体内后是否可以存活,与体内神经元是否能建立突触联系等问题,将是下一步深入研究的方向。
参考文献:
[1] 王昭霞,邹亚伟,李敏敏,等. 急性淋巴细胞白血病患儿骨髓间充质干细胞对 K562 和 K562/AO2细胞耐药的影响[J]. 实用儿科临床杂志,2012,27( 19) : 1507-1510.
[2] 高飞,袁正伟. 骨髓间充质干细胞在先天性脊柱裂胎鼠脊髓中的分化[J]. 实用儿科临床杂志,2012,27( 11) : 870-872,888.
[3] Camassola M,de Macedo Braga L M,Chagastelles P C,et al. Meth-odology,biology and clinical applications of human mesenchymalstem cells[J]. Methods Mol Biol,2012,879: 491-504.
[4] 张新宇,付学锋. 骨髓间充质干细胞定向分化移植对阿尔茨海默病大鼠学习记忆能力的影响[J]. 新乡医学院学报,2012,29( 2) : 96-101.
[5] Jung S,Sen A,Rosenberg L,et al. Human mesenchymal stem cellculture: rapid and efficient isolation and expansion in a defined ser-um-free medium[J]. J Tissue Eng Regen Med,2012,6 ( 5) : 391-403.
[6] 邢莹,白瑞樱,鄢文海,等. 人骨髓间充质干细胞向神经细胞分化过程中 Notch 通路信号分子表达的变化[J]. 生理学报,2007,59( 3) : 267-272.
[7] Woodbury D,Schwarz E J,Prockop D J,et al. Adult rat and humanbone marrow stromal cells differentiate into neurons[J]. NeurosciRes,2000,61( 4) : 364-370.
[8] 孙萌萌,刘兰芬. 脑源性神经营养因子 BDNF 与精神分裂症的关联性研究进展[J]. 精神医学杂志,2011,24( 5) : 392-394.