
角质形成细胞是鳞状上皮细胞的主要组成成分,具有广泛的生物学特性。常见的鳞状上皮细胞有皮肤和口腔黏膜上皮细胞,当其出现大面积损伤时创口自身不能正常愈合,只能通过组织移植来补偿缺损的组织面。皮肤或口腔黏膜是容易接触一些药物或材料刺激的组织,因此探讨皮肤或口腔黏膜组织对于临床药物和材料的反应是重要的研究课题。
体外细胞检测模型一般来自患者的原代培养细胞或来自肿瘤、遗传物质突变的转化细胞系,但原代细胞培养获得的细胞有限,传代后组织特异性也逐渐丧失,且组织来源不同的原代细胞培养所得出的测定数据差异较大,不是毒理学研究的理想细胞; 转化细胞容易获得并易于维持,稳定性高,可重复性好,但其具有肿瘤细胞的特性,例如生长失去控制、接触抑制丧失、细胞外形改变、核型异常等[1],也不是毒理学研究的理想模型,因此,急需建立新的外源性化合物安全性的评价模型。人胚胎干细胞( hu-man embryonic stem cells,hESCs) 是健康和永生的单一胚胎细胞来源的人类样本,既可真实反映人类生物学特征[2],又可通过单一胚胎细胞无限增殖和定向分化达到样本高度标准化[3],可能成为预测受试物细胞毒性和遗传毒性的体外替代实验模型[4],为体外安全性评价提供了新的希望。将 hESCs 诱导分化为角质形成细胞目前暂无标准化方法,研究发现通过形成拟胚体( embryonic body,EB) 的方法获得的角质形成细胞增殖能力过低,不利于组织发育[5]; 2008 年,Metallo 等[6]用直接诱导法将 hESCs诱导分化为上皮细胞的前体细胞,并比较了 EB 法和直接诱导法诱导 hESCs 5 周后获得的细胞角蛋白( cytokeratin,CK) 14 的阳性表达率( 15% vs. 87%) ,发现直接诱导法具有显著的优势。
人永生化口腔上皮细胞系( human immortalizedoral epithelial cells,HIOECs) 是用人乳头瘤状病毒E6、E7 开放读码框架转染原代培养的正常口腔上皮细胞后建立的[7],HIOECs 具有与口腔黏膜上皮细胞相似的形态和生化特性,所建模型可被用于评价药物在口腔吸收机制的研究[8].人永生化皮肤角质形成细胞 HaCaT 是由成人皮肤转染猴空泡病毒40( simian virus,SV40) 后发生自分化的未成瘤的永生化皮肤角质形成细胞系[9].
本课题组前期实验亦通过直接诱导法将 hESCs诱导分化为上皮样细胞[10],但尚不清楚所得到的上皮样细胞是否仍保持正常的染色体核型,其进一步分化是趋向于发展为皮肤上皮还是口腔黏膜上皮,以及能否作为将来毒理学的检测模型。本研究对得到的上皮样细胞进行了染色体核型的分析,在基因水平上探讨了由 hESCs 诱导 K-hESCs 过程中多能性标志物及上皮相关标志物的表达变化; 并以人原代牙龈上皮细胞 ( human gingival epithelial cells,HGECs) 、HIOECs 和 HaCaT 作为对照细胞,通过实时定量荧光 PCR 方法检测了其诱导末期人胚胎干细胞源角质形成细胞( keratinocyte derived from hu-man embryonic stem cells,K-hESCs) 与对照细胞上皮相关标志物基因表达的差异性; 在蛋白水平上,通过免疫组织化学方法探讨了多种上皮细胞相关标志物在 K-hESCs 和对照细胞中的表达差异。
1 材料与方法
1. 1 材料
研究所用明胶、Matrigel 购自美国 BD 公司,胚胎干细胞完全培养基( mTeSR1) 购自美国 Stem Cell公司,中性蛋白酶购自德国 Roche 公司,CK、波形蛋白( vimentin,VIM) 抗体购自美国 Santa Cruz 公司,细胞培养瓶及培养皿购自美国 Corning 公司,通用型二步法检测试剂盒购自美国 GBI 公司,TritonX-100 购自美国 Amresco 公司,Gimsa 染液购自北京Solarbio 公司; 其他研究所用材料全部购自美国Invitrogen 公司。
1. 2 细胞培养
1. 2. 1 hESCs 的培养 人胚胎干细胞系 H9 ( H9-hESCs) 由新加坡国立大学提供,将其培养于 Matri-gel 上,培养液为胚胎干细胞完全培养基,每天换液,细胞接近汇合时用 1 g/L 的中性蛋白酶,37 ℃消化5 min,机械刮除,800 r / min 离心 5 min,1 ∶ 6 传代。
1. 2. 2 HGECs 的原代培养 选择拟行阻生牙拔除术、无口腔黏膜疾病且冠周龈组织无炎症表现的患者,术前征得患者同意,术中收集拔除牙齿上附带的牙龈组织,采用组织块法在无血清上皮培养基( de-fined keratinocyte serum-free medium and supplement,D-KSFM) 中培养获得 HGECs.本研究获得北京大学生物医学伦理委员会批准( 批准号: PKUSSIRB-201310055) .
1. 2. 3 HIOECs 及 HaCaT 培养 分别使用 D-KSFM和含 10%( 体积分数) 血清的 DMEM 高糖培养基培养 HIOECs 与 HaCaT,传代时均用胰酶 37 ℃分别消化 5 min 和1 min,用含血清培养基中和,前者600 r/min 离心 10 min,后者 1 000 r / min 离心 5 min,1 ∶ 3传代。
1. 3 诱导 hESCs 分化为 K-hESCs.H9-hESCs 常规传代后第 2 天,将 hESCs 完全培养基 换 成 上 皮 分 化 诱 导 液 ( 体 积 分 数 98% 的DMEM / F12 培养基,含有 1 × N2 补充成分、1 μmol /L 维甲酸、25 μg / L 骨形成蛋白 4) ,每天换液,连续诱导 7 天,第 7 天传代。传代时用 1 g/L 的中性蛋白酶,37 ℃消化 5 min,机械刮除,D-KSFM 重悬,200 × g 离心 4 min,D-KSFM 重悬轻吹匀,1 ∶ 3 传代至明胶铺被的板子上,晃匀,隔天换液。P1 代第 10天时 K-hESCs 用胰酶 37 ℃消化 1 min,含血清培养基中和,200 × g 离心 4 min,D-KSFM 重悬轻吹匀,1 ∶ 1 传代至明胶铺被的板子上,晃匀,隔天换液。
1. 4 Real-time PCR 检测方法。
Trizol 法提取细胞总 RNA,取 2 μL RNA 检测纯度和浓度,20 μL 体系逆转录为 cDNA,以 GAPDH 为内参,PCR 引物序列见表 1,20 μL 体系在7500 实时PCR 检测仪( 美国 ABI 公司) 上行定量 PCR 检测。

1. 5 免疫细胞化学检测
将细胞均匀接种在无菌的载玻片上,待贴壁生长至合适密度后,95% ( 体积分数) 乙醇固定 30min,PBS 冲洗,0. 1% ( 体积分数) Triton-X 100 室温处理 15 min,PBS 冲洗; 10% ( 质量分数) H2O2室温处理 10 min,PBS 冲洗; 滴加一抗,4 ℃ 过夜。第 2天滴加二抗试剂,室温孵育 30 min,PBS 冲洗; DAB室温显色,苏木素复染,脱水,透明,封片。
SOX2[SRY-related high-mobility-group ( HMG) -box protein-2 ]、OCT4 ( octamer-binding transcriptionfactor-4) 、CK1、P63 以核内有着色颗粒为阳性判断标准,余以细胞浆内有着色颗粒为阳性判断标准。采用半定量分析判定阳性表达强度,无着色颗粒或阳性细胞数少于 5% 为阴性( - ) ,着色且着色总面积在5% ~10%为弱阳性( +) ,着色总面积在 11%-50% 为中等阳性( + + ) ,着色总面积大于 50% 者为强阳性( + + +) .
1. 6 二倍体检测
生长状态良好的 K-hESCs,加入 0. 012 mg/L 秋水仙素培养 8 h,收集细胞,加入预温至 37 ℃ 的0. 075 mmol / L KCl 溶液 5 mL,置 37 ℃ 15 min,用3 ∶ 1 甲醇冰醋酸固定 3 次,滴到预冷的载玻片上,70 ℃ 3 h 烤片。Gimsa 染色 10 min,水洗,显微镜下观察染色体并进行核型分析。
1. 7 统计学分析
利用 SPSS 16. 0 软件进行统计学分析,采用多组间比较的单因素方差分析、成组设计多个样本比较的秩和检验( Kruskal-Wallis 法) 及完全随机设计两独立样本的秩和检验分析方法,P < 0. 05 为差异有统计学意义。
2 结果
2. 1 培养细胞形态和鉴定
2. 1. 1 细胞形态 原代培养的 HGECs 呈铺路石样紧密排列的上皮样细胞形态,细胞大小一致,形态规则,细胞核清晰( 图 1A) ; HIOECs 为分散生长的多角形上皮样细胞,细胞大小较一致,生长较慢( 图 1B) ;HaCaT 细胞呈克隆状聚集生长,细胞为多角形,长满后也为铺路石样,生长较快( 图 1C) .未分化的H9-hESCs在 Matrigel 上细胞成团克隆状生长,饱满厚实,排列紧密,形似鸟巢,细胞之间界限不清,胞体体积小,核大,有1 个或几个核仁,细胞增殖并保持未分化状态( 图1D) .用上皮分化培养基诱导得到的 P1代细胞以组织块贴壁细胞为中心呈现克隆状生长,细胞呈铺路石状,排列紧密; 以小圆形、多角形为主的上皮样细胞,克隆中央的细胞较小且排列较紧密,克隆周围的细胞较大且大小较一致,细胞核清晰( 图 1E) ,类似于 HGECs,我们将其称为人胚胎干细胞源角质形成细胞 K-hESCs.从 P1 代第 8 天开始,克隆周围的细胞开始收缩卷边,细胞变大、变长且细胞内出现空泡和颗粒,细胞间连接变稀疏,到第15 天左右大多数细胞凋亡。P2 代细胞贴壁量较少,分散生长,细胞增殖速度变慢,细胞形态改变,表现为胞体变大、核模糊、出现空泡、死亡脱落( 图 1F) .
2. 1. 2 细胞鉴定 细胞免疫化学的实验结果显示,原代培养的 HGECs,CK 表达阳性( 图 2A) ,VIM 表达阴性( 图2B) ; H9-hESCs 的 SOX2 及 OCT4 表达阳性( 图 2C 和 2D) .9 种上皮相关标志物在 hESCs、K-hESCs( P0 代及 P1 代) 和 HaCaT 中的免疫组织化学染色结果见表 2 和图 3.


2. 2 Real-time PCR 结果
在 H9-hESCs 诱导为 K-hESCs 的过程中,胚胎干细胞多能性标志物 OCT4 和 NANOG 基因的表达直线下降,角质形成细胞干性标志物 CK18 和 p63基因的表达整体呈现先上升后下降趋势,而 CK14基因的表达在 P0 代稍微下降,在 P1 代呈不断上升趋势。H9-hESCs 与 P1 代第 7 天时的 K-hESCs 相比,OCT4、NANOG、CK18、p63、CK14 的表达差异均有统计学意义( 配对 t 检验,P 分别为 0. 016、0. 023、0. 011、0. 030、0. 013,图 4) .
比较角质形成细胞标志物 p63、CK18、CK14 在K-hESCs ( P1 代 第 7 天 时 ) 、HGECs、HIOECs 及HaCaT 中的基因表达差异。 由图 5 可见,与 K-hESCs 相比,基因 p63 在 HGECs 和 HIOECs 中的表达差异均无统计学意义( P = 0. 245、P = 0. 439) ,但基因 p63 在 HaCaT 中的表达远远高于 K-hESCs( P =0. 036) ; CK18 在 K-hESCs 中表达最高,但与HGECs、HIOECs、HaCaT 相比,差异并无统计学意义( F =0. 575,P =0. 640) ; CK14 在 HGECs 中表达最高,与 K-hESCs 相比差异有统计学意义( P <0. 001,且其在 HIOECs 和 HaCaT 中的表达与 K-hESCs 相比差异亦有统计学意义( P =0. 001、P <0. 001) .

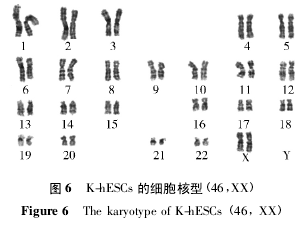
2. 3 二倍体检测K-hESCs 染色体核型为正常女性( 46,XX) ,无结构异常( 图 6) .
3 讨论
2006 年诱导多能性干细胞( induced pluripotentstem cells,iPS) 的出现被认为有巨大的潜在应用价值,在建立体外病理模型方面有一定的方便性,但与胚胎干细胞相比,iPS 要多经历分离、纯化、扩增、诱导去分化、筛选、建库、扩增等步骤才能诱导定向分化,这一体外过程复杂而漫长,细胞传代数过高对细胞的遗传稳定性、表观遗传特性和生物学特性都构成了极大的不稳定,iPS 细胞即被证明带有自身的表观遗传印记和端粒异常,有数百个基因存在异常表达[11 -13].本文旨在建立健康安全评价检测模型,对细胞本身的正常性要求较高,因此,认为胚胎干细胞较 iPS 更具优势。
上皮细胞主要包括上皮干细胞及其子代短暂扩充细胞、终末分化细胞。其中干细胞存在于上皮基底层,有无限的增殖潜能,正常情况下处于静止状态; 短暂扩充细胞具有低的自我更新能力和高的终末分化可能性,短暂扩充细胞仅分裂增殖 3 ~5 次即到终末分化状态。
处于不同分化阶段的细胞具有不同的表型。β1 整合素( integrin-β1) 的表达是维持角质形成细胞未分化状态所需要的,β1 整合素可以区分角质形成细胞干细胞和短暂扩充细胞。Michel 等[14]对 CK19和 β1 整合素进行研究后提出,细胞经染色后,若CK19 和 β1 整合素同时呈阳性且具有未完全分化状态特征的干细胞,则可视为角质形成细胞的祖细胞。P63 主要与上皮细胞的分化和增殖有关,之前被认为是干细胞标志物,但最近的研究表明,P63 在体内不仅表达于基底层而且还表达于基底上层,即表达于正在增殖的和有增殖能力的细胞[15],因此推断 P63 更应该是短暂扩充细胞而非干细胞标志物[16 -18].CK18 在细胞进入分化和复层前,持续地在单层细胞中表达,有些细胞 CK18 的表达下调被CK14 取代[19].CK14 早期表达时可作为复层细胞的基底细胞标志物表达于单层细胞上[19].CK10 通常表达于角化复层鳞状上皮的基底上层,即终末分化时将要角化的细胞,为角化标志,其表达与上皮细胞角化状态密切相关。低相对分子质量 CK( AE1)对腺上皮表达敏感性较高,高相对分子质量 CK( AE3) 对鳞状上皮表达敏感性较高。
本研究诱导 hESCs 分化而成的 K-hESCs 呈现正常的 46 条女性染色体核型。Real-time PCR 检测结果表明,在基因水平上,单层上皮干细胞标志物CK18、短暂扩充细胞标志物 p63 的表达呈现先上升后下降的趋势,复层上皮基底层标志物 CK14 呈现先稍微降低后上升的趋势,提示 K-hESCs 经历了由hESCs 向单层上皮干细胞分化继而转向复层上皮终末分化发展的趋势。免疫组织化学染色显示,K-hESCs 在分化过程中,CK18、P63 表达先上升后下降,CK14 表达增加,与基因水平一致; 此外,单层细胞表皮干细胞标志物 CK19、β1 整合素的表达增高,间充质细胞标志物( 上皮干细胞标志物) 波形蛋白( VIM) 及角化标志物 CK1、CK10 的表达增高,可以推断 P1 代第 7 天时 K-hESCs 正处于角化细胞祖细胞阶段,其鳞状上皮标志物 AE3 的免疫组织化学表达高于腺上皮的标志物 AE1 的表达,提示所得角化细胞祖细胞更偏向于鳞状上皮细胞的祖细胞。
Real-time PCR 检测结果显示,P1 代第 7 天时K-hESCs 上皮干细胞标志物 CK18 的基因表达与 HGECs、HIOECs、HaCaT 相比差异无统计学意义( P >0. 05) ,而复层上皮细胞基底层标志物 CK14 的表达显著低于 HGECs、HIOECs、HaCaT( P < 0. 01) ,提示 P1 代第7 天时 K-hESCs 处于未完全成熟阶段。
P1 代第 7 天时 K-hESCs 的 p63 表达与 HGECs 及HIOECs 差异无统计学意义( P > 0. 05) ,而与 HaCaT有明显差异 ( P < 0. 01) ,提示 P1 代第 7 天时K-hESCs可能更偏向于将来分化为口腔黏膜上皮。
综上,本研究可在体外有效诱导 hESCs 分化为上皮样角质形成细胞 K-hESCs,诱导所得 P1 代第 7天时的 K-hESCs 具有正常核型,类似于单层鳞状上皮干细胞向终末分化初始阶段的角质形成细胞,该阶段细胞由上皮干细胞静止状态被激活,处于分化初始高增殖活力阶段,有望作为口腔临床药物的毒理检测模型。
参考文献
[1] Rolletschek A,Blyszczuk P,Wobus AM. Embryonic stem cell-derived cardiac,neuronal and pancreatic cells as model systems tostudy toxicological effects[J]. Toxicol Lett,2004,149 ( 1 - 3 ) :361 - 369.
[2] Amit M,Carpenter MK,Inokuma MS,et al. Clonally derived hu-man embryonic stem cell lines maintain pluripotency and prolifera-tive potential for prolonged periods of culture[J]. Dev Biol,2000,227( 2) : 271 - 278.
[3] Thomson JA,Itskovitz-Eldor J,Shapiro SS,et al. Embryonic stemcell lines derived from human blastocysts[J]. Science,1998,282( 5391) : 1145 -1147.
[4] Laustriat D,Gide J,Peschanski M. Human pluripotent stem cellsin drug discovery and predictive toxicology[J]. Biochem SocTrans,2010,38( 4) : 1051 - 1057.
[5] Iuchi S,Dabelsteen S,Easley K,et al. Immortalized keratinocytelines derived from human embryonic stem cells[J]. Proc NatlAcad Sci U S A,2006,103( 6) : 1792 - 1797.
[6] Metallo CM,Ji L,de Pablo JJ,et al. Retinoic acid and bone mor-phogenetic protein signaling synergize to efficiently direct epithelialdifferentiation of human embryonic stem cells[J]. Stem Cells,2008,26( 2) : 372 - 380.
[7] 张志愿,帕提曼·司地克,曹俊,等。 16 型人乳头状瘤病毒 E6、E7 诱导的人永生化口腔上皮细胞系的建立[J]. 中华口腔医学杂志,2002,37( 1) : 12 -14.
不能产生动作电位的非可兴奋细胞(血液细胞、上皮细胞、结缔组织、骨骼、肿瘤细胞等)接受宽频电场作用后,细胞可产生极化的被动响应,即频域细胞被动电特性(passiveelectricalpropertiesofcells)。细胞电阻抗、膜电容、电导率、电阻率、介电常数等均...
越来越多学者认为心肌细胞凋亡在心脏相关性疾病中起到至关重要的作用。;因此,中医药成为探讨和研究抗心肌细胞凋亡的热点,而且愈来愈受到临床重视。...
诱导性多能干细胞(inducedpluripotentstemcells,iPSC)是利用基因工程技术将动物或人的体细胞重编程而得到的一种类似胚胎干细胞(embryonicstemcells,ESC)的多能干细胞类型[1].本研究小组前期研究发现,维甲酸能诱导iPSC分化成神经细胞,并且能形...
人与动物的肠道是一个营养丰富的环境,由大量复杂的微生物聚集而成,其中包括大量益生菌(probiotics bacteria)。益生菌是通过定殖在人体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物。...
辅助性T(T helper,Th)淋巴细胞亚群是机体适应性免疫系统的关键组分,包括了在分子特征、产细胞因子、效应功能及组织分布上有所差异的一群细胞。...
本文将对线粒体在脓毒症心肌细胞凋亡中的作用机制做一综述,以期为后续更深入的研究提供一定的理论依据。...
星形胶质细胞(astrocytes,AS)是中枢神经系统(central nervous system,CNS)中最丰富的胶质细胞类型,具有提供营养物质、调节细胞外离子浓度、协助神经元代谢等多种神经支持功能。...
间充质干细胞(Mesenchymalstemcells,MSCs)是成体干细胞的一种,具有多向分化潜能。来源广泛,可从多种组织中分离得到,易于体外扩增培养,应用不涉及伦理问题,副反应少,安全性较高,在组织修复和再生方面的临床应用前景广阔。目前间充质干细胞已用于...
CAF-1主要功能是在DNA复制中与增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)相互作用,负责募集组蛋白 H3、H4 沉积在新合成的DNA 上以促进核小体装配。...
细胞衰老是生物界普遍存在的现象。肿瘤细胞是一类摆脱细胞周期束缚,突破Hayflick界限,能够无限增殖而不衰老的细胞。...