
1 引言
中药是我国传统医学的有益组成部分,是抗肿瘤制剂的重要来源。很多中药药物是由中药粗提物制备而成,然而,中药粗提物大部分含有成百上千种类型、结构和含量不同的成分,其有效成分通过多成分、多靶点、多途径发挥药效。这给药物筛选带来了极大的困难,使抗肿瘤药物的筛选成为研究中药抗肿瘤过程的关键环节。目前,关于荧光蛋白、微管蛋白、G-蛋白偶联受体、细胞膜、活细胞等与生物活性成分作用的文献已有报道。值得关注的是,由于细胞更接近体内生理环境,基于细胞的药物筛选方法,具有特异性高、可操作性强、可高通量等优点,已被广泛应用于药物靶点确证、吸收、分布、代谢和毒性研究。另外,在药物筛选的不同阶段,已出现了基于活细胞的微型和纳米级的分析技术。
在体内环境下,所有的细胞均处于三维(3D)空间之中。二维(2D)培养的细胞,缺乏3D细胞支架来支持细胞生长和维持适当的组织功能,不能模拟体内微环境。3D培养的细胞,可以重现细胞-细胞和细胞-基质之间的相互作用,更能真实地反映细胞生长的微环境。在药物功效预测方面,一个更接近体内生理条件的体外模型能提供更可靠的数据。因此,细胞在3D条件下的响应更能代表其在体内条件下的响应,基于3D细胞的药物筛选方法将更有效。
本研究旨在利用3D细胞反应器模拟体内微环境,建立一种与肿瘤细胞作用的活性药物分子的筛选和分析方法:(1)利用本实验室自制的丝素蛋白/胶原蛋白/纳米羟基磷灰石(SCH)复合多孔支架,构建了一个3D细胞反应器;(2)将人结肠癌细胞系Lovo细胞动态接种和灌流培养于3D细胞反应器中的SCH复合多孔支架上,并完成药物-细胞相互作用;(3)富集药物细胞作用后的流出液,用HPLC分析检测,筛选与肿瘤细胞特异性结合的成分。结果表明,这一方法具有高效、简便等特点,可用于与细胞特异性结合成分的筛选和分析,以及中药中候选药物的筛选。
2 实验部分
2。1 仪器与试剂
XO-SM200超声微波联用仪(中国南京先欧仪器制造有限公司);Quanta200环境扫描电子显微镜(SEM,日本FEI公司);NikonTE2000倒置相差显微镜(IM,日本Nikon公司);LeicaTCSSP5激光共聚焦扫描显微镜(CLSM,德国Leica公司);LC-MS系统包括Agilent1100LC(美国Agilent公司)和BrukeQ6000MS(德国Bruke公司);冷冻干燥机(德国CHRIST公司);CO2孵育箱(德国Heraeus公司);SW-CJ-IF型超净台(中国苏州安泰空气技术有限公司);Millicell-PCF超纯水机(美国Millipore公司)。
胎牛血清、DMEM、胰酶和DMSO购于Sigma-Aldrich公司;戊二醛购于Amersco公司;乙腈、甲醇(HPLC级)购于FisherScientific公司;白藜芦醇、紫杉醇标准品购于中国药品生物制品检定所。
SCH复合多孔支架由本实验室自制;人结肠癌细胞系Lovo细胞购自中国典藏物培养中心(武汉);桃儿七购于西安药材市场,经陕西师范大学生命科学学院任毅教授鉴定。
2。2 药品供试液的制备
分别将白藜芦醇、紫杉醇、酮洛芬、青霉素G用DMSO溶解(DMSO最终浓度不能超过0。1%),经0。22μm滤膜过滤除菌后用PBS稀释至15mg/mL。
将桃儿七粉碎,过筛。用甲醇在微波功率400W,提取温度50℃条件下提取2次,每次15min。提取液经旋转蒸发仪浓缩后冷冻干燥,用DMSO溶解(DMSO最终浓度不能超过0。1%),经0。22mm滤膜过滤除菌后用PBS稀释至15mg/mL。
2。3 色谱分析
药物的HPLC分析在Shimadzu-10A液相色谱仪(主要由1个SPD-10AVP紫外检测器,2个10AVP泵,1个7725i进样阀,1个HT-220A柱温箱以及N2000工作站组成)上进行。色谱分离在AgilentSB-C18色谱柱上完成,检测条件如下:柱温25℃,流动相流速1。0mL/min,进样体积20mL。对于紫杉醇分析,流动相为乙腈(A)-水(B)(60:40),检测波长为227nm;对于白藜芦醇分析,流动相为甲醇(A)-0。5%甲酸水溶液(B)(45:55),检测波长为303nm;对于酮洛芬分析,流动相为乙腈(A)-0。02mol/LpH3。5KH2PO4水溶液(B)(60:40),检测波长为254nm;对于青霉素G分析,流动相为(A)-0。02mol/LpH2。5KH2PO4水溶液(B)(10:90),检测波长为220nm;对于桃儿七分析,流动相为乙腈(A)-0。04%甲酸水溶液(B),洗脱梯度为0~20min90%~77%B、20~40min68%B、40~65min59%B,检测波长为290nm。
采用Ultimate3000HPLC耦合maXisTMUHR-TOF质谱仪(含ESI源)对桃儿七提取液中的成分进行鉴定。质谱分析条件为:采用高纯氦气(99。999%)为碰撞气,高纯氮气(99。999%)为雾化气。分别采用正离子模式和负离子模式分析。质谱参数为:扫描范围m/z=120~1000,雾化气压力为0。8bar,干燥气流速为8。0L/min,干燥气温度为180℃,毛细管电压为4000V。
2。4 细胞悬液的制备
将Lovo细胞置于25cm2的细胞培养瓶中,用含10%(v:v)胎牛血清的DMEM细胞培养液在37℃、5%二氧化碳、95%相对湿度的二氧化碳培养箱中培养,每2天换液一次。待细胞长至80%汇合度时,使用胰蛋白酶消化液(含0。25%胰酶和0。04%EDTA)消化细胞,1200r/min离心3min,弃上层清液,加入适量培养液稀释细胞,得1×106个细胞/mL的细胞悬液。
2。5 3D细胞反应器的构建
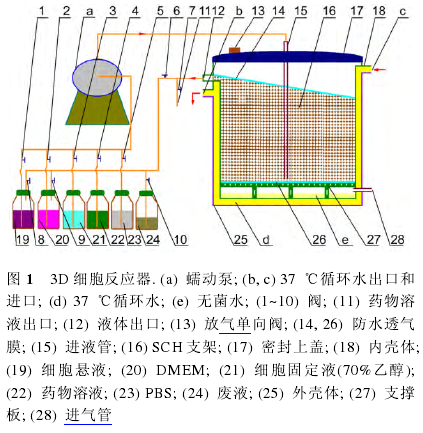
3D细胞反应器(图1)主要由具有30?斜坡的SCH复合多孔支架、反应器外壳体、反应器内壳体、密封上盖、支撑板、进气管、出气单向阀门、进液管、防水透气膜、出液管、蠕动泵、细胞悬液瓶、缓冲液瓶、细胞培养液瓶、废液瓶及阀门组成,通过Co60辐照灭菌。
在反应器外壳体内安装有反应器内壳体,反应器外壳体和反应器内壳体采用有机玻璃制成,形状为圆柱形。二者之间保持有间隙,形成水流通道,37℃的循环水从反应器外壳体与反应器内壳体之间的进水口进入,流经水流通道,从出水口流出。反应器外壳体的左侧下部安装有进气管,进气管插入到反应器外壳体内,进气管的内端伸入到反应器内壳体内的下部。
在反应器内壳体的上端通过螺纹连接安装有密封上盖,其上通过螺纹连接安装出气单向阀门。反应器内壳体的右侧有出液管,出液管的外端部为加工有孔的封闭管,出液管与反应器内壳体相连通。反应器内壳体内的下部安装有支撑板,支撑板上加工有通气孔,支撑板与反应器内壳体内底部之间保持一定的距离,形成气室。气室与进气管相连通,气室内底部装有用于提供湿度的无菌水,无菌的5%二氧化碳/95%空气的混合气可进入到气室内,从密封上盖上的出气单向阀门流出。支撑板上放置一张防水透气膜,用于通气和防止水流下。反应器内壳体防水透气膜上部装有SCH支架,支架的上表面也放置一张用于保湿通气的防水透气膜。进液管的下端插入到反应器内壳体内穿过SCH支架至下防水透气膜的上表面,进液管通过导管与蠕动泵的出口相连通,蠕动泵的进口通过安装在导管上的阀门与细胞悬液瓶、细胞培养液瓶、PBS瓶、细胞固定液瓶、药物溶液瓶等相连通,可将它们注入到SCH支架上并循环流动。废液通过安装在导管上的废液阀门与出液管相连通,废弃溶液经安装在导管上的废液阀门流入到废液瓶内。
2。6 药物-细胞相互作用
药物-细胞相互作用在图1所示的3D细胞反应器中进行,具体步骤如下:(1)动态接种。打开阀1、6和8,将细胞悬液以3mL/min的流速循环泵入支架,该过程持续20min以完成细胞接种,动态接种完成后,静置3h,使细胞在支架上黏附;(2)淋洗。打开阀2、6和10,将DMEM以1。5mL/min的流速泵入,以淋洗掉在支架上未黏附的细胞和黏附不牢固的细胞,这一过程持续到细胞反应器流出液中无细胞流出为止;(3)动态培养。打开阀2、6和9,将DMEM以1mL/min的流速泵入支架中,此过程保持24h,以完成细胞的动态培养;(4)药物-细胞相互作用。打开阀6、8和9,将药物溶液以1mL/min的流速泵入支架中,此过程保持3min,以确保药物和细胞完全接触,静置一段时间,完成药物和细胞的相互作用;(5)洗脱。打开阀7、10和11,将PBS以3mL/min的流速泵入支架中,将没有和细胞结合的药物洗脱出来。
将洗脱下来的药物富集到富集柱(C18Sep-Pak柱)上,再用色谱流动相将富集柱中富集的药物冲洗下来,用HPLC进行分析检测。将药物分别与活肿瘤细胞和固化细胞作用,在与固化细胞作用之前,需完成细胞固定化过程,打开阀3、6和10,将细胞固定液(70%乙醇)泵入淹没并浸泡支架30min。
2。7 不同培养方式对细胞形貌的影响
分别利用IM和E-SEM观察2D和3D培养的Lovo细胞形貌。对于E-SEM分析,分别于细胞接种后1、3和7d取出细胞/支架复合物,用PBS清洗支架3次,用2。5%戊二醛于4℃固定30min后,再用PBS清洗,用外科手术刀片切片,用体积分数为50%、60%、70%、80%、90%、95%、100%的乙醇梯度脱水(每个梯度脱水30min),喷金后用E-SEM观察。
3 结果与讨论
3。1 细胞在SCH支架上的形态

Lovo细胞在SCH支架上的形态如图2所示。由图2(a)可以看出,2D培养的Lovo细胞呈平面伸展状态。图2(b~d)表明,3D培养的Lovo细胞呈圆形、簇状均匀地分布在SCH支架上,并按支架的物理形状排列;支架上细胞密度随着培养时间的延长而明显增大,细胞表面的伪足和微绒毛均表明细胞生长状态良好。由于2D培养时细胞平铺在培养瓶或培养板上,没有传质的限制;而3D培养时,细胞培养基质对细胞营养物质的限制和细胞的异质性使3D培养具有传质局限性,不仅会得到增殖细胞和非增殖细胞,而且含有坏死细胞,这与实体瘤的多重表型相似。因此,3D培养更能模拟体内微环境。
3。2 可行性分析
根据药物-细胞的相互作用,可以将药物分为两类:与细胞结合的药物和与细胞不结合的药物。
其中,与细胞不结合的药物可以被收集到富集柱上,这些药物被认为没有抗癌作用;相应地,它们的生物指纹谱峰面积在与细胞结合前后几乎没有变化。与细胞结合的药物则不能被收集到富集柱上,它们的生物指纹谱峰面积会减小。药物与细胞的结合分为特异性结合和非特异性结合。由于细胞膜可以非特异性地结合一些药物,细胞培养支架也可能吸附一些药物,而这些非特异性的结合和吸附均会引起假阳性的结果。因此,将药物与固化肿瘤细胞作用作为对照,可以排除假阳性结果。特异性结合的成分可以通过比较药物与活肿瘤细胞和固化肿瘤细胞作用后的生物指纹谱峰面积而识别。这些特异性结合的药物的结合度可按下式计算:
结合度=(Af?Al)/Af×100%(1)式中,Al和Af分别为药物与活肿瘤细胞和固化肿瘤细胞作用后的生物指纹谱峰面积。
紫杉醇和白藜芦醇是抗肿瘤药物,具有抗人结肠癌的效果,选择为与Lovo细胞作用的抗肿瘤模型药物;酮洛芬和青霉素G是已知的非抗肿瘤药物,选择为不与Lovo细胞作用的非抗肿瘤模型药物。
紫杉醇和白藜芦醇与活肿瘤细胞作用后的生物指纹谱峰面积和与固化肿瘤细胞作用后的谱峰面积之间有显著性差异(P<0。05),根据式(1)计算,紫杉醇和白藜芦醇与Lovo细胞的结合度分别为64。8%±6。3%和81。7%±7。8%。而酮洛芬和青霉素G与活肿瘤细胞作用后的谱峰面积和与固化肿瘤细胞作用后的谱峰面积之间没有显著性差异(P>0。05)。
模型抗肿瘤药物和模型非抗肿瘤药物在与肿瘤细胞作用上的显著不同,证明该方法可用于筛选与细胞特异性结合的生物活性成分。
3。3 桃儿七活性成分的筛选与分析
将反应时间设定为45min,桃儿七提取物浓度设定为15mg/mL,研究桃儿七提取物与活肿瘤细胞和固化肿瘤细胞作用后的生物指纹谱峰面积,结果如图3所示。试验重复进行6次,结果表示为平均值±RSD%。
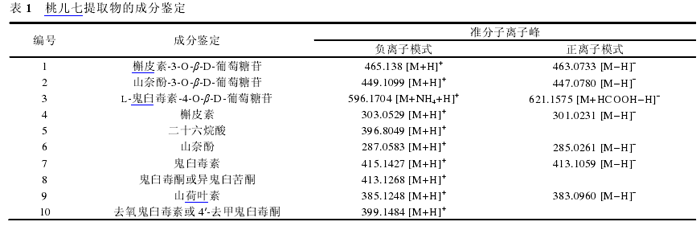
通过比较正离子模式和负离子模式的质谱数据以及参考文献资料,可以初步确定桃儿七中的10种组分(表1)。
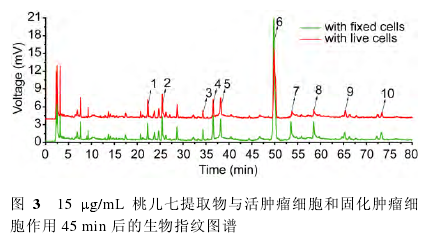
由于槲皮素-3-O-b-D-葡萄糖苷,山奈酚-3-O-b-D-葡萄糖苷和山荷叶素3种组分分别与活肿瘤细胞和固化肿瘤细胞作用后的生物指纹谱峰面积之间没有显著性差异(P>0。05),因此,可以认为它们与Lovo细胞没有特异性结合。而L-鬼臼毒素-4-O-b-D-葡萄糖苷、槲皮素、二十六烷酸、山奈酚、鬼臼毒素、鬼臼毒酮或异鬼臼苦酮和去氧鬼臼毒素或4′-去甲鬼臼毒酮7种组分分别与活肿瘤细胞和固化肿瘤细胞作用后的生物指纹谱峰面积之间具有显著性差异(P<0。05),说明这7种组分可以与Lovo细胞特异性结合,根据式(1)计算出它们的结合度分别为32。6%±3。1%、29。3%±3。0%、15。2%±1。7%、57。1%±4。8%、68。9%±9。2%、63。6%±8。7%和46。3%±4。8%。
4 结论
本文为从天然产物和植物药物中筛选抗癌候选药物提供了一个新的思路,建立了一种在模拟体内微环境下筛选和分析与肿瘤细胞特异性作用的活性成分的新方法,采用已知抗肿瘤药物和非抗肿瘤药物验证了方法的可行性。利用该方法从中草药桃儿七提取物中筛选出了7种能与Lovo细胞特异性结合的活性成分,这一亲和筛选方法还可用于从多组分复杂体系中筛选和分析与其他贴壁细胞特异性结合的活性成分。




